
Урок в 10 классе
Учитель Михайлов А.Е.

- Кислородсодержащие соединения.
- Спирты
а) Классификация.
б) Гомологический ряд спиртов
в) Изомерия спиртов
г) Физические свойства спиртов
д) Строение молекулы этанола
е) Химические свойства спиртов
- Метанол и этанол. Получение
- Действие на организм
- Применение спиртов
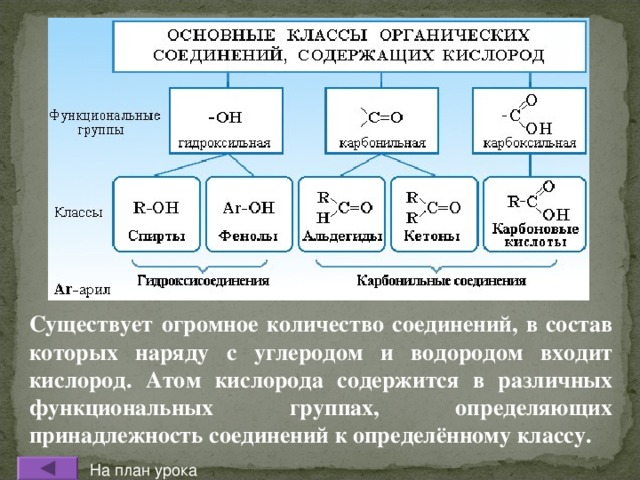
Существует огромное количество соединений, в состав которых наряду с углеродом и водородом входит кислород. Атом кислорода содержится в различных функциональных группах, определяющих принадлежность соединений к определённому классу.
На план урока

C x H y (OH) n
Спиртами называются органические вещества, молекулы которых содержат одну или несколько гидроксильных групп, связанных с углеводородным радикалом.
На план урока

Спирты можно классифицировать по разным признакам :
- по характеру углеродного радикала;
- по количеству гидроксильных групп;
- по характеру атома водорода, с которым связана гидроксильная группа
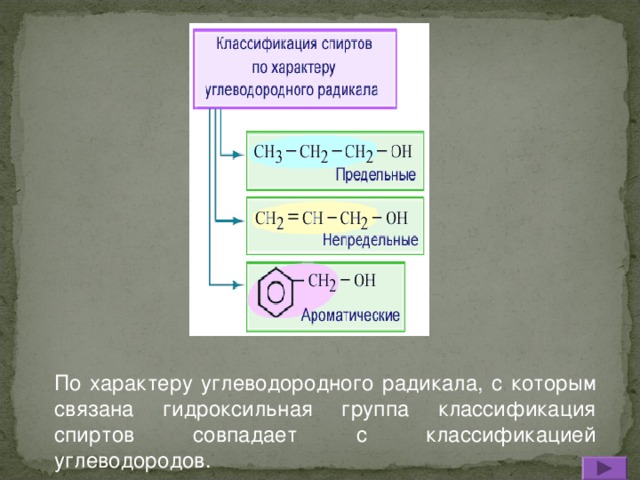
По характеру углеводородного радикала, с которым связана гидроксильная группа классификация спиртов совпадает с классификацией углеводородов.

Спирты различаются по числу гидроксильных групп, входящих в состав молекулы спирта. По этому признаку различают одноатомные, двухатомные, трёхатомные и многоатомные спирты.

Спирты различаются по характеру атома углерода, с которым связана гидроксильная группа. По этому признаку различают первичные, вторичные и третичные спирты.
На план урока

Гомологический ряд спиртов
Простейшими представителями спиртов являются предельные одноатомные спирты – алканолы.

Метиловый спирт
Этиловый спирт
Пропиловый спирт СН 3 -СН 2 -СН 2 -ОН - пропан ол
Бутиловый спирт СН 3 -СН 2 -СН 2 -СН 2 -ОН - бутан ол
Алканолы образуют гомологический ряд общей формулы C n H 2n+1 OH ( n= 1,2,3,: N) . Названия алканолов по систематической номенклатуре строятся из названий соответствующих алканов путём добавления суффикса «ол»
На план урока

Изомерия спиртов
Для алканолов характерны два вида изомерии:
1- изомерия положения гидроксильной группы в углеродной цепи

2- изомерия углеродного скелета.
Первым из спиртов, для которого характерны оба вида изомерии, является бутанол
На план урока

Физические свойства спиртов.
Алканолы являются бесцветными жидкостями или кристаллическими веществами с характерным запахом. Первые члены гомологического ряда имеют приятный запах, для бутанолов и пентанолов запах становится неприятным и раздражающим. Высшие алканолы имеют приятный ароматный запах.

Сравните температура кипения спиртов.
Название спирта
Метиловый
(метанол)
Формула
Температура кипения
СН 3 ОН
Этиловый
(этанол)
64,7
С 2 Н 5 ОН
Пропиловый
(пропанол)
78,3
С 3 Н 7 ОН
Бутиловый
(бутанол-1)
Амиловый
(пентанол-1)
С 4 Н 9 ОН
97,2
117,7
С 5 Н 11 ОН
Гексилдовый
(гексанол-1)
137,8
С 6 Н 13 ОН
Гептиловый
(гептанол-1)
157,8
С 7 Н 15 ОН
176,3

Высокая температура кипения спиртов объясняется значительным межмолекулярным взаимодействием – ассоциацией молекул, возможность которой объясняется полярностью связи О–Н и неподелёнными электронными парами атомов кислорода. Такое взаимодействие называют водородной связью
Водородная связь – это связь между атомом водорода одной молекулы и атомами с большой электоотрицательностью ( О, F , N , Cl ) другой молекулы.

Водородные связи могут устанавливаться и между молекулами спирта и воды. Именно этим объясняется растворимость спиртов в отличие от углеводородов. Но растворимость спиртов в воде разная. Первые три спирта растворяются полностью, а бутиловый и амиловый растворяются в меньшей степени. Понижение растворимости спиртов объясняется тем, что чем больше углеводородный радикал в молекуле спирта, тем труднее гидроксильной группе удержать такую молекулу в растворе за счёт образования водородных связей.
Опыт.
На план урока

Н Н
| | δ -
Н – С – С О Н
| |
Н Н
Строение молекулы этанола
В молекуле этанола атомы углерода, водорода и кислорода связаны только одинарными - связями. Поскольку электроотрицательность кислорода больше электроотрицательности углерода и водорода, общие электронные пары связей С – О и О – Н смещены в сторону атома кислорода. На нём возникает частичный отрицательный, а на атомах углерода и водорода частичные положительные заряды.

Атом кислорода образует ковалентные связи с другими атомами под некоторым углом, а не по прямой линии

Классификация спиртов
1.
Номенклатура спиртов
2.
Изомерия спиртов
3.

 Получите свидетельство
Получите свидетельство Вход
Вход











 Урок по теме "Спирты" 10 класс (801.84 KB)
Урок по теме "Спирты" 10 класс (801.84 KB)
 0
0 2819
2819 440
440 Нравится
0
Нравится
0



