
«Продолжай успешно идти по дороге, на которой хорошо начал свой путь» (Из античной мудрости)

Классная работа.
Основания.

План изучения темы:
- Состав, названия и определение оснований.
- Классификация оснований.
- Физические свойства оснований.
- Химические свойства оснований.

Страна
Оснований
раздел Воспоминаний (состав, названия и определение оснований)

Основания
– это сложные вещества, состоящие из атома металла и одной или нескольких гидроксогрупп.

Состав оснований: Назовите составные части оснований.
Валентность гидроксогруппы (ОН) – I Количество гидроксогрупп определяется валентностью металла, образующего основание.
Ме(ОН) х

Выберите формулы оснований. Назовите их.
НС l, NaOH, Na 2 O, Ca(OH) 2 , H 2 SO 4 , P 2 O 5 , Fe(OH) 3 , MgO , C и (OH) 2

Основания
NaOH – гидроксид натрия
Ca(OH) 2 – гидроксид кальция
Fe(OH) 3 – гидроксид железа ( III )
C и (OH) 2 – гидроксид меди ( III )
Найдите ошибку!

Страна
Оснований
раздел Классификаций
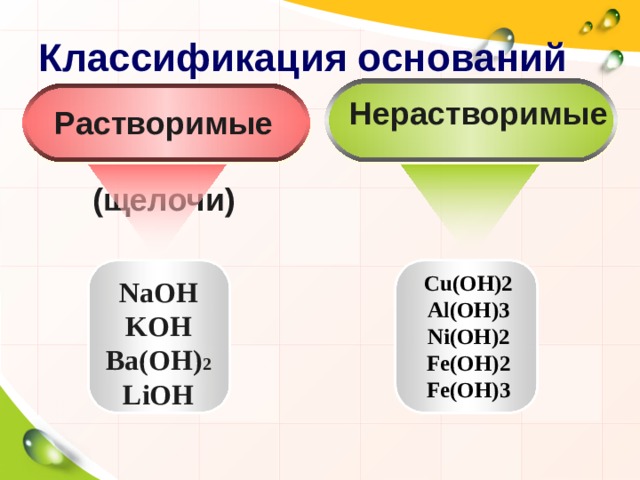
Классификация оснований
Нерастворимые
Растворимые
(щелочи)
Cu(OH)2
Al(OH)3
Ni(OH)2
Fe(OH)2
Fe(OH)3
NaOH
KOH
Ba(OH) 2
LiOH

По какому признаку основания разделены на группы?
?
?
?
Al(OH)3
Fe(OH)3
Cu(OH) 2
Ba(OH) 2
Pb(OH) 2
Fe(OH) 2
NaOH
KOH
LiOH
С sOH
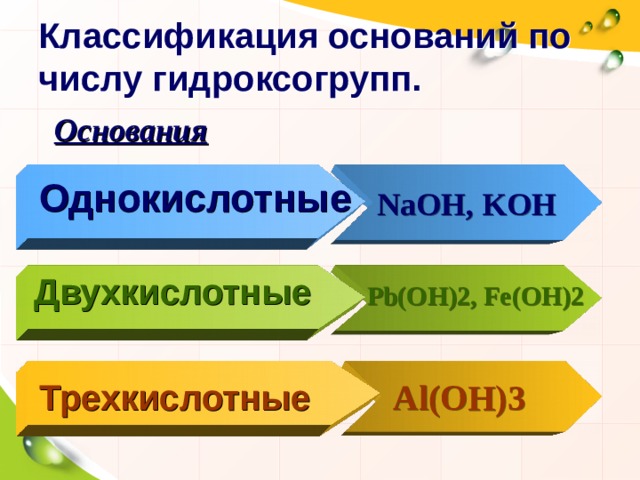
Классификация оснований по числу гидроксогрупп.
Основания
Однокислотные
NaOH , KOH
Двухкислотные
Pb(OH)2 , Fe(OH)2
Трехкислотные
Al(OH)3

Страна
Оснований
раздел Физический (свойства)

Физические свойства оснований
КОН
Агрегатное состояние:
Все твердые вещества
- Цвет кислот :
Белого – КОН ,
Голубого - Cu(OH) 2
Красно-бурого - Fe(OH) 3
- Запах – ?
- Вкус – ? (горький, солоноватый)
- Растворимость в воде - ?
Cu(OH)2

Физкультминутка

Страна
Оснований
раздел Химический (свойства)

Самостоятельная работа с учебником с.172 (табл. 17).

Химические свойства нерастворимых оснований.
1). Разлагаются при нагревании.
2). Взаимодействуют с кислотами (реакция нейтрализации).

1. Термическое разложение нерастворимых оснований:

2. Основание + кислота:
Реакция нейтрализации – это…

Химические свойства щелочей.
1). Изменяют окраску индикаторов.
Взаимодействуют с:
2). кислотами (реакция нейтрализации),
3). кислотными оксидами,
4). солями.

ПРАВИЛА БЕЗОПАСНОСТИ
Попавшие на кожу капли раствора щелочи немедленно смойте сильной струей холодной воды, а затем обработайте поврежденную поверхность 1% раствором уксусной кислоты.
Едкое вещество—щелочь! Разрушает и раздражает кожу, слизистые оболочки.
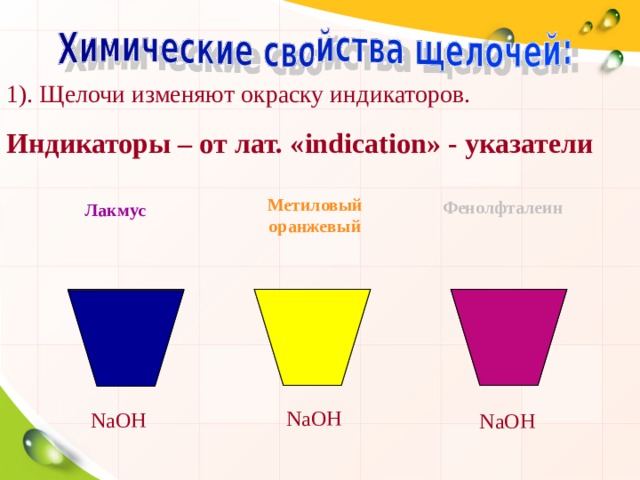
1). Щелочи изменяют окраску индикаторов.
Индикаторы – от лат. « indication » - указатели
Метиловый оранжевый
Фенолфталеин
Лакмус
NaOH
NaOH
NaOH

- Щелочь + кислота :
Ва(ОН) 2 + 2НС l = ВаС l 2 + 2Н 2 О
хлорид бария

3. Щелочь + кислотный оксид :
В ходе реакции образуется соль и вода
Для написания реакции необходимо знать,
какая кислота соответствует кислотному оксиду.
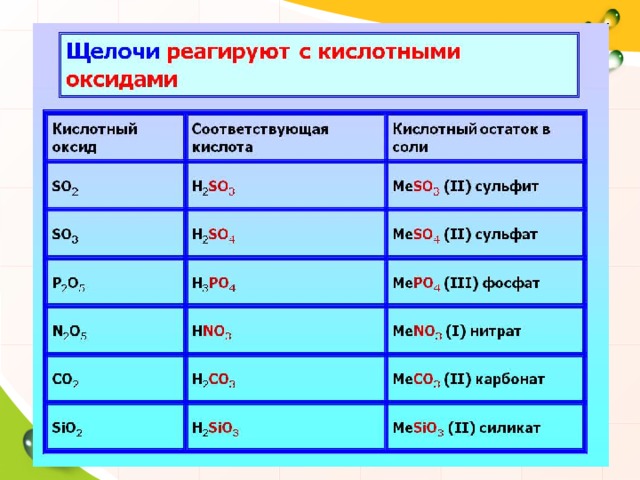

4. Щелочь + соль =
Условия протекания реакции: 1). исходные вещества должны быть растворимыми 2). образование осадка

Минута истории
Какие основания получили алхимики?

Выполните задание. Допишите уравнения реакций. Назовите вещества.
2 ВАРИАНТ
1). К OH + HNO 3 =
2). KOH + N 2 O 5 =
3). KOH + Cu(NO 3 ) 2 =
4). KOH + лакмус =
5). Pb(OH) 2 =
1 ВАРИАНТ
1). NaOH + H 2 SO 4 =
2). NaOH + SO 3 =
3). NaOH + CuSO 4 =
4). NaOH + фенол-фталеин =
5). Mg(OH) 2 =
t
t

Кто может о своей работе на уроке сказать:
«Я сегодня на уроке не работал, отдыхал!»?

Кто может о своей работе на уроке сказать:
«Я сегодня на уроке не все понял, потому что…»

Кто может о своей работе на уроке сказать:
«Я сегодня на уроке хорошо поработал! Все понял, потому что…»

Д/З § 39, у. 2, 5,

Спасибо за урок!

 Получите свидетельство
Получите свидетельство Вход
Вход











 Урок по теме : "Основания" (2.01 MB)
Урок по теме : "Основания" (2.01 MB)
 0
0 256
256 16
16 Нравится
0
Нравится
0







