Цель: Обобщение и систематизация знаний учащихся по теме «предельные и непредельные углеводороды»
Задачи:
Повторить, обобщить и систематизировать общие сведения о предельных и предельных углеводородах.
Развивать умения и навыки учащихся применять полученные знания на практике.
Развивать интерес к химии через решение нестандартных заданий.
Ход урока.
I. Организационный момент. «Обобщение – это, вероятно, самый легкий и самый очевидный путь расширения знаний», - сказал один из великих людей.
II. Обобщение темы «Предельные и непредельные углеводороды».
Задание 1. У каждого на парте приготовлены 8 химических уравнений реакции.
А. 2CH3I + 2Na → СH3–CH3 + 2NaI
Б. CH3–CH3 + HNО3 → CH3–CH3NО2 + Н2О
В. CH2=CH–CH3 + HBr → CH3–CHBr–CH3
Г. CH2=CH2 + H2O → CH3CH2OH
Д. 2СН3–СН2ОН → СН2=СН–СН=СН2 + 2Н2О + Н2
Е. СН≡СН + Н2О → СН3–HСO
Ж. 3CH≡CH → С6Н6
З. СН2=СН–СН3=CН2 + Н2 → СН3–СН2–СН3
Задания:
1. Выберите реакцию, которая протекает по правилу Марковникова.
2. Найдите реакцию гидратации.
3. Выберите реакцию, которую впервые применил Лебедев.
4. Среди реакций выберите реакцию Вюрца.
5. Поднимите реакцию Коновалова.
6. Среди реакций найдите реакцию Кучерова.
7. Найдите реакцию Зелинского.
8. Последнюю реакцию назовите сами.
Задание 2. Назовите вещества. Составьте структурные формулы.
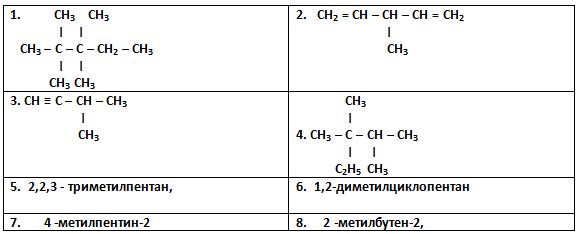
Задание 3. Химическая сказка. «Удивительное превращение».
Шел по улице Метан. И вдруг среди бела дня на него набросился грабитель по кличке Хлор. Между ними завязалась драка, в результате которой оторвали они друг у друга по одному атому. Увидел драку проходивший мимо почтенный Натрий и сгоряча схватил потерпевшего, да так крепко, что у того в глазах раздвоилось. А грабителя и след исчез.
Спросил Натрий имя у потерпевшего, а тот ответил: «Этан». Почему изменил имя потерпевший? Напишите уравнения реакций.
Задание 4. Вопрос - ответ.
1. Реакция присоединения водорода.
2. Реакция присоединения воды.
3. Реакция отщепления воды.
4. Реакция отщепления водорода.
5. Органические соединения, состоящие из двух элементов – углерода и водорода
6. Углеводороды с общей формулой СnН2n+2
7. Углеводороды с общей формулой СnН2n, в молекулах которых имеется одна двойная связь 8. Углеводороды с общей формулой СnН2n - 2 c одной тройной связью
9. Реакция взаимодействия этана с хлором относится к реакциям?
10. Реакция взаимодействия этена с хлором относится к реакциям?
11. Историческое название предельных углеводородов атомы углерода в которых замкнуты в цикл?
12. Наука, изучающая соединения углерода и водорода
Задание 5. Восстановите уравнения реакций, написанные на них, добавив левые части уравнений.
→2СО2 + 2Н2О
→ СН2Сl – СН =СН2 – СН2Сl
→ СН2=СН2 + Н2↑
→ СН3 – СН2Сl
→СНВr =СНВr
III. Подведение итогов урока.
IV. Домашнее задание.
Решить задачу.
Массовая доля элементов углеводорода составляет 92, 31% углерода и 7, 69% водорода. Плотность паров по водороду 39. (С6Н6)
Органическое вещество содержит углерод (массовая доля 84, 21%) и водород (15, 79%). Плотность паров вещества по воздуху составляет 3, 93. Определите формулу этого вещества. (C8H18).

 Получите свидетельство
Получите свидетельство Вход
Вход











 Урок химии «Предельные и непредельные углеводороды» (25.04 КB)
Урок химии «Предельные и непредельные углеводороды» (25.04 КB)
 0
0 1764
1764 236
236 Нравится
0
Нравится
0






