УРОК ХИМИИ В 9 КЛАССЕ
«Д.И. МЕНДЕЛЕЕВ
И ЕГО
ПЕРИОДИЧЕСКИЙ
ЗАКОН»
Учитель химии
МКОУ « ДубровскаяСОШ
Маркаданова Н.Н.
2013год
Урок по теме « Д.И. Менделеев и его периодический закон» проведен в 9 классе общеобразовательной школы в форме устного журнала. Класс среднего уровня усвоения знаний и среднего уровня воспитанности .Учащиеся не плохо усваивают материалы уроков, проводимых в нестандартной форме. Поэтому была выбрана такая форма проведения урока обобщения и повторения знаний за курс 8 и 9 классов.
Задачами урока было :
- развитие умений сравнивать , классифицировать , обобщать изученные факты и понятия , устанавливать причинно- следственные связи и применять их в новых ситуациях ;
-контроль усвоения основных знаний , умений и навыков ,сформированных по теме «Периодический закон и периодическая система Д.И.Менделеева »за курс 8 и 9классов;
- формирование такого мировоззренческого понятия как познаваемость мира и природы.
Тема урока : Д.И. Менделеев и его периодический закон
Цели урока: -обобщение сведений учащихся о периодическом законе
Д.И.Менделеева ;
-продолжать развитие познавательного интереса к предмету;
навыков работы с дополнительной литературой , с компьютером;
навыков самостоятельной работы , работы с тестами ,
кроссвордами ;
- формирование у учащихся научного мировоззрения , нравственных
качеств личности , взглядов и убеждений; воспитание чувства гордости
за научное наследие ученого
Оборудование : дискета с презентацией, плакат с
девизом урока, портрет Д.И. Менделеева, таблица«Периодическая
система Д.И. Менделеева», компьютер, мультимедийный проектор,
тестовые задания, карточки задания , плакаты с кроссвордами .
Фома проведения урока: устный журнал
Девиз урока : 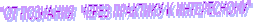
План урока

1

1.Вступление учителя :В начале урока учитель говорит о том , что сегодня предстоит обобщить знания , которые учащиеся получили за весь предшествующий период обучения химии по Периодическому закону .Его существенная особенность состоит в том , что он в отличие от некоторых других фундаментальных законов природы не может быть записан в виде какой либо математической формулы или уравнения , а имеет наглядное графическое изображение в форме Периодической системы химических элементов. Периодический закон и периодическая система являются основой современной химии. Они относятся к таким научным законам , которые реально существуют в природе и поэтому никогда не потеряют своего значения.
Затем учитель знакомит учащихся с формой проведения урока (Устный журнал) и
раскрывает страницы журнала , объясняя как будет проходить урок .
Предоставляется слово для сообщения учащемуся на тему :
«Дмитрий Иванович Менделеев и его Периодический закон», где ученик использует свою презентацию и сообщение к ней ( приложение №1).

2
Предлагаю учащимся провести страницу « Практическую » и выполнить ряд заданий. Форма работы: работа в экипажах. Работа в экипажах позволяет учащимся работать в группе , разобрать неясные вопросы .Группы подбираются по 2-3 человека , один из них более сильный ученик по предмету, способный ответить на все вопросы . Учитель выступает в роли консультанта. Учащиеся должны выполнить все задания и работать на результат ( присутствует соревновательный момент).
Учащиеся в экипажах выбирают командира и выбирают карточки для работы. Предложены карточки « Все-все», « Командир»,
« Делегат», « Выбор».
Учащиеся , работающие с карточкой «Выбор»,выполняют все задания совместно и учитель спрашивает по своему выбору учащегося группы на любой вопрос, который учащийся отвечает у доски.
КАРТОЧКА « ВЫБОР»
Какие группы сходных химических элементов вы знаете ? ( ответ обоснуйте)
Сравните свойства галогенов и щелочных металлов.
Почему Na, Li,K относят к группе щелочных металлов?
Почему Cl,Br, I, F относят к одной группе? Какой ?
Какова современная формулировка Периодического закона?
Учащиеся , работающие с карточкой « Все-все» готовят вопросы совместно и затем по очереди отвечают на них у доски.
КАРТОЧКА « ВСЕ-ВСЕ»
Запишите строение электронных оболочек у химического элемента с № 20
Объясните и приведите пример, как распределяются электроны вокруг ядра у химического элемента
Что вы можете сказать о химическом элементе № 5.( дать характеристику элемента по положению в П.С.)
Определите число р1 и n0 у химического элемента № 2 .
Учащиеся , работающие с карточкой « Командир « , разбирают вопросы совместно и затем на самый сложный вопрос отвечает у доски командир.
КАРТОЧКА « КОМАНДИР»
У себя на столе распределите карточки химических элементов в порядке
увеличения относительных атомных масс.( Ar)
Разместите химические элементы по сходным свойствам в одну группу.
Объясните как изменяются свойства металлов и неметаллов с возрастанием Ar слева направо , сверху вниз?
С чем связано изменение свойств химических элементов?
Учащиеся , работающие с карточкой « Делегат» , разбирают вопросы совместно и выбирают делегата , который будет отвечать у доски на один из вопросов.
КАРТОЧКА « ДЕЛЕГАТ»
Почему неприемлема классификация химических элементов на металлы и
неметаллы ?
Чем верна современная формулировка Периодического закона?
Каков физический смысл порядкового номера ?
Напишите схему строения электронных оболочек у атома № 13
Работу учащихся у доски учитель оценивает совместно с учащимися .
Далее переходим к тестовой работе .Тестирование позволяет выяснить степень усвоения знаний по теме.
Тестирование с целью проверки усвоения знаний.
Вещества со свойствами как металлов так и неметаллов
*а)обладают амфотерными свойствами
б).обладают кислотными свойствами
в).обладают основными свойствами
2. Элемент с № 2 имеет строение
а).1s 12s 2
б).1s 22s 1
*в).1s 2
3. Элемент 1s 22s 2 2 p 2 имеет номер
а).5
* б).6
в).2
4. Физический смысл порядкового номера
а).основная характеристика химического элемента
* б). это заряд ядра
в). это число нейтронов
5. Химический элемент это
*а). вид атомов
б). вид молекул
в). химический знак
6. Верно ли , что химический элемент с № 15 имеет
а). 5 е
* б). 15е
в). 10е
7. У химического элемента № 10 электроны распределены на :
а).одном энергетическом уровне
б). на двух энергетических уровнях
* в). на трех энергетических уровнях
8. Элемент со строением +19 2е 6е 1е потерял своё место .Это
а). №10
б). № 1
*в). № 19
9. Формулировка Периодического закона связана с :
а). физическими и химическими свойствами элементов
*б). с зарядом ядра
в). с порядковым номером
10. Верно ли, что определить число е на энергетическом уровне можно по
следующей формуле
* а). 2n 2
б). 2n
в). 5n 2
Правильные ответы обозначены знаком « * »
И так как девизом урока являются слова - « От познания через практику к интересному », то это позволяет органически перейти к третьей странице.

3
Предлагаю ученикам решить кроссворды
Кроссворд-1
1. G a 2.





 3.
3.
4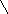 .2 F2 + 2 H2 O =4 HF + O2
.2 F2 + 2 H2 O =4 HF + O2


5. [ + 5 2 е 3 е ] 0
6.
| 2
| Li 3 | Be 4 | B 5 | C 6 | N 7 | O 8 | F 9 | Ne 10 |
Догадайтесь , что хотел изобразить автор кроссворда в своих заданиях , впишите в клетка п горизонтали полученные слова и по вертикали в выделенном столбце получите название определенного вида атомов с одинаковым зарядом ядра.
Ответы: 1 –галлий, 2- золото,3-вода, 4-фтор, 5-атом, 6-период, по вертикали слово- изотоп
КРОССВОРД-2
Скрылся из глаз необычный секрет
Букв кроме «О» в поле зрения нет
Букв кроме «О» в телескопы не видно
Ах! Как досадно ! Ох! Как обидно!
Элементов названья впиши ты в кружок !
Вот номера их 17, 27, 1, 50, 8, 76, 79, 7 –
удачи Дружок !!!
Ответы: 1.водород(№1), 2.-олово ( № 50), 3.-золото( №79), 4.- хлор ( № 17),
5.-кобальт ( № 27), 6. –азот( № 7), 7.- кислород ( № 8), 8.-осмий ( № 76)
Подводим итог урока. При подведении итога урока выясняем
- что было интересного? ,
- что запомнилось ?
- на что надо обратить внимание ?
- подводим результат тестовой работы и работы с
кроссвордами.
Урок прошёл, звенит звонок!
Пришла пора подвести итог.
Мы сегодня вместе с вами :
- У ученого в гостях побывали,
-В экипажах очень четко
все вопросы разобрали,
-И тестирование нам
оказалось по зубам,
-Изотопы разгадали ,
в облаках мы побывали
И скажу вам честно, честно-
было с вами интересно!
Приложение №1
Сообщение на тему :
« Д.И.Менделеев и его
Периодический закон»
В истории человеческих знаний немало подвигов. Но очень немногие из них можно сопоставить с тем , что сделано Дмитрием Ивановичем Менделеевым. Величие научного подвига Менделеева не только не стирается со временем , но продолжает расти. И никто не может сказать , будет ли когда-нибудь исчерпано до конца всё содержание одного из величайших в науке обобщений – периодического закона Д.И.Менделеева .
История строго и придирчиво отбирает и сортирует всё, что найдено и создано человеком .Поразительная , ставшая привычной четкость таблицы Менделеева наших дней скрывает от нас гигантскую работу ученого по созданию всего , что было известно до него о превращениях веществ , работу , благодаря которой стала осуществимой великая интуитивная догадка о существовании нового закона – закона периодичности свойств химических элементов.
Законы природы , открытые человеком , различны по объёму познанного и по тому , в каких областях познаний мира они действительны . Их трудно сравнивать между собой .Но законы сравнимы по самому главному – по возможности предсказания ,нового предвидения неизвестного. Периодический закон в этом отношении не имеет равных в истории науки .Менделеев указал путь направленного поиска в химии будущего. Многие ученые , основываясь на периодическом законе , предсказывали и описывали неизвестные химические элементы и их свойства
Дмитрий Иванович Менделеев родился в 1834 г. в г. Тобольске. После обучения в Тобольской гимназии он поступил в Петербургский педагогический институт , который окончил с золотой медалью.
Круг интересов Менделеева был разнообразен . Литературное наследие Менделеева огромно – полное собрание сочинений составляет 26 томов. К числу крупнейших работ ученого относятся исследования в области химической природы растворов , состоянии газов , теплоты сгорания топлива . Величайшим результатом творческой деятельнос-
ти , принесшей Д.И. Менделееву всемирную славу , было открытие им в 1869 году Периодического закона и Периодической системы химических элементов. За выдаю-щиеся заслуги Д.И.Менделеев был избран членом многих зарубежных академий .: Американской , Ирландской , Римской , Берлинской ,Бельгийской ,Датской Чешской , Краковской и др. Он был почетным доктором многих университетов , почетным членом многочисленных научных обществ.
В 1907 году в возрасте 73 года Д.И. Менделеев скончался от воспаления легких.
« Нашей стране нужны свои Менделеевы – великие ,
способные двинуть её вперед такими же гигантскими шагами ,
как это делал в свое время Дмитрий Иванович Менделеев. »
Что же было накануне открытия?
Было известно 63 химических элементов. Далеко не все свойства их были изучены, даже атомные веса некоторых не были определены.или неточно были определены. Много это или мало- 63 элемента ? Если учесть сколько мы сейчас знаем химических элементов –то мало . Но вполне достаточно , чтобы можно было подметить законо-мерности изменения их свойств. Открытие Менделеева оказалось своевременным. Так как и до него многие ученые пытались подчинить все известные химические элементы определенному порядку , классифицировать их, свести в систему .
Например в 1829г. немецкий химик Дёберейнер сгруппировал элементы со сходными химическими свойствами по тройкам : литий , калий , натрий , хлор, бром, йод
Он назвал эти группы т р и а д а м и.Позже эти группы стали именовать естественными семействами.
1849 г. классификацией элементов заинтересовался русский химик Г.И. Гесс. В учебнике « Основания чистой химии» он описывал группы элементов –неметаллов с похожими химическими свойствами.
I, Br, Cl , F ; C B Si ; N P As .
Гесс писал:« Эта классификация ещё очень далека от того , чтобы быть естественной , но она все таки соединяет элементы и группы весьма сходные , и с расширением наших сведений она может усовершенствоваться..».
Одну из попыток классификации сделал француз А.Бегье де Шанкуртуа .Систему элементов он представлял в виде спирали на поверхности цилиндра. каждом витке -16 элементов . Сходные элементы располагались друг над другом . Но никто из ученых не обратил внимание на работу де Шанкуртуа
Интересна классификация английского ученого Ньюлендса ( 1866г.) , по которой сходные элементы должны повторяться через семь элементов в ряду расположенные по возрастанию атомного веса .Однако при таком расположении в сходных группах оказывались такие элементы как углерод и ртуть.
Ближе других к истине оказались немецкий ученый Л.Майер и английский ученый
В .Одлинг. Ф 1864 г. Майер предложил таблицу химических элементов ,где элементы были разбиты на группы по 6 , согласно их валентности. Таблица напоминала Менделеевскую. Но она не содержала главного- общей закономерности изменения свойств элементов. Тот же недостаток был и у Одлинга.
Почему же Д.И. Менделееву удалось открыть Периодический закон ?
И как было сделано это открытие?
« Мир сложен .
Он полон событий , сомнений ,
и тайн бесконечных , и смелых догадок .
Как чудо Природы- является гений
И в хаосе этом наводит порядок …
Весь мир большой :жара и стужа ,
планет круженье , свет зари –
все то что видим мы с наружи,
законом связано внутри.
Найдем ли правило простое ,
что целый мир объединит ?
Таблицу Менделеев строит
Природы ищет Алфавит! …»
17 февраля 1869 г.( по старому стилю), собираясь в дорогу , профессор Петербургского университета Дмитрий Иванович Менделеев на обороте письма , в котором его проси ли приехать делает первый набросок таблицы химических элементов. В этой таблице он расположил химические элементы в порядке возрастания их атомных весов и проследил периодическую повторяемость их свойств.
Первое сообщение об открытии было сделано 6 марта 1869 г. на заседании русского химического общества . Менделеева на этом заседании не было . Вместо него его доклад читал химик Меншуткин Н.А.. За отсутствием автора обсуждение этого вопроса было отложено .
Менделеев видел три обстоятельства , которые по его мнению способствовали открытию периодического закона:
- были более или менее точно определены атомные веса большинства известных химических элементов
- появилось четкое понятие о группах химических элементов , сходных по свойствам
( естественных группах)
- к 1869 г. была изучена химия многих редких элементов, без знаний которой было бы трудно прийти к какому-либо обобщению
Наконец , решающим шагом к открытию закона явилось то , что Д.И. Менделеев сопоставил между собой все элементы по величине атомного веса.
Система элементов – это закономерность , выраженная в виде таблицы.
Сам Менделеев писал «… невольно зародилась мысль о том , что между массой и химическими свойствами необходимо должна быть связь…» И в самом деле нет ничего особенного в том , чтобы , написав на карточках символы химических элементов , их атомные веса и важнейшие свойства , расположить их по порядку по возрастанию атомных весов , начиная с самого легкого – водорода. Подметить же закономерность в изменении свойств правильно расположенных элементов , должно быть, не так уж трудно !
То кружились , то мелькали, то водили хоровод,
То взрывались , то пылали, то шипели,
То сверкали, то в покое пребывали –
Алюминий , Натрий , Калий ,
Фтор , Бериллий , Водород….
Перепутались все свойства –недалеко до беды .
Вдруг команда –Стройся войско !
Стали строиться в ряды.
Во втором ряду волненье : все бояться окисленья.
- Поглядите ! –злиться литий –
Фтор ужасный окислитель !
- Я не встану в этот ряд ! Пусть другие здесь стоят!
И Бериллий мрачно мыслит :- Кислород нас всех окислит!
- И простите за повтор -как несносен этот Фтор!
Бор кивает головой , но не рвётся сразу в бой !
И Азот не лезет в спор .
Но зато взорвался Фтор:
- Ах ! Так мы для вас не пара!
Кислород ! Поддай им жара!
- Окисляй ! За мной ! Вперёд!
-Стойте! –крикнул Углерод
- Я и уголь и алмаз! И за них я и за вас!
- Я сражаюсь не горю. Я вас лучше помирю!
Стану я посередине.
- Третий ряд! Трубите сбор! Натрий !Магний ! Алюминий!
Кремний ! Фосфор! Сера ! Хлор!
По порядку , по закону элементы встали в ряд .
И выходит , что в колонне все похожие стоят!
Кремний встал под Углеродом, Сера схожа с кислородом,
Алюминий встал под бор –замечательный подбор!
Ряды пристраиваются к ряду , а рядов то десять кряду.
Металлы под металлами, едкие под едкими ,
Ковкие под ковкими –идут своими клетками .
По порядку всё стоит .
Вот Природы Алфавит!!
Итак , в вертикальных рядах оказались химически сходные элементы .Металл литий схож по свойствам с натрием –оба режутся ножом , мягкие , бурно реагируют с водой , образуют щелочи. Бериллий схож с магнием, фтор схож с хлором- они образуют с металлами очень похожие соединения. И каждый химик знает , что сера и кислород похожи между собой. При таком расположении химических элементов совершенно четко проявилась периодичность свойств элементов.
В 1870 г. в первом издании « Основ химии » Д.И. Менделеев описывает второй вариант таблиц, названный « Естественная система элементов». Второй вариант позволил Менделееву предсказать существование неоткрытых ещё химических элементов , описать их свойства. В том же году ученый сформулировал , открытый им закон « Свойства простых тел, так же формы и свойства соединений элементов находятся в периодической зависимости от величины атомных весов элементов»
Твердо убежденный в естественности своей системы , в её научной правдивости Менделеев описывает свойства для трех предсказанных им элементов в виде примера.
-Я найду сначала свойства и поможет мне закон !
Удельный вес назвал и цвет, летуч на воздухе иль нет ,
Как плавится , в чем растворим ….законом пользуясь своим
ТРИ ЭЛЕМЕНТА предсказал ,как будто их в глаза видал!
Эти элементы были открыты позже . В 1875 г.-галий во Франции открыл ученый Лекок де Буабодран , предсказанный Менделеевым экаалюминий
« Ответ в Россию мчится :
-Прекрасная таблица ! Я Вами восхищен!
-Проверен мной практически Закон периодический ,
И я категорически приветствую Закон!»
В 1879 г.шведским ученым Л.Нильсоном открыт скандий. Когда были изучены его свойства , стало совершенно ясно , что это давно известный по предсказаниям Менделеева , экабор. Через 16 лет был открыт немецким химиком К.Винклером элемент названный германием.( менделеевский экасилиций)
Винклер писал: « Вряд ли может существовать более яркое доказательство справедливости учения о периодичности элементов , чем открытие до сих пор гипотетического экасилиция ; оно составляет , конечно , более чем простое
подтверждение смелой теории , -оно знаменует собою выдающееся расширение химического поля зрения , гигантский шаг в области познания..»
История химии не знает подобного триумфа. Закон Д.И. Менделеева оказал огромное влияние на развитие знаний о строении атома , о природе вещества .Открытие закона периодичности – величайшая веха в развитии химии. И как сказал Д.И. Менделеев :
« Периодическому закону не страшны разрушения , а только надстройки и развитие быть обещаются …»
13


 Получите свидетельство
Получите свидетельство Вход
Вход








 .2 F2 + 2 H2 O =4 HF + O2
.2 F2 + 2 H2 O =4 HF + O2











 Урок химии "Д.И. Менделеев и его периодический закон" (0.11 MB)
Урок химии "Д.И. Менделеев и его периодический закон" (0.11 MB)
 0
0 919
919 42
42 Нравится
0
Нравится
0


