
Углерод Оксиды углерода

Углерод

ряды
периоды
Группы элементов
VIII
VI
IV
I
V
III
II
VII
1
1
ХАРАКТЕРИСТИКА ЭЛЕМЕНТА
1
С+6 ) 2 ) 4 1 s 2 2s 2 2p 2
2
3
Углерод – основа всего живого на Земле.
Степень окисления в соединениях +4, +2, - 4.
4
2
2
12
3
3
4
4
5
+ 6
5
s
6
s
p
p
1
1
Е
7
Изолированное состояние
Возбужденное состояние
2
2
6
8
9
10
7
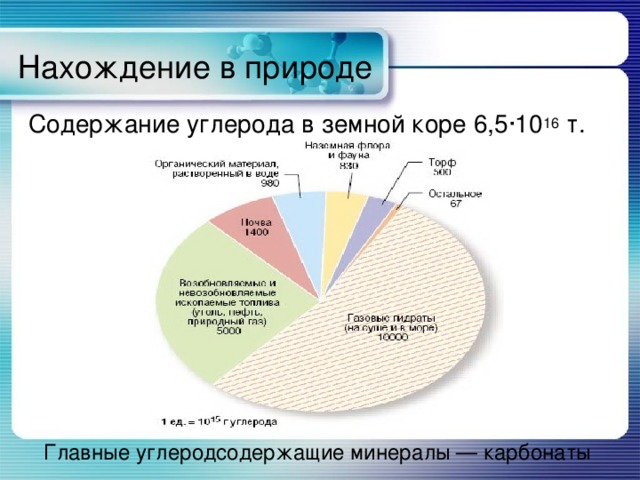
Нахождение в природе
Содержание углерода в земной коре 6,5·10 16 т.
Главные углеродсодержащие минералы — карбонаты

Физические свойства
Углерод образует несколько простых веществ. Среди них пока важнейшими считаются алмаз и графит, карбин, фуллерен.
а - кристаллическая решетка графита; б - кристаллическая решетка алмаза; в – линейная структура карбина
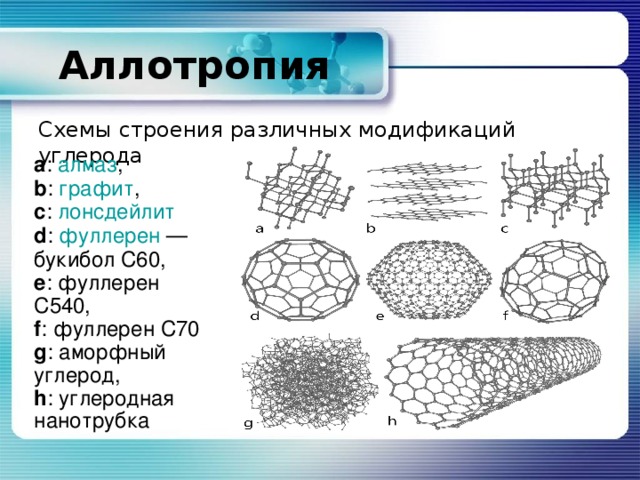
Аллотропия
Схемы строения различных модификаций углерода
a : алмаз ,
b : графит ,
c : лонсдейлит d : фуллерен — букибол C60,
e : фуллерен C540,
f : фуллерен C70 g : аморфный углерод,
h : углеродная нанотрубка

Алмаз
- Бесцветное кристаллическое вещество с атомной решеткой.
- Каждый атом углерода в алмазе окружен четырьмя другими, расположенными от него в направлениях от центра тетраэдра к его вершинам.
- Алмаз имеет высокую твердость, плохо проводит тепло и практически не проводит электрический ток.
- Это самое тугоплавкое природное вещество t пл =3730С.
- Его применяют как украшение, а также для резки стекла, бурения горных пород и шлифования особо твердых материалов.

Интересные факты о самых знаменитых алмазах
Одним из самых знаменитых драгоценных камней в мире является алмаз «Регент», он же «Питт».
По легенде, алмаз весом в 410 карат (82 грамма) нашел раб-старатель на руднике (р.Кришна). Он умышленно сделал на своей ноге рану и спрятал драгоценный камень в повязке. Индус доверился английскому капитану, который пообещал ему свободу от рабства взамен на алмаз.
Британец не сдержал своего слова, убив раба, завладел алмазом и продал камень индийскому торговцу. А тот, в свою очередь, британскому руководителю мадрасского отделения Ост-Индской компании Томасу Питту .

Самый древний алмаз
Индийский алмаз Кох-и-Нор ("Гора света") известен несколько тысячелетий. По преданию им владели последовательно 18 правителей Индостана. Сейчас бриллиант в 108,9 каратов - в Англии, в короне королевы Елизаветы II .

Самый крупный алмаз
Самым большим алмазом из известных в мире был "Куллинан" - 3106 каратов, подаренный в начале прошлого века английскому королю Эдуарду VII. После бриллиантовой огранки величиной в 530,2 карата - украсил скипетр короля Великобритании и хранится в лондонском Тауэре

Алмаз «Орлов» - подарок императрице
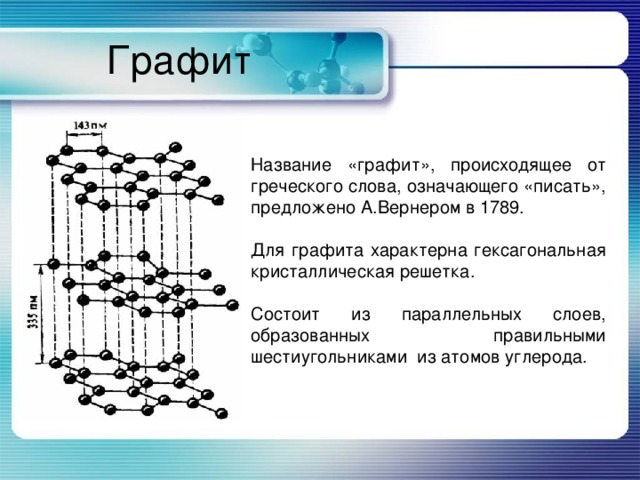
Графит
Название «графит», происходящее от греческого слова, означающего «писать», предложено А.Вернером в 1789.
Для графита характерна гексагональная кристаллическая решетка.
Состоит из параллельных слоев, образованных правильными шестиугольниками из атомов углерода.

Графит
- Жирное на ощупь вещество черного или серого цвета с металлическим блеском, тугоплавок, электропроводен, мягок, легко расслаивается.
- Из графита изготавливают огнестойкие изделия, устойчивые против действия щелочей и расплавленных систем; изготавливают электротехнические изделия, карандаши, краски, смазки, антифрикционные материалы и изделия.
- Графит применяется в атомной технике как замедлитель нейтронов, изоляционный материал
- Видоизменения графита, часто встречающиеся в природе- кокс, сажа. древесный уголь.
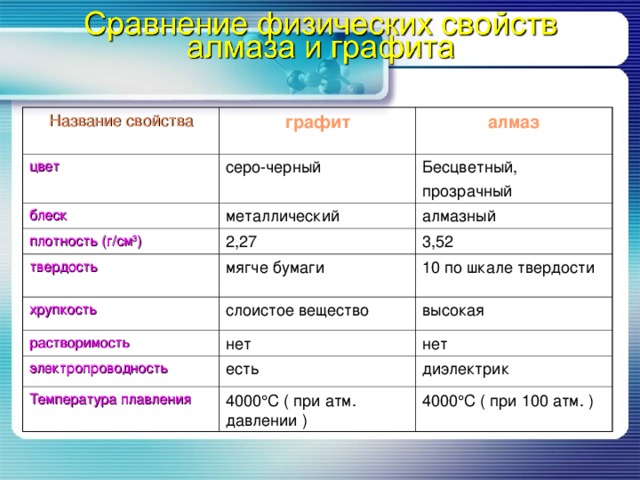
Название свойства
графит
цвет
алмаз
серо-черный
блеск
металлический
Бесцветный,
прозрачный
плотность (г/см 3 )
твердость
алмазный
2,27
мягче бумаги
3,52
хрупкость
10 по шкале твердости
слоистое вещество
растворимость
нет
высокая
электропроводность
нет
есть
Температура плавления
4000 С ( при атм. давлении )
диэлектрик
4000 С ( при 100 атм. )

Взаимопревращение алмаза и графита
t =2000 C без доступа воздуха
Алмаз
Графит
t =3000 C ,Р=50 тыс. атм.,
катализатор Ni
Алмазы, полученные искусственным путем из графита, мелкие, невысокого качества.
Их используют в основном для технических целей, а под названием фиониты – для ювелирных украшений.

Уголь
Уголь - аморфный углерод, по структуре напоминающий графит
При обработке его водяным паром поры и каналы угля, содержащие золу и поташ-карбонат калия, очищаются, площадь поверхности увеличивается. Такой уголь называется активированным.
Он обладает адсорбцией -способностью поглощать газы и некоторые растворенные вещества, удерживая их на своей поверхности.
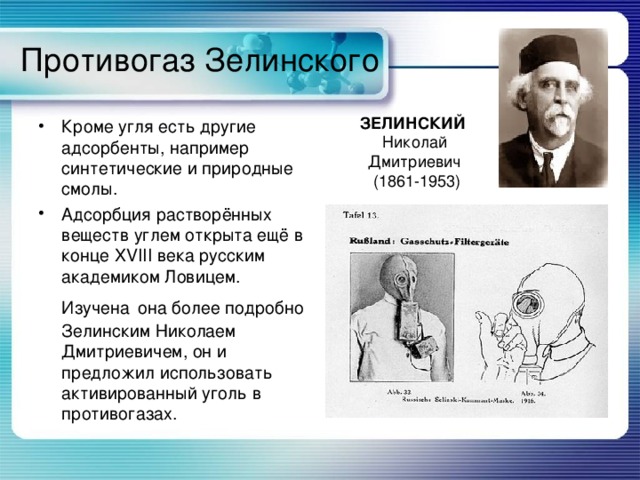
Противогаз Зелинского
ЗЕЛИНСКИЙ
Николай Дмитриевич
(1861-1953)
- Кроме угля есть другие адсорбенты, например синтетические и природные смолы.
- Адсорбция растворённых веществ углем открыта ещё в конце XVIII века русским академиком Ловицем. Изучена она более подробно Зелинским Николаем Дмитриевичем, он и предложил использовать активированный уголь в противогазах.

Химические свойства
Свойства окислителя:
- Свойства окислителя:
- Свойства окислителя:
- Свойства окислителя:
- Свойства окислителя:
а) с металлами образует карбиды
4 Al +3 C = Al 4 C 3 (при нагревании)
Из карбида алюминия получают метан Al 4 C 3 +12H 2 O = 4Al(OH) 3 + 3CH 4
Ca +2 C = CaC 2 ( при нагревании)
Из карбида кальция получают ацетилен CaC 2 + 2 H 2 O = Ca ( OH ) 2 + C 2 H 2
б) с водородом
С +2 H 2 = CH 4 (метан) ( при нагревании)

Свойства восстановителя:
в) восстанавливает металлы из их оксидов
CuO + C = CO 2 + Cu
г) горит в кислороде с выделением большого количества тепла
2 C + O 2 = 2 CO + Q
C + O 2 = CO 2 + Q

Применение
адсорбент
крем обуви
типография
сталь
сельское хозяйство
ювелирные изделия
топливо
медицина
резина
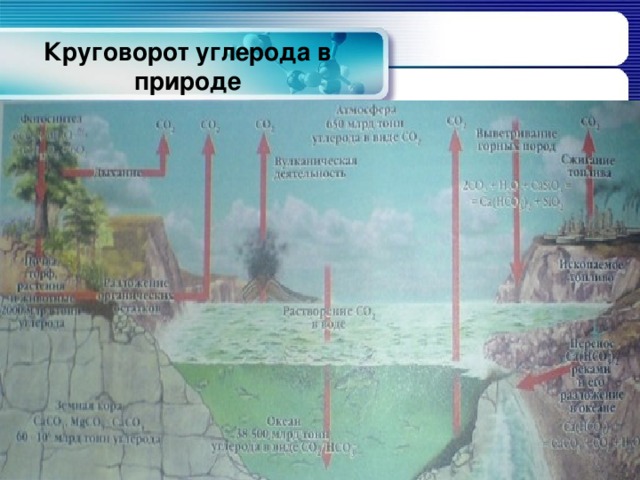
Круговорот углерода в природе

Оксиды углерода
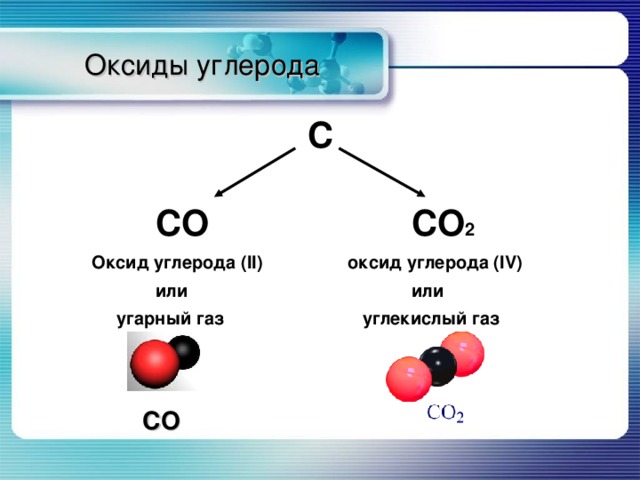
Оксиды углерода
С
СО СО 2
Оксид углерода ( II ) оксид углерода (IV)
или или
угарный газ углекислый газ
СО

Получение СО
Образуется при горении углерода или соединений на его основе (например, бензина) в условиях недостатка кислорода:
2C + O 2 → 2CO (тепловой эффект этой реакции 220 кДж),
или при восстановлении диоксида углерода раскалённым углём:
CO 2 + C ↔ 2CO↑ (ΔH=172 кДж, ΔS=176 Дж/К).

Получение CO 2
В лаборатории :
CaCO 3 + 2HCl = CaCl 2 + CO 2 ↑ + H 2 O
В промышленности :
CaCO 3 = Ca + CO 2 ↑

Прибор для получения углекислого газа

Физические свойства оксидов углерода :
CO 2
углекислый газ
Без цвета
Без запаха
В воде растворяется 1:1
Применяют
- При тушении пожаров
- При хранении продуктов
- Для получения соды
- Про-во газированной воды
СО
Угарный газ
Без цвета
Без запаха,
Плохо растворим в воде
ядовит
Применяют при выплавке чугуна

Химические свойства CO
Молекулы СО очень прочны, поскольку связь между атомами углерода и кислорода в них тройная.
Для оксида углерода ( II ) характерны восстановительные свойства. Например, он восстанавливает металлы из оксидов:
CuO + CO = Cu + CO 2
На воздухе угарный газ горит:
2 CO + O 2 = 2 CO 2

Тест
Вариант 1
- Число валентных электронов атома углерода равно
1)6 2)2 3)3 4)4
2. Низшая степень окисления атома углерода равна 1)-4 2)+4 3)-6 4)-2
3. Адсорбционные свойства наиболее характерны для
1) алмаза 2) активированного угля 3) графита 4) каменного угля
4. Определите вещество X в следующей схеме превращений: С → X → С2Н2:
1)СО 2 2) СО 3)СаС 2 4)А1 4 С 3
5. Определите массовую долю примесей в угле, если при сгорании 42 г угля было получено с выходом 85% 60 л (н.у.) углекислого газа.
1) 0,10 2)0,07 3)0,13 4)0,90

Вариант 2
1. Электронная конфигурация валентного уровня атома углерода
1)2s 2 2p 2 2)2s 2 3)2s 2 2p 4 4)3s 2 3p 2
2. Наиболее электроотрицательный элемент из приведенных — это
1)В 2) С 3) N 4) Gе
3. Масса алмаза «Шах» в 87 каратов равна 1)8,7 г 2) 87 г 3) 13,6 г 4) 17,4 г
4. Определите вещество X в следующей схеме превращений: СаС 2 → X →СО 2 .
1)А1 4 С 3 2)С 2 Н 2 3) С 4) СО
5. Определите массовую долю примесей в угле, если при сгорании 22,3 г угля было
получено с выходом 95% 36 л (н.у.) углекислого газа 1) 0.91 2)0,09 3)0,23 4)0,17


 Получите свидетельство
Получите свидетельство Вход
Вход











































 Углерод. Оксиды углерода (презентация) (6.66 MB)
Углерод. Оксиды углерода (презентация) (6.66 MB)
 0
0 2592
2592 184
184 Нравится
0
Нравится
0







