
Муниципальное бюджетное учреждение средняя общеобразовательная школа №93 с углубленным изучением отдельных предметов г.о.Тольятти.

Содержание.
- Классификация реакций.
2. Реакции соединения.
3.Реакции разложения.
4. Реакции обмена.
5. Реакции замещения .
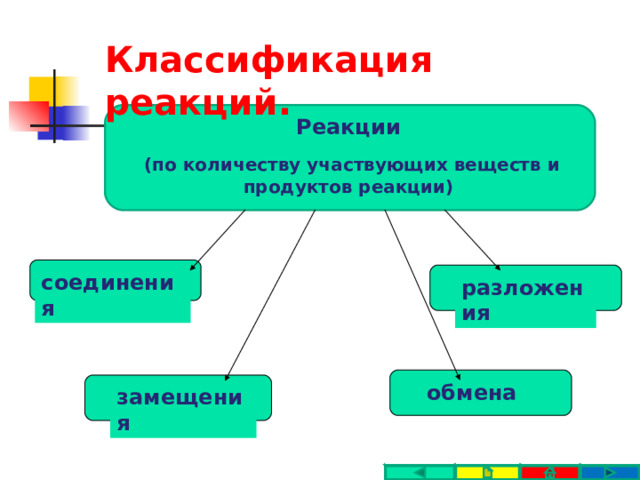
Классификация реакций.
Реакции
(по количеству участвующих веществ и продуктов реакции)
соединения
разложения
обмена
замещения

Реакция соединения.
Реакцией соединения - называется такая реакция, при которой из двух или более простых или сложных веществ образуется одно более сложное вещество.
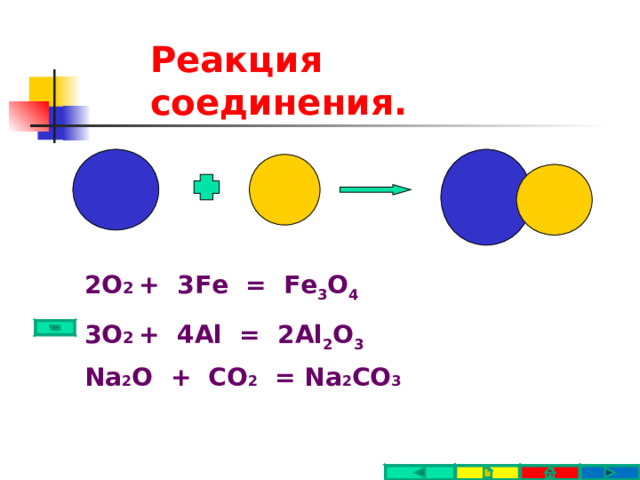
Реакция соединения.
2 О 2 + 3Fe = Fe 3 O 4
3 О 2 + 4Al = 2Al 2 O 3
Na 2 O + CO 2 = Na 2 CO 3
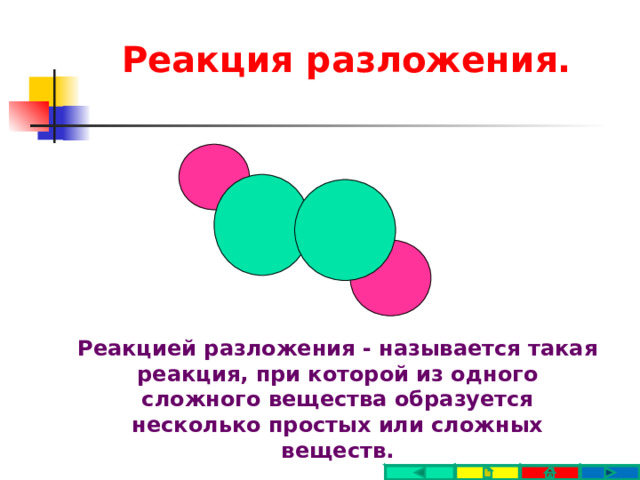
Реакция разложения.
Реакцией разложения - называется такая реакция, при которой из одного сложного вещества образуется несколько простых или сложных веществ.
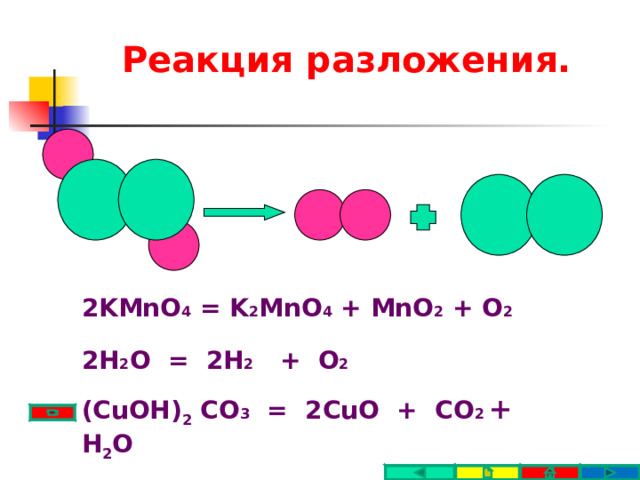
Реакция разложения.
2KMnO 4 = K 2 MnO 4 + MnO 2 + O 2
2H 2 O = 2H 2 + O 2
(CuOH) 2 CO 3 = 2CuO + CO 2 + H 2 O

Реакция обмена.
Реакцией обмена - называется такая реакция, при которой два сложных вещества обмениваются своими составными частями.
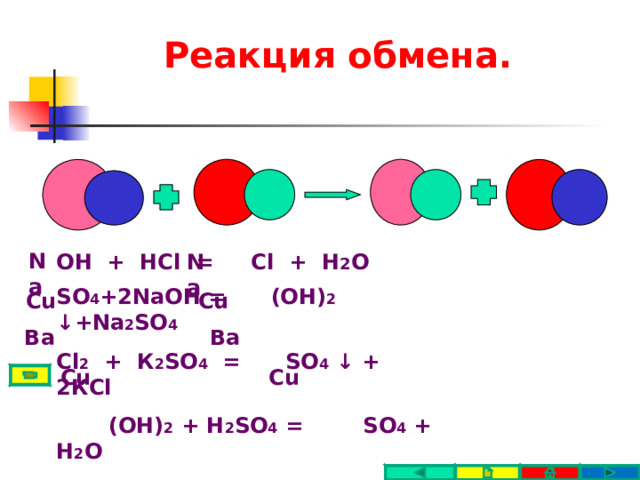
Реакция обмена.
Na
OH + HCl = Cl + H 2 O
SO 4 + 2 NaOH = (OH) 2 ↓ +Na 2 SO 4
Cl 2 + К 2 SO 4 = SO 4 ↓ + 2 К Cl
(OH) 2 + H 2 SO 4 = SO 4 + H 2 O
Na
Cu
Cu
Ba
Ba
Cu
Cu

Реакция замещения.
Реакцией замещения - называется такая реакция, при которой атомы простого вещества замещают атомы одного из элементов в сложном веществе.
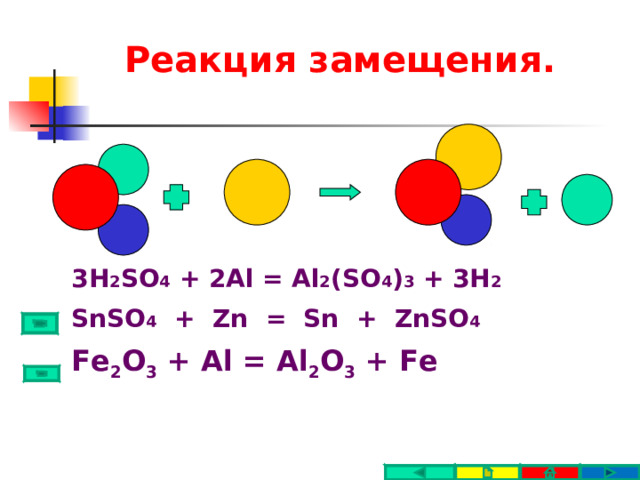
Реакция замещения.
3H 2 SO 4 + 2Al = Al 2 (SO 4 ) 3 + 3H 2
SnSO 4 + Zn = Sn + ZnSO 4
Fe 2 O 3 + Al = Al 2 O 3 + Fe

Список литературы:
- Фельдман Ф.Г., Рудзитис Г.Е. Химия 8 класс. Учебник для общеобразовательных учреждений. М.: Просвещение, 2008.
- Габриелян О.С. Химия 11 класс. Учебник для общеобразовательных учреждений. М.: Дрофа, 2008.
- Горковенко М.Ю. Поурочные разработки по химии 8 класс. М.: ВАКО, 2008.

 Получите свидетельство
Получите свидетельство Вход
Вход











 Типы химических реакций. (400 KB)
Типы химических реакций. (400 KB)
 0
0 345
345 3
3 Нравится
0
Нравится
0



