
Тема:
Строение
электронных оболочек
атомов

1. В течении 2 минут своими словами , напишите небольшой рассказ, который расскажет о том , что такое атом. Оценивается объём информации, а не качество составления предложений и текста в целом.
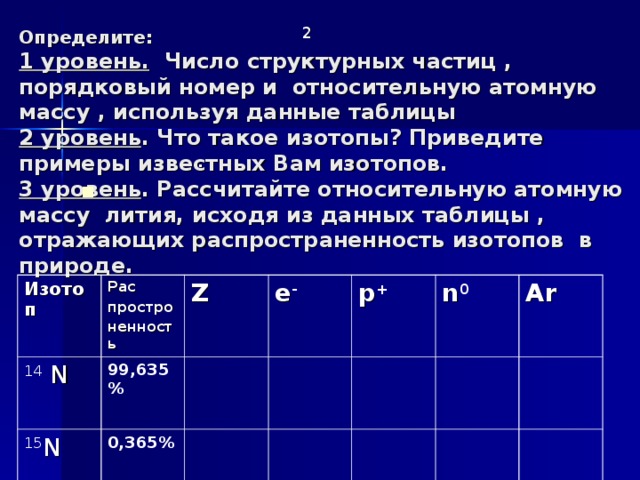
Определите: 1 уровень. Число структурных частиц , порядковый номер и относительную атомную массу , используя данные таблицы 2 уровень . Что такое изотопы? Приведите примеры известных Вам изотопов. 3 уровень . Рассчитайте относительную атомную массу лития, исходя из данных таблицы , отражающих распространенность изотопов в природе.
2
.
Изотоп
14 N
Рас
простро
ненность
Z
99,635%
15 N
e -
0,365%
p +
n 0
Ar
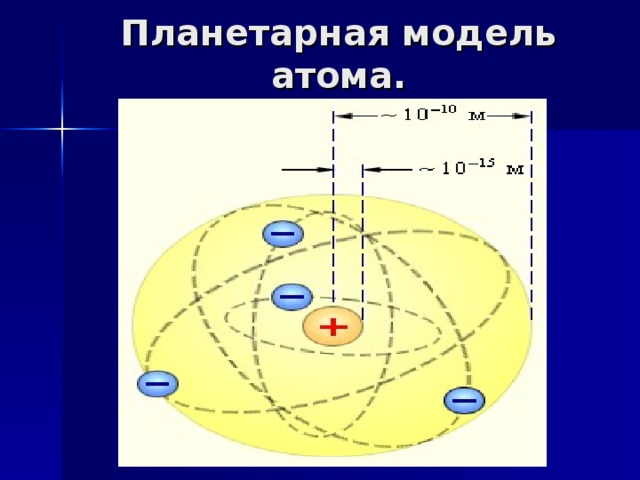
Планетарная модель атома.

Что такое электрон?
е – это частица!
е – волна!
е обладает скоростью
и энергией. Определить
где электрон будет
в следующий
момент времени
практически невозможно.
Он охватывает целую
область, называемую
электронным облаком
или атомной орбиталью.
m0 = 0,9109534*10 – 27 г
Z = 1,6021892*10 – 19 Кл
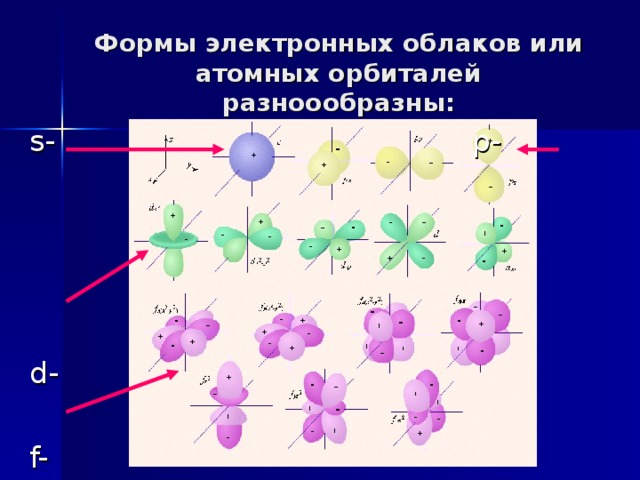
Формы электронных облаков или атомных орбиталей разноообразны:
s- p-
d-
f-

Атомная орбиталь (электронное облако) – это область пространства, где нахождение электрона наиболее вероятно.

Все электроны, окружающие ядро образуют электронную оболочку.
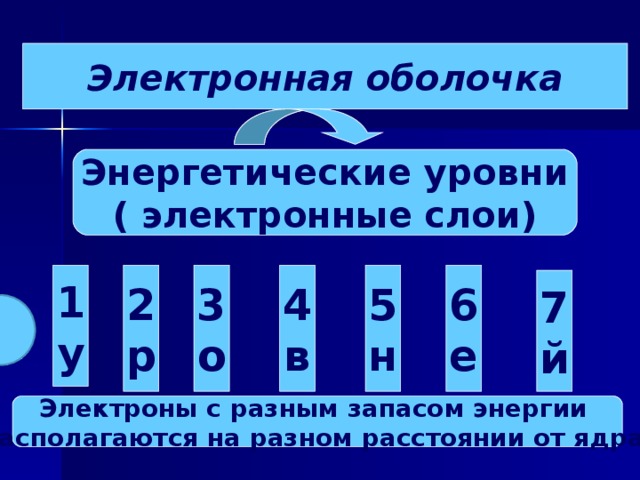
Электронная оболочка
Энергетические уровни
( электронные слои)
1
у
2
р
3
о
4
в
5
н
6
е
7
й
Электроны с разным запасом энергии
располагаются на разном расстоянии от ядра.

Меньше
запас
энергии
электрона.
Связь
с ядром
прочнее.
Связь
е
с ядром
Больше
запас
энергии
электрона.
Связь
с ядром
слабее.
ЯДРО

Запомни!
Число электронных слоёв или энергетических уровней = номеру периода в котором стоит элемент.

Энергетические уровни состоят из подуровней, на которых располагаются атомные орбитали s -, p -, d - и f -типа

Электронная оболочка
Энергетический уровень
( электронный слой)
Электронные подуровни
Атомные орбитали
s
p
d
f

+Z
1
2
s
3
s
4
p
s
p
s
5
6
p
s
d
s
p
7
d
p
f
d
s
f
d
p
f
d
f

Атомные орбитали
- На s -подуровне может находиться одна атомная орбиталь
- На p - подуровне их может быть уже три –
- На d - подуровне их может быть уже пять –
- На f - подуровне их может быть уже семь –

На одной АО могут находиться только ДВА электрона, которые вращаются вокруг своей оси в противоположных направлениях (по часовой стрелке и против часовой стрелке) – электроны с противоположными спинами:

+Z
1
2
s
2e -
3
s
2e -
4
P 6e -
s
2e -
s
2e -
5
p
6e -
p
6e -
6
d
10e -
S
2e -
7
s
2e -
d 10e -
p
6e -
f
14e -
p
6e -
s
2e -
d 10e -
P
6e -
d 10e -
f 14e -
f 14e -
d 10e -
f 14e -

+Z
1
2
3
4
5
6
7
2e
8e
18e
32e
32e
32e
32e
2 n 2

Электронные конфигурации с повышенной устойчивостью
p 3 d 5 f 7
s 2 p 6 d 10 f 14

В пределах подуровня атомные орбитали заполняются одиночными электронами с параллельными спинами, и когда все орбитали данного подуровня будут заняты, происходит спаривание последних:
↑↓
↑↓
↑
↑↓
↑
↑
↑
↑
↓
↑↓
↑

+Z
1
2
s
2e -
3
s
2e -
4
P 6e -
s
2e -
s
2e -
5
p
6e -
p
6e -
6
d
10e -
S
2e -
7
s
2e -
d 10e -
p
6e -
f
14e -
p
6e -
s
2e -
d 10e -
P
6e -
d 10e -
f 14e -
f 14e -
d 10e -
f 14e -

Электронная формула, которая показывает распределение электронов по подуровням.
1s ι 2s2p ι 3s3p3d ι 4s4p4d4f ι 5s5p5d 5f ι 6s6p 6d 6 f ι 7 s7p7d7f

ЭНЕРГИТИЧЕСКАЯ ДИАГРАММА РАСПОЛОЖЕНИЯ АО В ЭЛЕКТРОННОЙ ОБОЛОЧКЕ

РЯД НАИМЕНЬШЕЙ ЭНЕРГИИ:
1s ι 2s2p ι 3s3p ι 4s3d4p ι 5s4d5p ι 6s4f5d6p ι 7 s5f6d7p

Периоды показывают количество энергетических уровней
Номер группы показывает :
1. Количество электронов на внешнем энергетическом уровне
+ 8
Порядковый номер показывает:
1.Заряд ядра атома
2.Количество протонов
3.Количество электронов.

СХЕМА СТРОЕНИЯ АТОМА
Н
Показывает распределение электронов
по уровням
1
+1
1

Число частиц.
e - = 1
p + =1
n 0 =1 - 1
- e - = 1 p + =1 n 0 =1 - 1

ЭЛЕКТРОННАЯ ФОРМУЛА (КОНФИГУРАЦИЯ) АТОМА
Уровень форма орбитали
1 s 1
Число электронов
на данной орбитали
Показывает распределение электронов по подуровням

ЭЛЕКТРОННО - ГРАФИЧЕСКАЯ ФОРМУЛА АТОМА
s
1
Показывает распределение электронов по АО
↑

Валентные электроны
Электроны, которые не имеют пары.
= 1
в

Примеры электронных структур
Полная электронная формула
Cl - 1s 2 2s 2 2p 6 3s 2 3p 5
Краткая формула Cl - 3 s 2 3 p 5
Электроно-графическая формула
s p d
3
2
1 = 1
в

- Свойства химических элементов в таблице периодически повторяются. Каждый период начинается щелочным металлом и заканчивается инертным газом.
- Составив схемы строения атомов предложенных химических элементов, ответьте на вопрос – Почему свойства х.э. периодически повторяются? Как это связано с внутренним миром атома? Для этого сравните составленные схемы между собой и найдите черты сходства.
- 1 вариант – 1 А группа ( малые периоды)
- 2 вариант – 2А группа
- 3 вариант- 3А группа
- 4 вариант – 4а группа

- П.9.
- 1. 1 - 2 уровень. Составьте схемы строения атомов химических элементов 4 группы. Укажите черты сходства.
- 2. 3 уровень. Решите задачу. Элементы А и В имеют одинаковое число энергетических уровней, число электронов внешнего уровня элемента А равно общему числу электронов элемента В. В каком периоде находится элемент В.

Спасибо за урок!


 Получите свидетельство
Получите свидетельство Вход
Вход














































 Строение электронных оболочек атомов (0.95 MB)
Строение электронных оболочек атомов (0.95 MB)
 0
0 2382
2382 173
173 Нравится
0
Нравится
0


