
ОБЩАЯ ХИМИЯ
СТРОЕНИЕ АТОМОВ
ХИМИЧЕСКИХ
ЭЛЕМЕНТОВ

Найдите
в нижеприведенном
тексте противоречие .
Как Вы думаете,
почему оно
возникло?
Атом (от греч. аtomos – неделимый) –
электронно-ядерная система, состоящая из положительно заряженного ядра и отрицательно заряженных электронов.

ē, m → 0; заряд –1
р, m = 1; заряд +1
n, m = 1; заряд 0
АТОМ
(электронейтрален)
ЯДРО
ЭЛЕКТРОНЫ
ПРОТОНЫ
НЕЙТРОНЫ

Запомним:
Химический элемент - вид атомов с определенным одинаковым зарядом ядра , т.е. с одинаковым числом протонов ( Число нейтронов в атомах одного и того же химического элемента может быть разным!) (ИЗОТОПЫ)

Запомним:
Если атом отдает электрон, он превращается в ион с положительным зарядом – катион ( например, К 0 - ē = К + ) ;
Если атом присоединяет электрон, то становится отрицательным ионом – анионом ( например, F 0 + ē = F - ) .
4

Запомним:
( ∑ē = ∑р = № элемента )
Число электронов в атоме равно числу протонов и определяется по порядковому номеру элемента в ПС

Строение атомных ядер и их превращения – предмет ядерной физики.
В химии обычно рассматривают строение электронных оболочек атомов

МНОЖЕСТВО «ПОЧЕМУ?», «КАК?» И «ЗАЧЕМ?»…
- ПОЧЕМУ ОТРИЦАТЕЛЬНЫЕ ЭЛЕКТРОНЫ НЕ ПАДАЮТ НА ПОЛОЖИТЕЛЬНО ЗАРЯЖЕННОЕ ЯДРО?
- ПОЧЕМУ НЕЛЬЗЯ ГОВОРИТЬ О ТОЧНОМ МЕСТОНАХОЖДЕНИИ ЭЛЕКТРОНОВ В АТОМЕ?
- КАК УСТРОЕНА ЭЛЕКТРОННАЯ ОБОЛОЧКА АТОМА?
- ПОЧЕМУ ЭЛЕКТРОНЫ ОБРАЗУЮТ ЭЛЕКТРОННЫЕ СЛОИ, А НЕ РАСПОЛАГАЮТСЯ НА ОДНОМ РАССТОЯНИИ ОТ ЯДРА?
- КАК УЗНАТЬ КОЛИЧЕСТВО ЭЛЕКТРОНОВ НА КАЖДОМ ЭЛЕКТРОННОМ СЛОЕ?
- ЗАЧЕМ НУЖНО ЗНАТЬ СТРОЕНИЕ ЭЛЕКТРОННЫХ ОБОЛОЧЕК АТОМОВ? ...

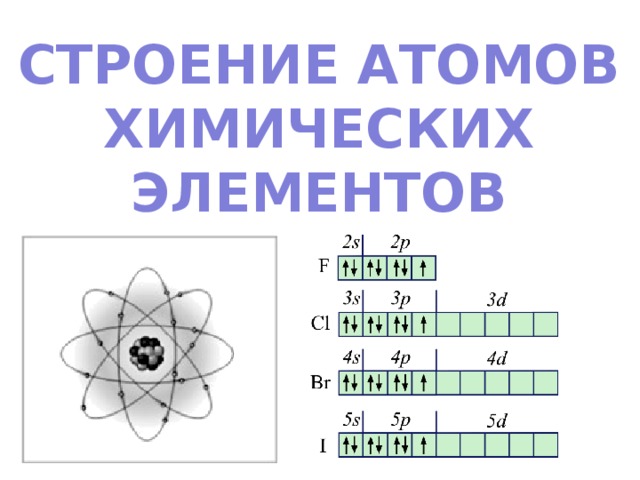
1. Электроны располагаются вокруг ядра на электронных слоях (энергетических уровнях)
Электроны разных слоев отличаются запасом внутренней энергии: чем дальше слой от ядра, тем больше запас энергии.
2n 2

2. Количество электронных слоев (энергетических уровней) в атоме равно номеру периода, в котором находится химический элемент в ПС

3. Каждый энергетический уровень состоит из подуровней, которые обозначаются латинскими буквами s , p , d , f .
Граничные поверхности и число s -, p -, d -, f - орбиталей на каждом уровне показаны на рисунке

4. Каждый подуровень состоит из атомных орбиталей.
Атомная орбиталь – место в пространстве вокруг ядра, в котором вероятность нахождения электрона наибольшая (90-95%).
Электронное облако атома водорода
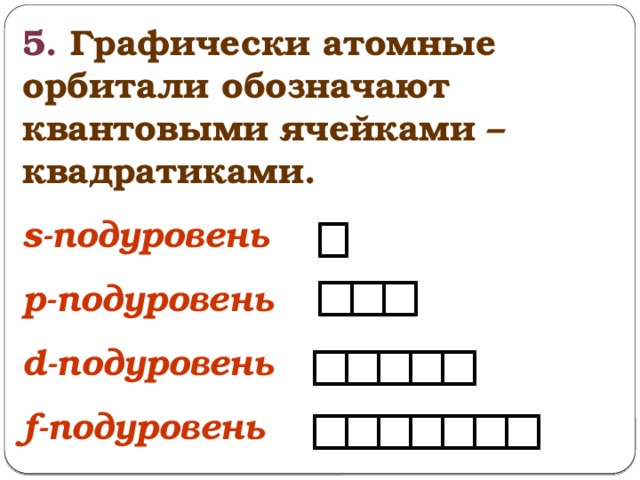
5. Графически атомные орбитали обозначают квантовыми ячейками – квадратиками.
1
s-подуровень
1
p-подуровень
1
d-подуровень
1
f-подуровень
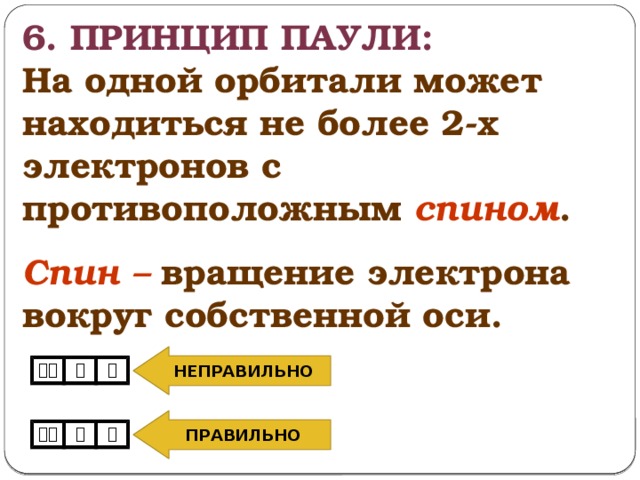
6. Принцип паули:
На одной орбитали может находиться не более 2-х электронов с противоположным спином .
Спин – вращение электрона вокруг собственной оси.
НЕПРАВИЛЬНО
ПРАВИЛЬНО

7. Правило хунда:
Электроны занимают свободные ячейки, располагаясь в них сначала по одному, а лишь затем спариваются.
ПРАВИЛЬНО
НЕПРАВИЛЬНО


Порядок заполнения орбиталей электронами :
(указано максимальное количество электронов на подуровне)
1s 2 - 2s 2 - 2p 6 - 3s 2 - 3p 6 - 4s 2 - 3d 10
- 4p 6 - 5s 2 - 4d 10 - 5p 6 - 6s 2 - 4f 14 –
- 5d 10 – 6p 6 – 7s 2 – 5f 14 …
ПРИМЕР

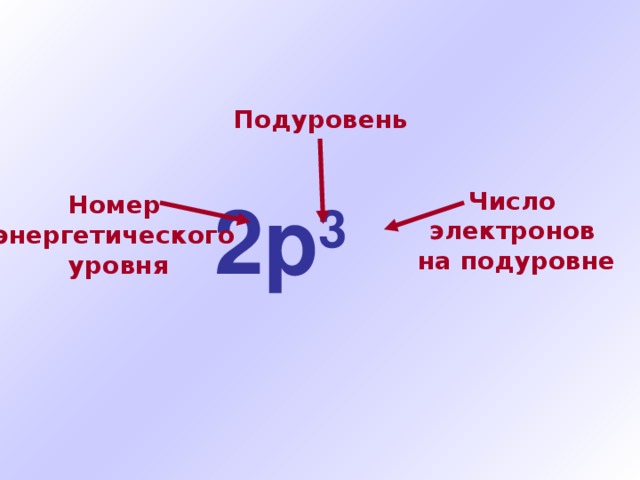
Подуровень
2р 3
Число
электронов
на подуровне
Номер
энергетического
уровня
Задание
Сколько энергетических уровней в атомах:
А) углерода
Б) хрома
В) бария
Г) гелия?

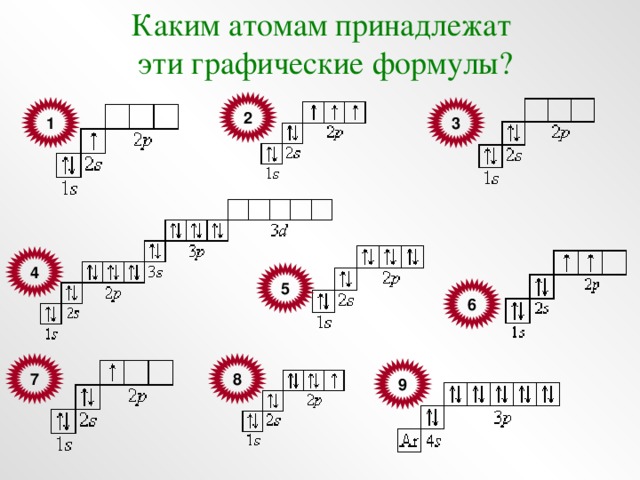
Каким атомам принадлежат
эти графические формулы?
2
3
1
4
5
6
8
7
9

Задание
Запишите электронную формулу:
А) гелия
Б) углерода
Постройте электронно-графическую формулу, распределив электроны по квантовым ячейкам



11 Na 1 s 2 2 s 2 2 p 6 3 s 1
17 Cl 1 s 2 2 s 2 2 p 6 3s 2 3 p 5
18 Ar 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6
Иногда в схемах, изображающих распределение электронов в атомах, указывают только число электронов на каждом энергетическом уровне, то есть записывают сокращенные электронные формулы атомов химических элементов :
11 Na 2, 8, 1; 17 Cl 2, 8, 7; 18 Ar 2, 8, 8.

Изотопы -
разновидности атомов одного и того же химического элемента, имеющие одинаковый заряд ядра (одинаковое число протонов в нем), но разную относительную атомную массу (разное число нейтронов)
О 16
О 17
о 18

Домашнее задание
Составьте электронные формулы элементов с порядковыми номерами:
На отметку «3» - 5,13,
На отметку «4» - 19,22,
На отметку «5» - 35,50
Для одного из двух химических элементов составьте графическую электронную формулу


 Получите свидетельство
Получите свидетельство Вход
Вход








































 Презентация по химии по теме "Строение атома" (0.67 MB)
Презентация по химии по теме "Строение атома" (0.67 MB)
 0
0 3445
3445 820
820 Нравится
0
Нравится
0


