Цель: На основе положения галогенов в периодической системе элементов рассмотреть и сформировать знания о строении атомов галогенов, свойствах галогенах.
Задачи:
Образовательная. Формировать знания учащихся по теме неметаллы, дать понятие о галогенах их положении в ПСХЭ, строении атомов, свойствах, значении и применении, уметь применять полученные знания и умения на практике.
Развивающая. Развивать умения давать характеристику химическим элементам седьмой группы главной подгруппы, простым и сложным веществам, образованных этими элементами, развивать творческие навыки, мышление, интерес к химии, навыки работы с дополнительной литературой, работы в Интернете, создания мультимедийной информации.
Воспитательная. Воспитывать творческое отношение к учебе, интерес к предмету, повышение самооценки учащихся, трудолюбие.
Этапы работы
- Здравствуйте
- Ребята, я прошу улыбнуться тех, кто пришел на урок с хорошим настроением.
- Желаю вам на сегодняшнем уроке подняться на новую ступеньку в познании окружающего мира
Проводится тестирование по теме «Неметаллы» § 17, проверяется зад. 5 стр. 111 ПТ
- Прежде, чем сообщить тему сегодняшнего урока, я загадаю Вам загадки, а Вы должны угадать, о чем пойдет речь на уроке. (Презентация Слайд 2 )
1. Красив в кристаллах и парах,
и на детей наводит страх. (Йод).
2. Самой сильной из кислот имя галоген дает? (Ответ: Хлорная кислота).
Сообщает тему, цель, задачи, характеризует практическую значимость изучаемого материала. (Презентация Слайд 3)
Тема: Галогены. Соединения галогенов.
Цель: На основе положения галогенов в периодической системе элементов рассмотреть и сформировать знания о строении атомов галогенов, свойствах галогенах.
Задачи:
Сформировать знания учащихся по теме неметаллы, дать понятие о галогенах их положении в ПСХЭ, строении атомов, свойствах, значении и применении, уметь применять полученные знания и умения на практике.
Сегодня у нас необычный урок. Мы отправимся в гости к ПСХЭМ.
(Презентация Слайд 4 )
С помощью ПСХЭ Д. И. Менделеева дается характеристика галогенов как ХЭ по составу, строению и свойствам. (Презентация Слайд 5 )
- Что общего в строении и свойствах галогенов на основании их положения в ПСХЭМ ?
- За счет какой связи образована молекула галогена?
- Какую кристаллическую решетку имеют галогены?
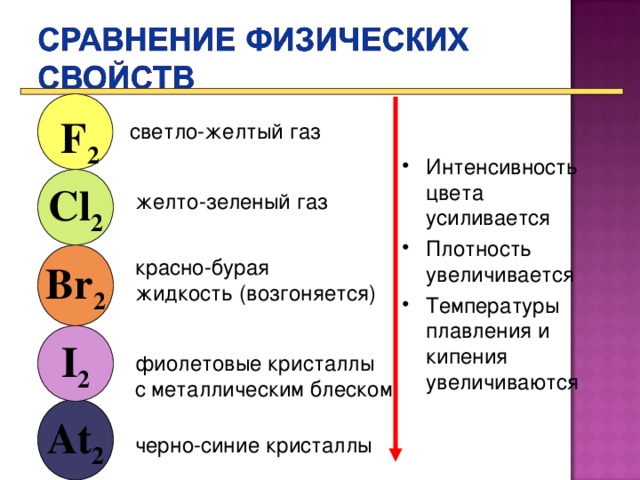
Исходя из строения атома, охарактеризуйте физические свойства галогенов ( выполнение зад. 3, стр. 113 ПТ. )
Проверяют по (Презентация Слайд 6 )
- Какие элементы в соединениях мы встречаем в повседневной жизни ?
- На ваш взгляд какой элемент самый необходимый?
- Почему? (Презентация Слайд 7 )
- Какую цель ставим на урок?
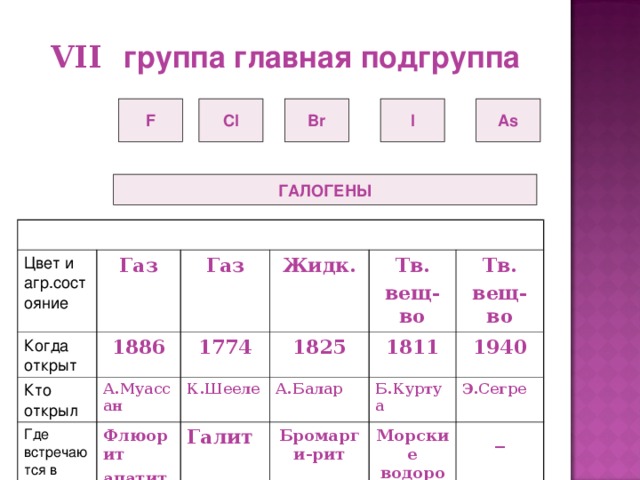
- Сейчас мы заслушаем интересные факты открытия галогенов, которые подготовили учащиеся. (Презентация Слайд 8 - 11 )
Ребята рассказали нам о четырех галогенах, остался Астат проводится беседа об Астате (Презентация слайд12 )
Данный элемент «открывали» много раз и давали разные названия: алабамий (1932 г. ) в честь штата в США, где предполагали, что он был обнаружен в монацитовом песке; гельвеций (в честь Швейцарии), англогельвеций, дакин (от названия древней страны даков в Северной Европе), лептин (в переводе с греческого «слабый») и т. д.
Однако первое достоверное сообщение о его открытии сделали физики, занятые синтезом новых элементов. На циклотроне Калифорнийского университета Д. Корсон, К. Мак - Кензи и Э. Сегре облучили альфа - частицами мишень из висмута. При этом получили новый элемент.
Его нет в природе.
Этот радиоактивный элемент из семейства галогенов назван «астат», что в переводе означает «неустойчивый». О нем известно очень мало. Установлено, что он может существовать в шести валентных состояниях: от - 1 до +7 (аналогиода). Как и иод, он хорошо растворяется в большинстве органических растворителей. Подобно иоду, он концентрируется в щитовидной железе и может быть использован для лечения заболевания щитовидной железы более эффективно, чем иод.
В каком виде находятся галогены в природе? Презентация Слайд 13 - 14____)
Для ответа на этот вопрос посмотрим презентацию:
- Как выдумаете, почему галогены называют еще «солероды»? (Презентация Слайд 15_)
Вспомним правила работы в парах. После прослушанных сообщений сделаем карточку – схему Работа в парах.
Заполненная на слайде карточка – схема (Презентация Слайд _16_)
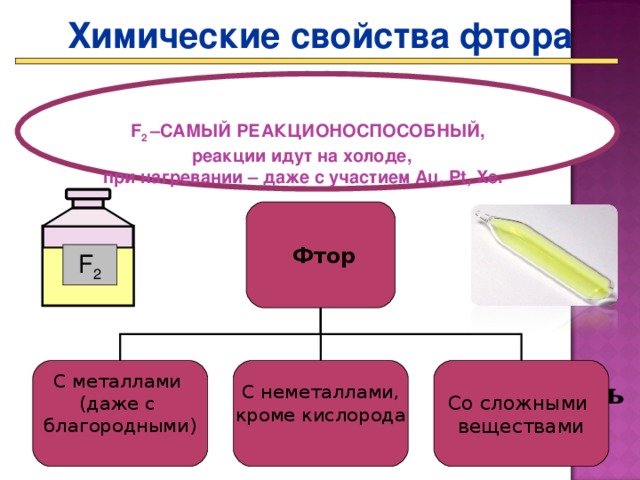
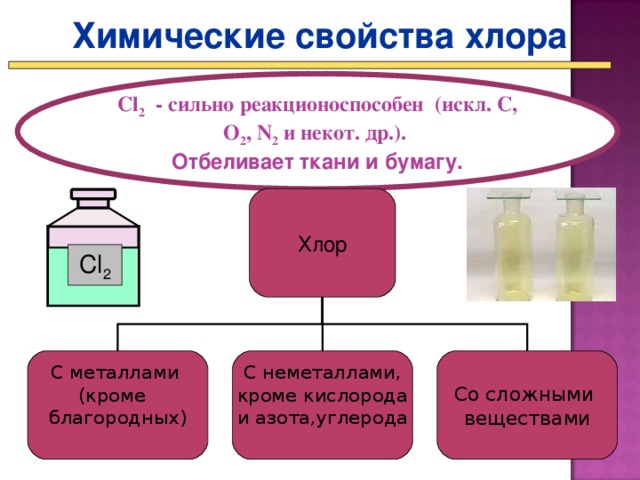
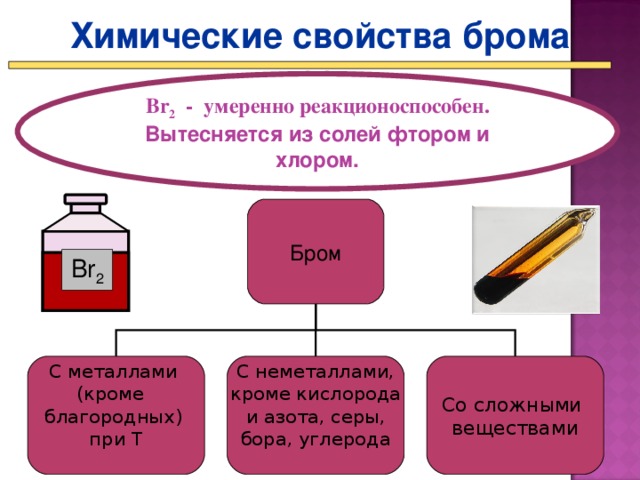
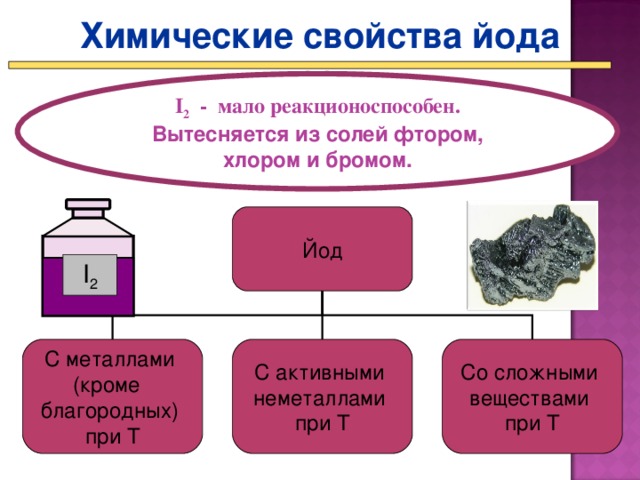
Представление презентации «Химические свойства галогенов» (Презентация Слайд 17 - 22_)
- По ходу презентации составляете и записываете уравнения реакций зад. 4 стр. 113 – 114 в ПТ.
При прохождении тем «Щелочные и щелочноземельные металлы мы уже познакомились с данными химическими реакциями) слабые учащиеся могут воспользоваться учебником стр. 163 - 164, чтобы правильно записать химические реакции.
Предположите, какой цвет будет иметь мокрая лакмусовая бумажка? Демонстрация реакции лакмусовой бумаги и соляной кислоты.
Какая среда?
Более активные галогены могут вытеснять менее активные из растворов их солей. Так хлор будет вытеснять бром и йод, а бром может вытеснить йод.
6. Фтор в силу своей активности не обладает этим свойством, так как он будет взаимодействовать с водой, а не с солью и будет окислять кислород.
Ваимодействие фтора с водой : 2F2 + 2H2O = 4HF + 02 Здесь кислород – восстановитель и продукт горения.
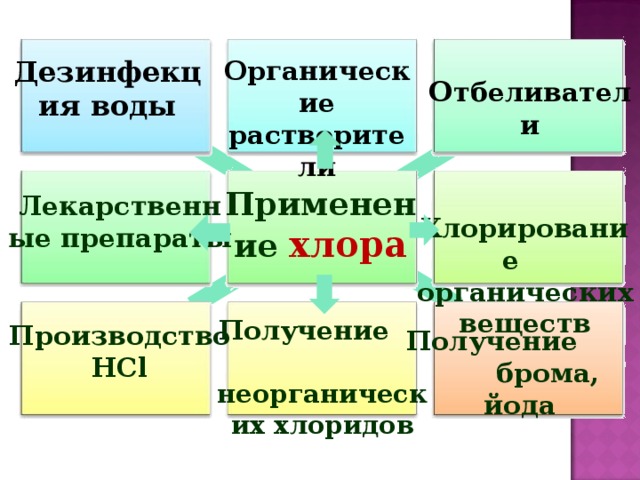
Рассмотрим применение галогенов , на примере хлора. (Презентация Слайд 23_)
выполним в ПТ зад. 7 стр. 115
Физминутка – релаксация
Когда вы зашли в класс наверное вы заметили , то по нашему классу разлетелись снежинки попробуйте сейчас глазами найти снежинки - галогены…. нашли? закройте глаза и представьте , что эти снежинки разлетелись кружась по полю ( звучит релаксационная музыка)
Отдохнули ? приступим к закреплению материала.
Первичное закрепление во внешней речи.
Проверим.
- Достигли ли мы цели урока?
- А какую цель дальше себе поставим?
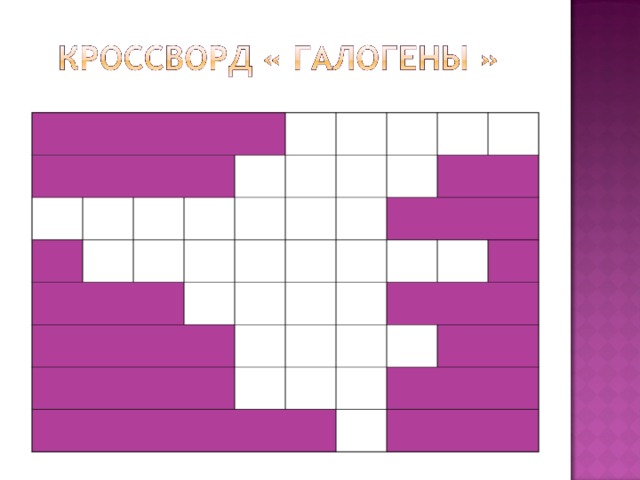
Для закрепления изученного материала отгадаем кроссворд
( Презентация Слайд 24 ).
По горизонтали :
1. Радиактивный элемент, может быть получен только искусственно.
2. Ядовитый газ, раздражающий слизистые оболочки даже в очень малых дозах.
3. Вещество, служащее реактивом на йод.
4. Группа химических элементов, у которых на внешнем уровне 7 электронов.
5. Самый активный из галогенов, вода горит в нем фиолетовым цветом.
6. Галоген – в жидком состоянии.
7. Галоген , антисептик.
По вертикали если верно угадали , вы все слова :
8. Перевод слова «галогены» с греческого языка.
Проверь себя (Презентация Слайд 25_)
Итог.
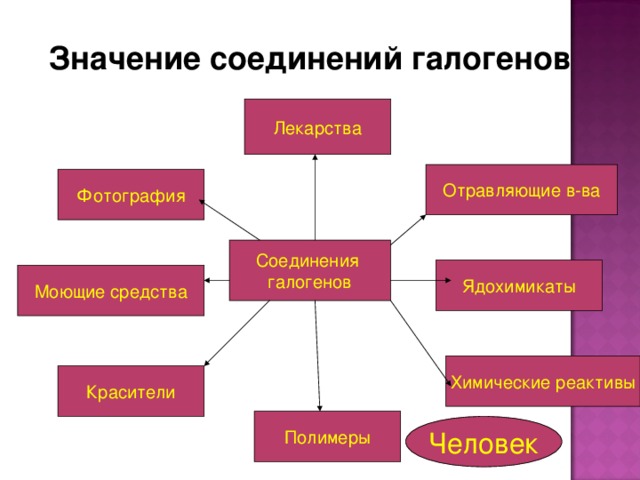
- Какое значение имеют галогены?
- Какую цель ставили на уроке?
- Удалось ли достичь поставленной цели?
- Какой вид работы вам больше всего понравился?
- § 18 ПТ стр. 116 – 117 зад. 1 – 5 , по желанию зад. 8
Инструктирую, проверяю, как учащиеся поняли содержание работы Презентация Слайд 26_)
Весь материал - смотрите документ.

 Получите свидетельство
Получите свидетельство Вход
Вход




























 Презентация по химии "Галогены. Соединения галогенов" (6.72 MB)
Презентация по химии "Галогены. Соединения галогенов" (6.72 MB)
 8
8 4889
4889 1173
1173 Нравится
0
Нравится
0


