гОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ПРОФЕССИОНАЛЬНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ
«ТОЛЬЯТТИНСКИЙ ХИМИКО-ТЕХНОЛОГИЧЕСКИЙ ТЕХНИКУМ»
Методические указания
к выполнению и оформлению лабораторных работ
по предмету «Химия»
для специальностей:
220703 «Автоматизация технологических процессов производства»
151031 «Монтаж и техническая эксплуатация промышленного оборудования»
Преподаватель: Зубкова Д.М.
Тольятти 2014
Содержание
Пояснительная записка 3
Техника безопасности при работе в химической лаборатории 4
Требования к знаниям и умениям при выполнении лабораторных работ 5
Лабораторная работа №1 Моделирование построения Периодической таблицы химических элементов 6
Лабораторная работа №2 Реакции ионного обмена 9
Лабораторная работа №3 Приготовление растворов заданной концентрации 13
Лабораторная работа №4 Определение характера среды раствора с помощью индикаторов 16
Лабораторная работа №5. Получение и свойства гидроксида цинка и гидроксида алюминия 18
Лабораторная работа №6 Взаимодействие металлов с кислотами 20
Лабораторная работа №7 Получение аммиака и изучение его свойств 21
Лабораторная работа №8 Получение оксида углерода (IV) и изучение его свойств 24
Лабораторная работа №9 Изучение свойств карбоновых кислот
Список литература 27
Пояснительная записка
Настоящие методические указания для выполнения лабораторных работ по дисциплине «Химия» были разработаны в соответствии с принятой рабочей программы учебной дисциплины «Химия» для специальностей СПО. Методические указания для выполнения лабораторных работ предназначены для студентов первого курса 220703
«Автоматизация технологических процессов производства», 151031 «Монтаж и техническая эксплуатация промышленного оборудования». Лабораторные работы рассчитаны на 20 часов учебных занятий, включают 9 работ.
Выполнение лабораторных работ направлены на формирование у студентов следующих умений:
1. получению конкретных веществ, относящихся к изученным классам соединений;
2. проводить расчеты по химическим формулам и уравнениям реакций;
3. осуществлять самостоятельный поиск химической информации с использованием различных источников (справочных, научных и научно-популярных изданий, компьютерных баз данных, ресурсов Интернета); использовать компьютерные технологии для обработки и передачи химической информации и ее представления в различных формах;
4. использовать приобретенные знания и умения в практической деятельности и повседневной жизни.
Структура методических указаний:
1. тему
2. цель работы
3. краткое теоретическое введение
4. оборудование и химические реактивы для выполнения лабораторных работ
4. порядок выполнения работы
5. контрольные вопросы
В лабораторных работах уделено внимание вопросам, которые находят применение в будущей профессиональной деятельности. Выбор опытов и экспериментов обусловлен не столько их внешним эффектом, сколько их познавательностью. Учебная дисциплина «Химия» является связующим звеном между общеобразовательными и общетехническими дисциплинами.
Перечень лабораторных работ:
1. Лабораторная работа №1 Моделирование построения Периодической таблицы химических элементов
2. Лабораторная работа №2 Реакции ионного обмена
3. Лабораторная работа №3 Приготовление растворов заданной концентрации.
4. Лабораторная работа №4 Определение характера среды раствора с помощью индикаторов
5. Лабораторная работа №5. Получение и свойства гидроксида цинка и гидроксида алюминия
6. Лабораторная работа №6 Взаимодействие металлов с кислотами
7. Лабораторная работа №7 Получение аммиака и изучение его свойств
8. Лабораторная работа №8 Получение оксида углерода (IV) и изучение его свойств
9. Лабораторная работа №9 Изучение свойств карбоновых кислот
Техника безопасности при работе в химической лаборатории
Лабораторные работы проводят в специально оборудованной химической лаборатории. При работе в лаборатории необходимо знать и строго соблюдать установленные правила. Работать разрешается только после ознакомления с правилами по технике безопасности и правилами работы в химической лаборатории.
1. Рабочее место содержите в чистоте и порядке, не загромождайте его посторонними предметами.
2. Не допускайте попадания химических реактивов на кожу и одежду. Нельзя брать вещества руками и пробовать на вкус
3. Не уносите на свои рабочие места реактивы общего пользования. Если нет указаний по дозировке реактивов для данного опыта, то берите их в минимальном количестве.
4. Запрещается пользоваться реактивами без этикеток или с сомнительными этикетками. Внимательно прочесть надпись на этикетке, прежде чем взять вещество для опыта.
5. Во всех опытах используйте дистиллированную воду. Сухие реактивы берите только чистым шпателем. Не путайте пробки от склянок с различными реактивами. Излишки реактивов не высыпайте и не выливайте в склянки, из которых они взяты.
6. Особую осторожность соблюдайте при работе ядовитыми и вредными веществами, с концентрированными кислотами и щелочами. Работать с ними следует в вытяжном шкафу.
7. При нагревании жидкости в пробирке необходимо держать ее так, чтобы в случае разбрызгивания жидкость не попала на самого экспериментатора и рядом работающих студентов, т.е. отверстие пробирки должно быть направлено в сторону от себя и товарищей. Лучше всего направить его на стенку вытяжного шкафа. Не забывайте пользоваться при этом держателем.
8. После опытов остатки реактивов сливайте в раковину после разбавления водой. Металлы собирайте в отведенную для этого склянку. Остатки агрессивных и дорогостоящих реактивов собирайте в специальные склянки.
9. Не трогайте, не включайте и не выключайте без разрешения рубильники и электрические приборы.
10. В лаборатории соблюдайте тишину, не занимайтесь посторонними делами, не проводите опыты, не относящиеся к данной лабораторной работе и не описанные в методическом указании.
11. Нюхать выделяющиеся газы издали, помахивая рукой от сосуда к себе.
12. Не зажигать спиртовки зажигалкой. При тушении спиртовки категорически запрещается дyть на пламя, необходимо закрывать его только колпачком, для этого нужно поднести колпачок сбоку и быстро накрыть им пламя.
13. В случае возникновения пожара в лаборатории вызвать пожарную охрану, а до прибытия гасить огонь песком, огнетушителем.
14. При ожоге рук или лица реактивом смойте реактив большим количеством воды, затем либо разбавленной уксусной кислотой (в случае ожога щелочью), либо раствором соды (в случае ожога кислотой), а затем опять водой.
Требования к знаниям и умениям при выполнении лабораторных работ
При выполнении лабораторных работ студент должен:
знать:
– основные классы неорганических соединений и их свойства, строение атома, типы химических реакций и связей;
– теорию электролитической диссоциации;
– периодический закон и периодическую систему химических элементов Д. И. Менделеева;
– теорию химического строения органических соединений А. М. Бутлерова;
– названия представителей гомологических рядов органических соединений, строение и свойства их, способы получения;
– правила по технике безопасности при работе в химической лаборатории.
уметь:
– проводить реакции ионного обмена и качественные реакции ионов, определять реакцию среды растворов солей;
– охарактеризовывать свойства металлов на основании их положения в Периодической системе химических элементов Д. И. Менделеева;
– строения атомов и электрохимическом ряду напряжений металлов;
– проводить реакции лабораторных способов получения оксида углерода(IV), аммиака этилена;
– описывать свойства органических веществ, составлять уравнения реакций.
Лабораторная работа №1
Моделирование построения
Периодической таблицы химических элементов
Цели работы
научиться видеть, что Периодическая таблица химических элементов – графическое отображение периодического закона.
рассмотреть структуру периодической таблицы: периоды (малые и большие), группы (главная и побочная).
уметь определять строение электронных оболочек атомов элементов малых периодов и особенности строения электронных оболочек атомов элементов больших периодов (переходных элементов) по положению хим. элемента в ПС.
Краткие теоретические сведения
Периодический закон открыт Д. И. Менделеевым в марте 1869 года при сопоставлении свойств всех известных в то время элементов и величин их атомных масс. Термин «периодический закон» Менделеев впервые употребил в ноябре 1870, а в октябре 1871 дал окончательную формулировку Периодического закона: «свойства простых тел, а также формы и свойства соединений элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости от их атомного веса». Графическим (табличным) выражением периодического закона является разработанная Менделеевым периодическая система элементов. Несмотря на всю огромную значимость такого открытия, периодический закон и система Менделеева представляли лишь гениальное эмпирическое обобщение фактов, а их физический смысл долгое время оставался непонятным. Причина этого заключалась в том, что в XIX в. совершенно отсутствовали какие-либо представления о сложности строения атома.
Данные о строении ядра и о распределении электронов в атомах позволяют рассмотреть периодический закон и периодическую систему элементов с фундаментальных физических позиций. На базе современных представлений периодический закон формулируется так:
Свойства простых веществ, а также формы и свойства соединений элементов находятся в периодической зависимости от величины заряда ядра атома (порядкового номера).
Закономерности ПСХЭ Д. И. Менделеева
Рис.1
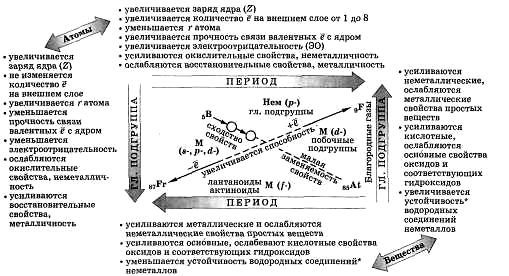
Оборудование
Задание
Дать характеристику химических элементов с № 3 по № 20 (по выбору преподавателя) по плану.
ПЛАН ХАРАКТЕРИСТИКИ ХИМ. ЭЛЕМЕНТА
ПО ПЕРИОДИЧЕСКОЙ СИСТЕМЕ Д.И. МЕНДЕЛЕЕВА.
1. Положение элемента в периодической системе:
порядковый номер
период, ряд
группа, подгруппа
относительная атомная масса
2. Строение атома элемента:
заряд ядра атома
формула состава атома (количество р; n; е )
количество энергетических уровней и размещение на них электронов
формула электронной конфигурации (1S 2S2Р 3S3P 4S4P5S4D5P)
графическая формула
число электронов на последнем слое = металл или неметалл
3. Формулы соединений:
оксида
гидроксида (кислоты или основания)
летучего водородного соединения (для неметаллов)
4. Химический характер, его доказательство:
а) кислотный: кислотный оксид + щелочь = соль + вода; кислота + основание = соль + вода
б) основной: основной оксид + кислота = соль + вода;основание + кислота = соль + вода
в) амфотерный (а + б)
5. Запишите сведения по элементам №3-№9 в таблицу.
Таблица 1.
| Химический символ | Порядковый номер элемента
| Относительная атомная масса элемента
| Электронная формула элемента |
| Li |
|
|
|
| Be |
|
|
|
| … |
|
|
|
Сформулируйте выявленную вами закономерность в виде закона.
Вопросы для выводов
Почему формулировка ПЕРИОДИЧЕСКОГО ЗАКОНА (Д. И. Менделеева) была изменена? Поменялся ли физический смысл ПЗ?
Контрольные вопросы
Напишите электронные формулы атомов с порядковыми номерами: 6 и 19
Напишите электронные конфигурации следующих элементов: N, Si, Fe
Как изменяются неметаллические свойства элементов в периодах периодической системы? Приведите конкретные примеры соединений элементов, подтверждающие эти свойства.
Как определяется принадлежность химического элемента к тому или иному электронному семейству?
Что такое «провал» электрона? Приведите примеры элементов, у которых это явление наблюдается, запишите их электронные формулы.
Лабораторная работа №2
Реакции ионного обмена
Цели работы
закрепить знания по теме "Реакции ионного обмена";
приобрести практический навык в проведении реакций ионного обмена в растворах эликтролитов;
исследовать необратимые реакции;
отработать навыки экспериментальной работы, соблюдая правила техники безопасности при работе в кабинете химии;
отработать навыки составления уравнений реакций в молекулярной и ионной формах.
Краткие теоретические сведения
Распад электролитов на ионы при растворении в воде или расплавлении называется электролитической диссоциацией.
Электролиты – вещества, проводящие электрический ток в растворенном или расплавленном состоянии. К электролитам относятся вещества с ионной связью: соли, основания и полярные молекулы кислот. Вещества, которые в растворенном или расплавленном состоянии не проводят электрического тока, называются неэлектролитами.
Количественной характеристикой процесса распада растворенного вещества на ионы является степень электролитической диссоциации – α. Степенью диссоциации называется отношение числа молекул растворенного вещества, распавшихся на ионы в растворе (n), к общему числу растворенных молекул (N). Степень электролитической диссоциации определяется опытным путем и выражается либо в долях единицы, либо в процентах. Степень диссоциации электролита зависит от природы электролита, концентрации и температуры.
По степени диссоциации электролита в растворе, растворы условно делят на три группы: сильные, слабые и средние электролиты. Если в растворе электролита α 0,3 (30 %) электролит считается сильным, α ≤ 0,03 (3 %) – слабым электролитом. Электролиты с промежуточными значениями степени диссоциации считают средними. Сильные электролиты – вещества, которые при растворении в воде полностью распадаются на ионы, т. е. диссоциируют практически полностью. После разрыва связи между ионами в молекуле электролита под действием молекул воды, образовавшиеся ионы окружают себя молекулами воды и поэтому в растворе находятся в гидратированном состоянии.
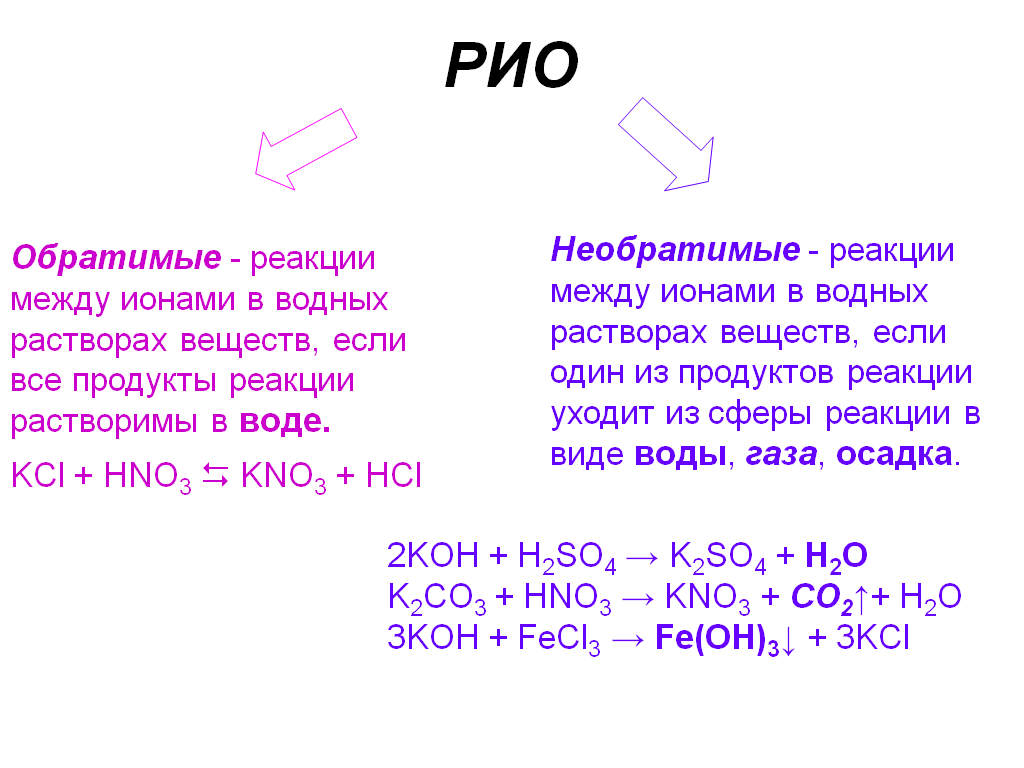
Реакции обмена между растворами электролитов идут до конца, если образуется малодиссоциирующее вещество, или вещество, практически нерастворимое, выделяющееся из раствора в виде осадка или газа.
| Классификация электролитов | Степень электролитической диссоциации | Сила электролита | Примеры | | α 30% | сильные | кислоты | H2SO4, HNO3,HCl, HBr, HI | | основания | LiOH, NаОН, KОH,Ca(OH)2, Ba(OH)2, Sr(OH)2; | | соли | большинство солей растворимых в воде | | 3% | средние | кислоты | HF , H2SO3, Н3PO4 | | основания | Fe(OH)3 | | α | слабые | кислоты | H2S, H2CO3, H2SiO3, СН3СООH | | основания | Ме(OH)n Н. в воде и NH4OH | | соли | Малорастворимые в воде |
|
Электролитическая диссоциация:
I. кислот, II. щелочей, III. солей.
I. 1. HCl → H+ + Cl-,
H2SO4 → 2H+ + SO42-.
HNO3 → H+ + NO3ˉ;
2. Ступенчатая диссоцация кислот:
H3PO4 H+ + H2PO4-,
H2PO4- H+ + HPO42-,
HPO42- H+ + PO43-.
II. NaOH →Na+ + OH-,
Ca(OH)2 → Ca2+ + 2OH-.
III. NaCl → Na+ + Clˉ;
BaCl2 → Ba2+ + 2Cl-,
Ca(NO3)2 → Ca2+ + 2NO3-,
Al2(SO4)3 → 2Al3+ + 3SO42-.
При записи ионных уравнений реакций необходимо помнить:
1) сильные электролиты следует записывать в виде отдельных составляющих их ионов;
2) слабые электролиты и малорастворимые вещества следует записывать в виде молекул.
Приборы и реактивы
растворы: соляной, серной кислот; раствор гидроксида натрия, индикаторов: фенолфталеина, метилоранжа, синего лакмуса; растворы солей: карбонат натрия, нитрат бария, сульфат алюминия, сульфат меди (II), хлорид аммония, хлорид кальция; дистиллированная вода;
штатив с пробирками, стеклянная палочка, универсальная индикаторная бумага.
Необратимость ионных реакций (реакции обмена между растворами электролитов, идущие с образованием осадка, газа и малодиссоциирующего вещества)
1) образование малорастворимых веществ.
Опыт 1. В пробирку налейте примерно 0,5–1 мл раствора сульфата меди(II) CuSO4 и 3–5 капель разбавленного раствора гидроксида натрия NaOH. Наблюдайте образование осадка гидроксида меди(II). Что наблюдаете? Запишите уравнения реакций в молекулярной и сокращенной ионной формах.
Опыт 2. В пробирку налейте примерно 1 мл раствора сульфата никеля(II) NiSO4 и 3–5 капель разбавленного раствора гидроксида натрия NaOH. Наблюдайте образование осадка гидроксида никеля(II). Что наблюдаете? Запишите уравнения реакций в молекулярной и сокращенной ионной формах.
Опыт 3. В пробирку налейте примерно 1 мл раствора соли алюминия (AlCl3 или Al2(SO4)3) и добавьте по каплям разбавленный раствор гидроксида натрия NaOH до образования осадка гидроксида алюминия. Что наблюдаете в каждом случае? Запишите уравнения реакций в молекулярной и сокращенной ионной формах.
Опыт 4. В пробирку налейте примерно 1 мл раствора хлорида кальция и добавьте по каплям раствор карбонат натрия до образования осадка. Что наблюдаете? Запишите уравнения реакций в молекулярной и сокращенной ионной формах.
Запишите наблюдения (цвет и характер осадка). Составьте уравнения происходящих реакций в молекулярном и ионном видах. Назовите полученные вещества.
2) реакции с образованием газов.
Опыт 5 В пробирку налейте 1–2 мл раствора раствора хлорида аммония (NH4Cl) и 1–2 мл раствора щелочи.
Опыт 6 В пробирку поместите несколько кристалликов карбоната кальция СaСO3. Растворилась ли соль в воде? Прилейте 1–2 мл разбавленного раствора серной кислоты. Что наблюдаете? Запишите уравнения реакций в молекулярной и сокращенной ионной формах.
Опыт 7. В пробирку налейте 1–2 мл раствора соды Na2СO3, добавьте 1 – 2 мл разбавленного раствора соляной кислоты НCl. Что наблюдаете? Запишите уравнения реакций в молекулярной и сокращенной ионной формах.
Запишите наблюдения (цвет и запах газов). Составьте уравнения происходящих реакций в молекулярном и ионном видах. Назовите полученные вещества.
3) реакции, идущие с образованием малодиссоциирующих веществ.
Опыт 8. В пробирку налейте 1–2 мл раствора гидроксида натрия и добавьте индикатор - фенолфталеин.
Запишите наблюдения. Объясните причину изменения окраски индикатора.
Добавьте по каплям в пробирку раствор соляной кислоты до обесцвечивания. Объясните причину обесцвечивания.
Опыт 9. В пробирку налейте 1–2 мл раствора а сульфата меди и немного гидроксида натрия. Запишите наблюдения. Прилейте в эту же пробирку кислоты до растворения осадка. Запишите наблюдения.
Поясните, почему в опыте 8 произошло обесцвечивание, а опыте 9- растворение осадка. Составьте уравнения происходящих реакций в молекулярном и ионном видах. Назовите полученные вещества.
Вопросы для выводов
1.Указать: в чём заключается сущность реакций ионного обмена.
2.Условия течения реакций ионного обмена идущей до конца (необратимой реакции).
3.К какому типу относятся реакции;
4.Сформулировать в каком направлении протекают ионно-обменные реакции.
Контрольные вопросы и задачи
1. Что называют электролитической диссоциацией?
2. Какие реакции называются ионно-обменными?
3. Чем отличаются сильные и слабые электролиты? Приведите примеры электролитов сильных, слабых и средней силы.
4. В каком случае обменные реакции протекают до конца? Приведите примеры.
5. Какие из приведенных пар веществ реагируют между собой в растворе практически до конца? Составьте уравнения реакций в молекулярной, полной ионной (ионно-молекулярной) и сокращенной ионной формах.
а) BaCl2 + Na2SO4 →…;
г) FeS + HCl →…;
б) AlCl3 + KOH →…;
д) ZnCl2 + NaOH →…;
в) Zn(OH)2 + KOH →…;
е) AlCl3 +Na3PO4 →…;
6. Завершите приведенные ниже ионные уравнения. Приведите примеры двух уравнений в молекулярной форме, соответствующих этому ионному уравнению:
а) ион водорода + гидроксид-ион → ...;
б) карбонат-ион + ион водорода →…;
7. Каким молекулярным и ионно-молекулярным уравнениям соответствуют следующие сокращенные ионные уравнения?
а) Ag+ + Cl– = AgCl
б) Cu2+ + S2– = CuS
в) Ba2+ + SO42+ = BaSO42+.
8. Какие из приведенных ниже веществ реагируют практически до конца:
а) соляная кислота и нитрат серебра;
б) серная кислота и хлорид натрия;
в) сульфат натрия и гидроксид бария;
г) азотная кислота и гидроксид калия;
д) хлорид натрия и гидроксид калия?
Ответ обоснуйте.
9. Как называются реакции между кислотой и основанием? Почему?
Лабораторная работа №3
Приготовление раствора заданной концентрации
Цель: приготовить растворы солей определенной концентрации.
Оборудование: стакан объемом 50 мл; стеклянная палочка с резиновым наконечником;
весы; стеклянная лопаточка; мерный цилиндр; соли; холодная кипяченая вода.
Реактивы: хлорид натрия, хлорид калия, дистиллированная вода.
Краткие теоретические сведения
Раствором называют гомогенную систему, состоящую из двух и более веществ.
Растворы всегда однофазны, т. е. представляют собой однородный газ, жидкость или твердое вещество. Это связано с тем, что одно из веществ распределено в массе другого в виде молекул, атомов или ионов (размер частиц менее 1 нм).
Растворителем считают вещество, агрегатное состояние которого не изменяется при образовании раствора. Например, вода в водных растворах поваренной соли, сахара, углекислого газа. Если же раствор образовался при смешении газа с газом, жидкости с жидкостью и твердого вещества с твердым, растворителем считают тот компонент, которого больше в растворе. Столовый уксус, в котором содержится от 5 до 9% уксусной кислоты, представляет собой раствор этой кислоты в воде (растворитель — вода). Наибольшее значение имеют водные растворы. Природная вода всегда содержит растворенные вещества. Природные водные растворы участвуют в процессах почвообразования и снабжают растения питательными веществами. Сложные процессы жизнедеятельности, происходящие в организмах человека и животных, также протекают в растворах.
Концентрация — величина, характеризующая количественный состав раствора. Концентрацией растворённого вещества (не раствора) называют отношение количества растворённого вещества или его массы к объёму раствора (моль/л, г/л). Растворы с большим количеством растворенного вещества называют концентрированными, а с малым — разбавленными.
Массовая доля Массовая доля — отношение массы растворённого вещества к массе раствора. Массовая доля измеряется в долях единицы или в процентах:
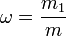 ,
,
где:
m1 — масса растворённого вещества, г;
m — общая масса раствора, г .Это масса растворённого вещества и растворителя (или воды).
Молярная концентрация Молярная концентрация — количество растворённого вещества (число молей) в единице объёма раствора. Молярная концентрация измеряется в моль/м³, однако на практике её гораздо чаще выражают в моль/л или ммоль/л. Возможно другое обозначение молярной концентрации 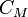 , которое принято обозначать М. Так, раствор с концентрацией 0,5 моль/л называют 0,5-молярным.
, которое принято обозначать М. Так, раствор с концентрацией 0,5 моль/л называют 0,5-молярным.
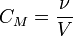 ,
,
где:
ν — количество растворённого вещества, моль;
V — общий объём раствора, л.
Задание
1. Приготовление раствора соли с определенной массовой долей вещества.
Ход работы:
Произведите расчеты: определите, какую массу соли и воды потребуется взять для приготовления раствора, указанного в условии задачи.
Задача: приготовьте 20 г водного раствора поваренной соли с массовой долей соли 5 %.
Отвесьте соль и поместите ее в стакан.
Отмерьте измерительным цилиндром необходимый объем воды и вылейте в колбу с навеской соли.
Внимание! При отмеривании жидкости глаз наблюдателя должен находиться в одной плоскости с уровнем жидкости. Уровень жидкости прозрачных растворов устанавливают по нижнему мениску.
Отчет о работе:
- проведите расчеты;
Образец оформления работы
Задание 1.
| Дано: m(раствора) =20 г w1(NaCl)= 5% þ(H2O) = 1г/мл | Найти: m(NaCl)= ? V(H2O)= ? |
| Решение: m(NaCl)= m((H2O)= V(H2O)= |
2. Приготовление раствора с заданной молярной концентрацией.
Под молярной концентрацией понимают число молей растворенного вещества, содержащегося в одном литре раствора (1 л раствора).
Задача. Приготовьте 25 мл раствора хлорида калия, молярная концентрация которого 0,2 моль/л.
Рассчитайте массу растворенного вещества в 1000 мл раствора заданной молярной концентрации.
Рассчитайте массу растворенного вещества в предложенном объеме раствора.
В соответствии с расчетами возьмите навеску соли, поместите ее в мерный стакан и добавьте немного воды (примерно 7-10 мл) помешивая стеклянной палочкой, растворите полностью соль, а затем прилейте воды до необходимого по условию задачи объема.
Отчет о работе:
- приведите расчеты;
Образец оформления работы
Задание 2.
| Дано: V(раствора КCl)= 25мл Cm =0,2 моль/л V(H2O)= 1000мл | Найти: m(КCl)= ?
|
| Решение: М(КСl) = m(KCl)= |
Контрольные вопросы
1 Дайте определение молярной концентрации, запишите её формулу.
2 Дайте определение массовой доли вещества, запишите её формулу
3. Какие растворы называют разбавленными и концентрированными?
4. Дайте определение понятию растворимость
5. Какие факторы влияют на процесс растворения?
6. Вычислите массу гидроксида натрия и воды, которые требуются для приготовления 5кг 10%-ого раствора?
7. Определите массу азотной кислоты, которая содержится в 250мл её раствора с массовой долей растворенного вещества 20% (плотность азотной кислоты составляет 1, 115г/мл)
Лабораторная работа №4 Определение характера среды раствора с помощью индикаторов
Цель работы:
- исследовать, как действуют кислоты и основания на индикаторы
- научиться определять реакцию среды растворов кислот и щелочей
Реактивы: раствор серной кислоты ; раствор соляной кислоты; раствор лакмуса; раствор метилового оранжевого (метилоранж); раствор фенолфталеина; раствор гидроксида калия.
Оборудование: штатив с пробирками.
Краткие теоретические сведения
Индика́тор (лат. indicator — указатель) — соединение, позволяющее визуализировать изменение концентрации какого-либо вещества или компонента или быстро определить pH. параметры.
Применение индикаторов Индикаторы позволяют быстро и достаточно точно контролировать состав жидких или газообразных сред, следить за изменением их состава, или за протеканием химической реакции. Широко используются кислотно-основные индикаторы, разбавленные растворы которых обладают способностью заметно изменять цвет, в зависимости от кислотности раствора. Причина изменения цвета — изменения в строении молекул индикатора в кислой и щелочной среде, что приводит к изменению спектра поглощения раствора.
Универсальная индикаторная бумага
Широко применяются смеси индикаторов, позволяющие определить значение рН растворов в большом диапазоне концентраций (1-10; 0-12). Растворами таких смесей - «универсальных индикаторов» обычно пропитывают полоски «индикаторной бумаги», с помощью которых можно быстро (с точностью до единиц рН, или даже десятых долей рН) определить кислотность исследуемых водных растворов. Для более точного определения полученный при нанесении капли раствора цвет индикаторной бумаги немедленно сравнивают с эталонной цветовой шкалой.
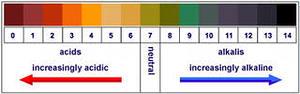
Таблица №1. Изменение цвета индикаторов
| Индикатор | Среда |
|
| кислая | нейтральная | щелочная |
| Лакмус | красный | бурый | синий |
| Фенолфталеин | бесцветный | бесцветный | красный |
| Метилоранж | красный | красный | оранжевый |
Ход работы:
В 3 пробирки внесите по 5 капель раствора соляной кислоты, к одной добавьте каплю лакмуса, а к другой – каплю метилоранжа, а к третьей – каплю фенолфталеина
Как изменяется окраска индикаторов от действия кислоты? Что наблюдаете? Какой можно сделать общий вывод о действии кислот на индикаторы – лакмус, метилоранж и фенолфталеина? Согласуется ли вывод с таблицей «Изменение цвета индикаторов».
Теперь проделайте то же самое с раствором КОН. В 3 пробирки добавьте несколько капель раствора щелочи КОН, к одной добавьте каплю лакмуса, а к другой – каплю метилоранжа, а к третьей – каплю фенолфталеина. Посмотрите, как изменилась окраска индикаторов от действия щелочи? Какой можно сделать общий вывод о действии оснований на индикаторы – лакмус и метиловый оранжевый? Согласуется ли вывод с таблицей «Изменение цвета индикаторов». Все данные запишите в таблицу №2.
На полоску универсальной индикаторной бумаги нанесите пипетками по одной капле раствора соляной кислоты, гидроксида калия и воды. Результаты наблюдений занесите в таблицу №2 укажите значение pH и его цвет.
Таблица № 2
|
| HCl | KOH | H2O |
| Индикатор |
|
|
|
| Лакмус |
|
|
|
| Фенолфталеин |
|
|
|
| Метилоранж |
|
|
|
| Универсальный индикатор (pH от 1 до 14) |
|
|
|
Контрольные вопросы
Как изменяется окраска индикаторов от действия кислоты?
Как изменяется окраска индикаторов от действия щелочи?
Дайте определению индикатор
какие ионы влияют на изменение окраски индикатора?
Лабораторная работа №5 Получение и свойства гидроксида цинка и гидроксида алюминия
Цель:
-получить и изучить свойства гидроксида цинка и гидроксида алюминия
-научиться составлять молекулярные и ионные уравнения реакций
Реактивы: дистиллированная вода.
Оборудование: штатив с пробирками.
Краткие теоретические сведения
Амфоте́рные гидрокси́ды (амфоте́рность от греч. (ἀμφότεροι — «двойственный», «обоюдный») — неорганические соединения, гидроксиды амфотерных элементов, в зависимости от условий проявляющие свойства кислотных или осно́вных гидроксидов.
Все амфотерные гидроксиды являются твёрдыми веществами. Нерастворимы в воде, в основном являются слабыми электролитами. При нагревании разлагаются с образованием соответствующего амфотерного оксида, например:
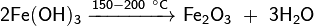
Получение Получают при взаимодействии солей алюминия с водными растворами щёлочи, избегая их избытка:
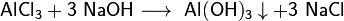
Высушенный гидроксид алюминия представляет собой белое кристаллическое вещество, нерастворимое в кислотах и щёлочах.
Химические свойства Свежеосаждённый гидроксид алюминия может взаимодействовать с кислотами. При взаимодействии с кислотами образуют соли с амфотерным элементом в катионе, например:

При взаимодействии со щёлочью образуют соли с амфотерным элементом в анионе, например:
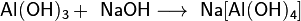
При этом образуются соли ортоалюминиевой кислоты H3AlO3 (ортоалюминаты) либо соли метаалюминиевой кислоты HAlO2 (метаалюминаты).
Ход работы
Опыт 1. В две пробирки накапать по 2 капли раствора сульфата цинка и раствора гидроксида натрия до образования осадка. В первую пробирку к образовавшемуся осадку гидроксида цинка добавить избыток раствора соляной кислоты, во вторую пробирку – избыток раствора гидроксида натрия, Охарактеризовать внешний вид осадка гидроксида цинка. Составить уравнение реакции образования гидроксида цинка в молекулярной и ионной форме:
1.1. ZnSO4+NaOH→…;
недост.
- составить уравнения реакций взаимодействия гидроксида цинка с соляной кислотой в молекулярной и ионной форме
1.2. Zn(OH)2+HCl→…;
- составить уравнение реакции взаимодействия гидроксида цинка с избытком гидроксида натрия, учитывая, что образуется тетрагидроксоцинкат натрия
1.3. Zn(OH)2+NaOH→…;
изб.
- ответить, какие кислотно-основные свойства проявляет гидроксид цинка;
- объяснить растворение гидроксида цинка в избытке аммиака;
- составить уравнение реакции, учитывая, что происходит образование гидроксида тетрааминцинка
Опыт 2 .В две пробирки накапать по 2 капли раствора соли сульфата алюминия и раствора гидроксида аммония до образования осадка. В первую пробирку к осадку гидроксида алюминия добавить избыток раствора соляной кислоты, во вторую пробирку – избыток раствора гидроксида натрия.
- охарактеризовать внешний вид осадка гидроксида алюминия;
- составить уравнение реакции образования гидроксида алюминия в молекулярной и ионной форме
2.1. Al2(SO4)3+NH4OH→…;
- отметить, какие изменения происходят с осадком гидроксида алюминия при добавлении избытка соляной кислоты и избытка гидроксида натрия;
- составить уравнение реакции взаимодействия гидроксида алюминия с соляной кислотой в молекулярной и ионной форме
2.2. Al(OH)3+HCl→…;
- составить уравнение реакции взаимодействия гидроксида алюминия с избытком гидроксида натрия:
2.3. Al(OH)3+NaOH→…;
- ответить, какие кислотно-основные свойства проявляет гидроксид алюминия.
Контрольные вопросы
Объясните значение терминов «амфотерный оксид», «амфотерный гидроксид».
Какие кислотно-основные свойства проявляет гидроксид алюминия?
Какие кислотно-основные свойства проявляет гидроксид цинка?
Составьте уравнения реакций в молекулярной, полной ионной (ионно-молекулярной) и сокращенной ионной формах
а) AlCl3 + KOH →…;
б) ZnCl2 + NaOH →…;
в) Zn(OH)2 + KOH →…
Лабораторная работа №6
Взаимодействие металлов с кислотами
Цель:
- исследовать, все ли металлы реагируют с кислотами, всегда ли при этом выделяется водород?
- научиться составлять УХР и делать выводы
- познакомились с рядом активности металлов
Оборудование и реактивы: спиртовка, пробирки, гранулы цинка, железные опилки, держатель для пробирок, несколько кусочков меди и алюминия, раствор соляной кислоты, раствор серной кислоты
Краткие теоретические сведения
Взаимодействие с соляной кислотой (HCl)
Соляная кислота – это техническое название хлороводородной кислоты. Поэтому независимо от концентрации соляной кислоты процесс диссоциации ее молекул в водном растворе протекает активно:
HCl → H+ + Cl-
Образующиеся в этом процессе ионы водорода H+ выполняют роль окислителя, окисляя металлы, расположенные в ряду активности левее водорода. Взаимодействие протекает по схеме:
Me + HCl → соль + H2↑
При этом соль представляет собой хлорид металла (NiCl2, CaCl2, AlCl3), в котором число хлорид-ионов соответствует степени окисления металла.
Взаимодействие с серной кислота (H2SO4)
В промышленности получают серную кислоту очень высокой концентрации (до 98%). Следует учитывать различие окислительных свойств разбавленного раствора и концентрированной серной кислоты по отношению к металлам.
Разбавленная серная кислота
В разбавленном водном растворе серной кислоты большинство ее молекул диссоциируют:
H2SO4 → H+ + HSO4-
HSO4- → H+ + SO42-
Образующиеся ионы Н+ выполняют функцию окислителя. Как и соляная кислота, разбавленный раствор серной кислоты взаимодействует только с металлами активными и средней активности (расположенными в ряду активности до водорода).
Химическая реакция протекает по схеме:
Ме + H2SO4(разб.) → соль + H2↑
Электрохимический ряд активности металлов (ряд напряжений, ряд стандартных электродных потенциалов) — последовательность, в которой металлы расположены в порядке увеличения их стандартных электрохимических потенциалов φ0,
| Li→K→Ba→Ca→Na→Mg→Al→Mn→Zn→Cr→Fe→Co→Ni→Sn→Pb→H→Cu→Hg→Ag→Pt→Au |
Ход работы:
В пробирки положите разные металлы: в одну- гранулу цинка, в другую – железные опилки, в третью – кусочки меди, в четвертую – кусочки алюминия. Во все пробирки налейте по 1 мл раствора серной кислоты. Что замечаете? Если в какой-либо пробирки не наблюдается реакция, то слегка нагрейте ее содержимое (осторожно!), но не доводя до кипения. Докажите, в каких пробирках выделяется газ водород.
Сделайте общий вывод об отношении кислот к металлам. Для этого воспользуйтесь схемой:
Отношение металлов к воде и к некоторым кислотам
| K, Ca, Na, Mg, Al | Cu, Hg, Ag, Pt, Au |
| Реагируют с растворами соляной и серной кислот с выделением водорода | Не реагируют с растворами соляной и серной кислот |
Вопросы для вывода
Какой из металлов, взятый для опытов, не реагирует с раствором серной кислот? Какие еще металлы не реагируют с этими кислотами?
К какому типу реакций относится взаимодействие кислоты с металлом?
Контрольные вопросы
С какими из перечисленных веществ взаимодействует соляная кислота: Mg, Cu, Ca,Cu, Fe?
При помощи каких реакций можно осуществить следующие превращения:
Zn → ZnS → ZnO → ZnCl2 → Zn(OН)2
Fe→ FeCl2 → Fe(OH)2 → FeO→ Fe→ FeCl3 → Fe(OH)3→ Fe2O3→Fe
Ca → CaO→ Ca(OH)2 → CaCl2 → CaSO4 → Ca(NO3)2
Подобрать коэффициенты в уравнении реакции, указать окислитель, восстановитель, процесс окисления и восстановления:
Mg + O2 MgO
Cu + Cl2 CuCl2
Zn + HCl ZnCl2 + H2
Лабораторная работа №7
Получение аммиака и изучение его свойств
Цель работы:.
- приобрести навыки получения, собирания и распознавания аммиака
- научиться составлять УХР и делать выводы
- проводить наблюдения и делать выводы.
Реактивы: Разбавленные растворы солей, оснований: NH4Cl и KOH, KMnO4 , H2SO4, NH4OH, индикаторная бумаги (универсальная).
Оборудование. Штатив с пробирками, спиртовка, держатель.
Краткие теоретические сведения
Аммиа́к — NH3, нитрид водорода, при нормальных условиях — бесцветный газ с резким характерным запахом (запах нашатырного спирта). По физиологическому действию на организм относится к группе веществ удушающего и нейротропного действия. Пары аммиака сильно раздражают слизистые оболочки глаз и органов дыхания, а также кожные покровы.
Аммиак относится к числу важнейших продуктов химической промышленности, ежегодное его мировое производство достигает 150 млн тонн. В основном используется для производства азотных удобрений (нитрат и сульфат аммония, мочевина), взрывчатых веществ и полимеров, азотной кислоты, соды (по аммиачному методу) и других продуктов химической промышленности. Жидкий аммиак используют в качестве растворителя. В холодильной технике используется в качестве холодильного агента.
Благодаря наличию неподеленной электронной пары во многих реакциях аммиак выступает как основание. Так, он присоединяет протон, образуя ион аммония:
NН3 + Н+ → [NН4]+
Водный раствор аммиака («нашатырный спирт») имеет слабощелочную реакцию из-за протекания процесса:
NН3 + Н2O → [NН4]+ + ОH-
Аммиак - сильный восстановитель. Например, он взаимодействует с кислородом, образуя азот и воду:
4NH3 + 3O2 = 2N2 + 6H2O
В присутствии катализатора аммиак окисляется до оксида азота (II):
4NH3 + 5O2 = 4NO + 6H2O
Ход работы:
Опыт 1. Получение и обнаружение аммиака.
В пробирку прилейте 1—2 мл раствора хлорида аммония (NH4Cl), а затем такой же объем раствора щелочи NaOH (или KOH). Закрепите пробирку в держателе и осторожно нагрейте на пламени горелки. Что наблюдаете? Осторожно понюхайте выделяющийся газ. Что ощущаете? Выделение аммиака установить с помощью влажной индикаторной бумаги (универсальной или красно - лакмусовой). Поднесите к отверстию пробирки влажную красную лакмусовую бумажку. Что наблюдаете? Какие свойства проявляет гидроксид аммония?
В отчете записать наблюдения, а также уравнения реакций образования аммиака в молекулярной и ионной формах.
t
NH4Cl + NaOH → …
NH3 + H2O → …
Опыт 2. Восстановительные свойства раствора аммиака
В пробирку поместить по 5 - 6 капель растворов перманганата калия, подкислить его серной кислотой и прибавлять по каплям раствор аммиака до обесцвечивания окраски. Написать уравнения реакций и подобрать в них коэффициенты методом электронного баланса.
В отчете записать наблюдения, а также уравнения реакций в молекулярной и ионной формах.
КМnO4 + H2SO4 + NH4OH →
Контрольные вопросы
При помощи каких реакций можно осуществить следующие превращения:
NH3→ N2 → NO→NO2 → HNO3 → NH4NO3
2. Определите степень окисления азота в следующих соединениях: NH3, N2O, NO2
3. Допишите уравнения реакций:
NH3 + H2SO4 →
NH4OH + H3РO4 →
NH4Сl + NaOH →
4. Объясните почему водные растворы аммиака проявляют щелочную среду?
5. С помощью каких реакций можно доказать восстановительные свойства аммиака?
Лабораторная работа № 8
Получение оксида углерода (IV) и изучение его свойств.
Цель работы.
- приобрести навыки получения, собирания и распознавания оксида углерода (IV).
- научиться составлять УХР и делать выводы
- проводить наблюдения и делать выводы.
Реактивы. Разбавленные растворы оснований, кислот: Ca(ОН)2, СaСO3, HCl, Na2СO3 , индикаторная бумаги (универсальная).
Оборудование. Штатив с пробирками, аппарат Кипа, стеклянная трубочка.
Краткие теоретические сведения
Оксид углерода(IV) — углекислый газ, газ без запаха и цвета, при сильном охлаждении кристаллизуется в виде белой снегообразной массы — «сухого льда». Углекислый газ образуется при гниении и горении органических веществ. Содержится в воздухе и минеральных источниках, выделяется при дыхании животных и растений. Растворим в воде (1 объём углекислого газа в одном объёме воды при 15 °С).
По химическим свойствам диоксид углерода относится к кислотным оксидам. При растворении в воде образует угольную кислоту. Реагирует с щёлочами с образованием карбонатов и гидрокарбонатов. Оксид углерода(IV) не поддерживает горения. Только некоторые активные металлы горят в нём, так как отнимают кислород.
2Mg + CO2 → 2MgO + C
Взаимодействие с оксидом активного металла:
CaO+CO2 → CaCO3
При растворении в воде образует угольную кислоту:
CO2 + H2O ↔ H2CO3
Реагирует со щёлочами с образованием карбонатов и гидрокарбонатов:
Ca(OH)2 + CO2 → CaCO3↓ + H2O (качественная реакция на углекислый газ)
KOH + CO2 → KHCO3
Ход работы:
Опыт 1. Получение оксида углерода (IV) и его взаимодействие с водой
В аппарат Киппа поместите кусочек мрамора и прилейте раствор соляной кислоты. Что наблюдаете? Через 1—2 минуты внесите в верхнюю часть пробирки горящую лучинку. Что наблюдаете? Поднесите к отверстию пробирки влажную красную лакмусовую бумажку или универсальную индикаторную бумагу. Что наблюдаете? Запишите уравнение реакции в молекулярной и ионной формах.
СaСO3+ HCl →…
Составить уравнение реакции взаимодействия оксида углерода (IV) с водой:
CO2+H2O↔…;
Опыт 2 Распознавание солей угольной кислоты
В пробирку налейте 1—2 мл прозрачного раствора Na2СO3 и прилейте раствор соляной кислоты. Что наблюдаете? Запишите уравнение реакции в молекулярной и ионной формах.
Na2СO3 + HCl →…
Опыт 3 В пробирку налейте 1—2 мл прозрачного раствора известковой воды Ca(ОН)2. Используя чистую стеклянную трубочку, осторожно продувайте через раствор выдыхаемый вами воздух. Что наблюдаете? Запишите уравнение ре акции в молекулярной и ионной формах.
Ca(ОН)2 + CO2 → …
Контрольные вопросы
Как можно охарактеризовать кислотно-основные свойства оксида углерода (IV) и угольной кислоты?
Напишите диссоциацию угольной кислоты по ступеням.
Приведите все известные названия оксида углерода (IV).
Составить уравнение реакции взаимодействия оксида углерода (IV) с NaOH.
Допишите и уравняйте реакции:
СО+О2 → …
С + О2 → …
СО2 + К2О → …
NaHCO3 + HCl → …
Лабораторная работа № 9
Изучение свойств карбоновых кислот
Цель работы:
- изучить свойства карбоновых кислот
- исследовать химические свойства карбоновых кислот, в лаборатории соблюдая правила техники безопасности
- проводить наблюдения и делать выводы
- научиться составлять УХР
Оборудование и реактивы: уксусная кислота (СН3СООН), раствор гидроксида калия, универсальная индикаторная бумага, пробирки, шпатель,cода (NaHCO3) или мел (СаСО3), гранулу цинка (Zn).
Краткие теоретические сведения
Карбо́новые кисло́ты — класс органических соединений, молекулы которых содержат одну или несколько функциональных карбоксильных групп -COOH. Кислые свойства объясняются тем, что данная группа может сравнительно легко отщеплять протон.
Карбоновые кислоты обладают свойствами, характерными для минеральных кислот. Они реагируют с активными металлами, основными оксидами, основаниями, солями слабых кислот.
2СH3COOH + Mg → (CH3COO)2Mg + H2
2СH3COOH + СaO → (CH3COO)2Ca + H2O
H–COOH + NaOH → H–COONa + H2O
2СH3CH2COOH + Na2CO3 → 2CH3CH2COONa + H2O + CO2
СH3CH2COOH + NaHCO3 → CH3CH2COONa + H2O + CO2
Карбоновые кислоты слабее многих сильных минеральных кислот (HCl, H2SO4 и т.д.) и поэтому вытесняются ими из солей: СH3COONa + H2SO4(конц.) → CH3COOH + NaHSO4
Ход работы
Опыт № 1.
Налейте в пробирку 1 мл раствора уксусной кислоты. Осторожно понюхайте этот раствор. Что ощущаете? В пробирку с раствором уксусной кислоты опустите полоску универсальная индикаторной бумаги, по изменению цвета судите о рН среды.
Опыт № 2
Затем в пробирку с раствором уксусной кислоты добавьте избытком щелочи. Что наблюдаете? Запишите УХР.
Опыт № 3.
В пробирку наливают 2 мл уксусной кислоты. Затем шпателем добавляют небольшое количество соды или мела. Запишите наблюдения. Запишите УХР. Сделайте выводы о свойствах карбоновых кислот.
Опыт № 4.
В пробирку наливают 2 мл уксусной кислоты добавьте гранулу цинка. Что наблюдаете? Запишите УХР.
Контрольные вопросы
1. Дать определение классу веществ "Карбоновые кислоты".
2. Назовите три основных способа получения уксусной кислоты.
3. Где вы применяете уксусную кислоту дома?
4. Указать какие свойства карбоновых кислот как неорганических кислот были исследованы в данной работе?
5. Допишите уравнения реакций:
СН3 СООН + ZnО →
СН3 СООН + Сu(ОН) 2 →
Список литературы
Габриелян О. С. Химия. 11класс: учеб. для общеобразоват. учрежден. – М.:Дрофа, 2006. – 362с.
Саенко О.Е. Химия для колледжей: учеб. – Ростов н/Д., 2009. – 282с.
ru.wikipedia.org
28

 Получите свидетельство
Получите свидетельство Вход
Вход














 Методические указания к выполнению и оформлению лабораторных работ по предмету «Химия» (0.4 MB)
Методические указания к выполнению и оформлению лабораторных работ по предмету «Химия» (0.4 MB)
 0
0 2804
2804 673
673 Нравится
0
Нравится
0



