
- Степень окисления
- Окислитель
- Электролитическая диссоциация
- Электролит
- Ион гидроксония

Нужна нам везде и всегда сильнейшая серная кислота…
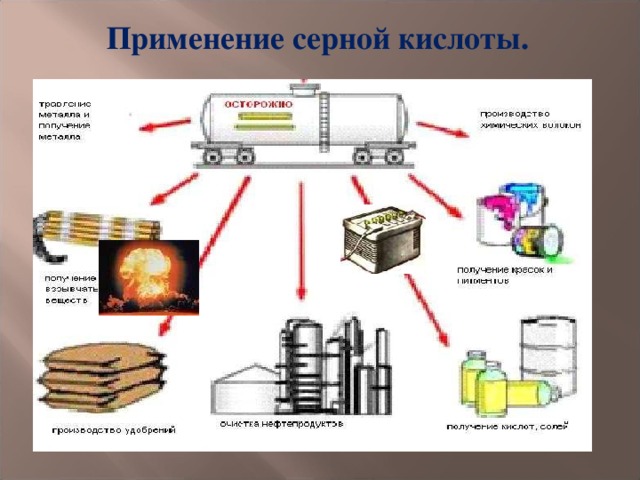
Применение серной кислоты.


1. физические свойства;
2. химические свойства:
- общие с другими кислотами;
- специфические?

1) определять тип химической реакции;
2) составлять ионные уравнения химических реакций;
3) составлять ОВР;
4) определять окислитель и восстановитель;
5) проводить химический эксперимент, делать выводы.


- Какова основность серной кислоты?
- Сколько ступеней диссоциации характерно?
- Напишите уравнения ступенчатой диссоциации серной кислоты.
- Докажите кислую среду раствора с помощью индикаторной бумаги.

1. при добавлении лакмуса….
Сделайте вывод.

1. Проведите опыт, согласно задания.
2. Запишите уравнение реакции в молекулярном, полном ионном и сокращенном ионном видах.
3. Рассмотрите уравнение как ОВР.

1. Проведите опыт, согласно задания.
2. Запишите уравнение реакции в молекулярном, полном ионном и сокращенном ионном видах.

1. Проведите опыт, согласно задания.
2. Запишите уравнение реакции в молекулярном, полном ионном и сокращенном ионном видах.

1. Проведите опыт, согласно задания.
2. Запишите уравнение реакции в молекулярном, полном ионном и сокращенном ионном видах.

Проявляет ли разбавленная серная кислота (раствор) свойства, характерные для всех других кислот?
Каким ионом определяются общие химические свойства серной кислоты?

1. Продуктом окисление является соль (сульфат).
Продуктом восстановления является SO2 , S , H2S
Н2 никогда не выделяется, а образуется вода.
2. Серная кислота гигроскопична!
3. Реакция растворения серной
кислоты в воде экзотермическая.
Не забывай правила разбавления!

H2SO4 – сильная кислота.
Свойства разбавленной и концентрированной серной кислоты отличаются: в разбавленной окислителем является ион водорода Н+ , а в концентрированной – S+6 .

1. Параграф 22
2. Расставить коэффициенты в уравнении методом электронного баланса.
Zn + Н2 SO4= ZnSO4+H2S +H2O
3. Составьте генетический ряд серы. Осуществите превращения ( не менее 6 реакций).

СПАСИБО
ЗА УРОК!


 Получите свидетельство
Получите свидетельство Вход
Вход





























 Серная кислота (2.42 MB)
Серная кислота (2.42 MB)
 0
0 697
697 24
24 Нравится
0
Нравится
0






