1.1. Роль элективных курсов в школе
В соответствии с одобренной Правительством РФ «Концепцией модернизации российского образования предусматривается профильное обучение старшеклассников. Профильное обучение – форма дифференциации и индивидуализации обучения, которое позволяет за счет изменений в структуре, содержании и организации образовательного процесса более полно учитывать интересы, склонности и способности обучающихся, создавать условия для образования старшеклассников в соответствии с их профессиональными интересами.
Переход к профильному обучению позволяет создать условия для дифференциации содержания обучения старшеклассников, построения индивидуальных образовательных программ; обеспечить углубленное изучение отдельных учебных предметов; установить равный доступ к полноценному образованию разным категориям обучающихся, расширить возможности их социализации; обеспечить преемственность между общим и профессиональным образованием.
Профильное обучение предусматривает возможность для каждого учащегося обучаться по индивидуальному учебному плану, который строится на основе базисного плана и включает следующие основные блоки: 1) базовые общеобразовательные предметы (обязательные для всех учащихся во всех профилях обучения); 2) профильные общеобразовательные предметы (предметы повышенного уровня, определяющие направленность каждого конкретного профиля обучения, которые являются обязательными для учащихся, выбравших данный профиль); 3)элективные курсы, обязательные курсы по выбору учащихся, определяемые профилем обучения, они реализуются за счет времени, отводимого на компонент образовательного учреждения.
Содержание первых двух блоков учебных предметов определяется федеральным компонентом государственного стандарта общего образования и контролируется ЕГЭ. Элективные курсы играют важную роль в системе профильного обучения на старшей ступени школы. Количество их в составе профиля должно быть избыточным по сравнению с курсами, которые обязан выбрать учащийся.
Таким образом, создание элективных курсов – важнейшая часть обеспечения профильного обучения
1.1.1. Классификация элективных курсов по химииМожно выделить следующие типы элективных курсов по химии:
1. Предметные курсы, цель которых – углубление и расширение содержания профильного общеобразовательного курса химии.
Курсы повышенного уровня, направленные на углубленное изучение всех разделов учебного предмета «Химия».
Спецкурсы, в которых углубленно изучаются отдельные разделы профильного курса химии, входящие в обязательную программу данного предмета (например, «Химия полимеров»).
Спецкурсы, в которых углубленно изучаются отдельные разделы основного курса, не входящие в обязательную программу («Квантовая химия», «Химия плазмы», «Ядерные реакции»).
Прикладные элективные курсы, цель - ознакомить учащихся с важнейшими путями и методами применения знаний на практике, развитие интереса учащихся к современной технике и производству.
Элективные курсы, в которых изучаются химические методы познания природы («Как делаются открытия»).
Элективные курсы, посвященные истории химии (Современные проблемы химии», История органической химии»).
Элективные курсы, содержанием которых является составление и решение задач по химии
Межпредметные элективные курсы, обеспечивающие интеграцию знаний учащихся о природе и обществе («Алхимия как феномен культуры», «Экологическая химия», «Химия и здоровье»).
3. Элективные курсы по предметам, не входящим в базисный учебный план, но поддерживающие их изучение, профессиональное самоопределение учащихся (например, «Мир профессий»).
1.1.2. Требования к разработке элективных курсов
Министерством образования и науки РФ определены требования к учебным изданиям для профильного обучения. Они направлены на реализацию личностно ориентированного подхода к обучению и воспитанию, на создание условий для самообразования и творческой работы учащихся.
В основу разработки курса должны быть положены принципы, соответствующие логике отбора и реализации содержания личностно ориентированного образования (систематизация, целеполагание, трансформация содержания профессиональной деятельности в дидактические объекты, проектирование технологии изучения курса,, оформление содержания и технологии его освоения в виде программ).
При разработке содержания и учебно-методической системы курса необходимо четко обозначить место курса в соотнесении с общеобразовательными и базовыми профильными предметами. Важно показать, какие межпредметные связи реализуются при изучении элективного курса, какие умения и навыки при этом развиваются, каким образом создаются условия для активизации познавательного интереса учащихся, профессионального самоопределения.
Цели и задачи изучения курса желательно формулировать в терминах, понятных и учителю, и учащимся. В целях указывается, для чего изучается курс, какие образовательные потребности он удовлетворяет. В соответствии с целями ставятся задачи изучения. Методы и формы обучения должны определяться требованиями профилизации обучения, учета индивидуальных особенностей учащихся, развития и саморазвития личности. Ведущее место в профильном обучении следует отвести методам проблемного, практического и исследовательского характера, стимулирующим познавательную активность учащихся (дискуссии, эксперименты, учебные проекты). Значительной должна быть доля самостоятельной работы с различными источниками учебной информации.
При определении форм организации учебных занятий следует исходить прежде всего из специфических целей курса. Поскольку не исключается изучение элективного курса даже одним учащимся, необходимо предусмотреть варианты изучения, как в коллективных, так и в индивидуально-групповых формах.
Тематический план включает в себя основное содержание всех разделов и тем курса с распределением учебного времени. Отдельно выделяются практические и лабораторные работы, экскурсии, работа над учебными проектами и др.
Важным элементом методического обеспечения элективного курса является определение ожидаемых результатов изучения курса, а также способов их диагностики и оценки. Ожидаемый результат изучения курса – это ответ на вопрос: какие знания, умения, опыт, необходимые для построения индивидуальной образовательной траектории в школе и последующей профессиональной деятельности будут получены, какие виды деятельности будут освоены и какие ценности будут предложены для усвоения. Результаты должны быть значимы в первую очередь для самих учащихся, что необходимо для обеспечения привлекательности курса на этапе первоначального знакомства с ним и его выбора школьниками.
Элективные курсы
Тема № 1. ВведениеКоллоидная химия – это наука, изучающая физические и химические свойства гетерогенных дисперсных систем и некоторых высокомолекулярных продуктов, а также поверхностные явления – физико-химические процессы, протекающие на границе раздела фаз. Дисперсные системы, являются основным объектом изучения коллоидной химии, состоят из дисперсной фазы – мелкие частицы, распределенные в сплошной фазе – дисперсионной среде.
Основы коллоидной химии заложены в 1860 году английским химиком Т. Гремом. В 1861году он ввел понятие о «коллоидах» и «кристаллоидах», а в 1864 предложил термины «золь» и «гель».
Первоначально под коллоидами понималось особая группа веществ, которые в растворе диффундируют очень медленно и не проходят через полупроницаемые перегородки. Однако в начале XX века было доказано, что в виде коллоида может быть получено любое вещество и, следовательно, нужно говорить не о коллоидных веществах, а о коллоидном состоянии вещества.
Многие минералы, природные воды, вирусы, нервные мышечные клетки, кровь - все это коллоидные системы. Установлена связь между коллоидно-химическими свойствами почвы и ее плодородием. Например, почвенные коллоиды образуются в результате раздробления крупных частиц при выветривании или путем конденсации молекул или ионов. Почвенные коллоиды по происхождению бывают: минеральные, органические и органо-минеральные. Чем больше в почве коллоидов, тем больше гумуса, а, следовательно, и лучше плодородие почвы. Количество коллоидов в почве по массе до 30-40%.
В курсе коллоидной химии изучают и более грубые дисперсные системы (10-5 – 10-3 см) – суспензии, пены, аэрозоли, порошки. Эти системы имеют огромное значение в практической жизни человека. Продукты питания, сырье, полуфабрикаты относятся к этим системам – творог, сыры, хлеб, мука, какао-порошок, сухое молоко, сливочное масло, соки, шампанское и т.п. Хозяйственные товары, начиная с моющих средств, паст, красок и кончая строительными материалами (цемент, алебастр, мел, известь).
Тема № 2. Особенности и классификация дисперсных систем.
Особенности дисперсности систем
1. Все коллоидные растворы способны рассеивать свет – опалесцинировать.
2.Диффузия частиц в коллоидных растворах протекает медленно.
3.Маленькое осмотическое давление.
4.Коллоидные частицы могут выделяться из раствора, т.е. коагулировать.
Классификация дисперсных систем
1. Классификация по наличию или отсутствию взаимодействия между частицами дисперсной фазы.
Согласно этой классификации дисперсные системы делятся на свободнодисперсные и связаннодисперсные.
К свободнодисперсным системам относят типичные коллоидные растворы, суспензии, взвеси, разнообразные растворы высокомолекулярных веществ, которые обладают текучестью, как обычные жидкости и растворы.
К связаннодисперсным относят так называемые структурированные системы, в которых в результате взаимодействия между частицами возникает пространственная ажурная сетка-каркас, и система в целом приобретает свойства полутвердого тела.
2. Классификация дисперсных систем в зависимости от размеров частиц дисперсной фазы.
Грубодисперсные, когда величина частицы превышает 10-5 см (суспензии, эмульсии).
Коллоидные системы с размером частиц в пределах 10-5 – 10-7см.
Молекулярно-дисперсные системы имеют частицы размером порядка
10-8см. Это, как правило, растворы неэлектролитов (спирт, глюкоза и т.д.).
Ионно-дисперсные системы. Системы с наибольшей степенью дисперсности. Частицы меньше 10-8 см. Сюда относят растворы электролитов. [5, с.161]
3. Классификация дисперсных систем в зависимости от агрегатного состояния дисперсной фазы и дисперсионной среды.
| Дисперсионная среда | Дисперсные системы для дисперсной фазы | ||
|
Жидкая | Твердой | жидкой | газообразной |
| Т/Ж золи, суспензии, гели, пасты | Ж/Ж эмульсии | Г/Ж газовые эмульсии, пены | |
| твердая | Т/Т твердые золи, сплавы | Ж/Т твердые эмульсии, пористые тела | Г/Т твердые пены, пористые тела |
| газообразная | Т/Г дымы, пыли | Ж/Г туманы | Г/Г системы маловероятны |
Часто встречаются сложные дисперсные системы. Например, почва относится к сложной дисперсной системе типа Г,Ж/Т; ее твердая дисперсионная среда пронизана пространством заполненным воздухом и водным раствором.
Тема №3 Получение коллоидных растворов. Строение мицеллы и коагуляция коллоидных систем.
Получение коллоидных систем.


Методы получения
Конденсация Диспергирование
а) физическая (диспергируемое (механическое измельчение,
вещество берут в готовом виде); истирание твердых или
б) химическая (диспергируемое жидких тел).
вещество получают путем
химической реакции, например,
AgNO3 + KI=KNO3 + AgI ↓
Строение мицеллы.
Na2SiO3(изб) + 2NaCI→ 2NaCI + H2SiO3↓
{[m H2SiO3] n SiO32- *2(n-x)Na+}2x- 2xNa+
_____ _______________ __________
ядро адсорбционный диффузный
слой противоинов слой противоионов
___гранула__________________
____________мицелла_______________
Тема № 4 Основные свойства коллоидных систем
Молекулярно-кинетические;
Оптические;
Электрические;
Структурно-механические.
Молекулярно-кинетические свойства
а) броуновское движение; б) диффузия; в) осмос; г) седиментация.
Броуновское движение
Для коллоидных растворов характерно движение частиц дисперсной фазы, вызываемое беспорядочными ударами со стороны молекул среды, находящихся в тепловом движении. Его впервые наблюдал шотландский ботаник Броун. Именно поэтому движение частиц дисперсной фазы в дисперсионной среде золя называется броуновским. Если частица велика, то она испытывает одновременно множество ударов со всех сторон, в результате чего эти удары взаимно уравновешиваются. Частица коллоидной степени дисперсности, как очень малая, никогда не испытывает одинаково сильных и частых ударов сор всех сторон, и в одно мгновение более сильным оказывается удар с одной стороны, а в следующее мгновение – с другой. В результате направление движения каждой частицы подвергается непрерывному и притом беспорядочному изменению.
Изучение броуновского движения показало, что кинетические свойства коллоидных растворов близки кинетическим свойствам истинных растворов. Однако скорости перемещения частиц в коллоидных растворах меньше, чем в истинных (это связано с размерами частиц).
Кроме того, движение частиц молекулярной степени дисперсности нельзя наблюдать в микроскоп.
Диффузия в коллоидных системах.
Диффузией называют самопроизвольно протекающий в системе процесс выравнивания концентрации молекул, ионов или коллоидных частиц под влиянием их теплового хаотического движения, т.е. диффузия является макроскопическим проявлением теплового движения молекул и поэтому всегда идет тем быстрее, чем выше температура. Явление диффузии необратимо, она протекает до полного выравнивания концентрации.
Явление седиментации.
Седиментация – это явление, при котором происходит оседание частиц под действием силы тяжести.
Способность дисперсной системы сохранять равномерное распределение частиц по всему объему принято называть седиментационной, или кинетической устойчивостью системы.
Дисперсные системы по кинетическим свойствам делятся:


Устойчивые (размер частиц неустойчивые (размер частиц граничит
граничит с истинными растворами) с грубодисперсными системами)
Оптические свойства коллоидных систем
Коллоидные растворы по внешнему виду часто невозможно отличить от истинных. Различие в оптических свойствах дает возможность легко установить наличие коллоидно - растворенного вещества. Все дисперсные системы способны рассеивать свет. В истинных же растворах рассеяние света не наблюдается.
а) опалесценция






конус Тиндаля
ист. Света
б) окраска.
На окраску коллоидных систем влияют не только природа дисперсной фазы, но и дисперсность частиц, их форма и строение, так как эти факторы влияют на рассеяние и адсорбцию света.
Электрические свойства коллоидных растворова) электрофорез; б) электроосмос.
В 1909 г. проф. Московского университета Ф.Ф. Рейсс наблюдал воздействие постоянного электрического тока на диспергированную в воде глину и на этом основании описал электрические свойства коллоидных растворов. Частицы дисперсной фазы (глины) перемещались к аноду, где вследствие их большого скопления наблюдалось помутнение раствора. Частицы же дисперсионной среды (воды) перемещались к катоду, где наблюдалось повышение уровня прозрачной жидкости. Направленное движение частиц к электродам говорила об их заряде, причем стало ясным, что дисперсная фаза несет на себе заряд, противоположный по знаку заряду среды. Движение частиц дисперсной фазы к одному из электродов при пропускании через золь постоянного электрического тока получило название электрофореза, движение частиц дисперсионной среды – электроосмоса.
Итак, электрофорез и электроосмос обусловлены наличием разноименного заряда у частиц дисперсной фазы и дисперсионной среды. На границе раздела фаз возникает двойной электрический слой, состоящий из тонкой (адсорбционной) части и протяженной диффузной части. Между фазами возникает разность потенциалов, называемая элетротермодинамическим потенциалом φ. Часть скачка потенциала, обусловленная диффузным слоем, называется электрокинетическим или ς (дзета) – потенциалом. Элетрокинетический потенциал определяется толщиной и зарядом диффузного слоя, которые зависят от концентрации и заряда противоионов и температуры. Его значение можно регулировать, например, введением противоионов с высоким значением зарядов.
Реологические свойства дисперсных систем
а) вязкость; б) пластичность; в) упругость.
Механические свойства системы зависят от ее внутренней структуры и поэтому называются структурно-механическими или реологическими. Реология – раздел механики, изучающий деформации и течение любой материальной системы.
Внутренняя структура, а, следовательно, и механические свойства коллоидных и дисперсных систем определяются взаимодействием частиц дисперсной фазы с молекулами дисперсионной среды и между собой. Изучению внутренней структуры и строения материалов посвящен раздел коллоидной химии, названный физико-химической механикой. Физико- химическая механика дисперсных систем изучает их реологические свойства в связи с внутренним строением и решает вопросы управления ими с целью получения новых материалов. Значение этого раздела коллоидной химии очень велико и с практической, и с теоретической точки зрения. Такие системы, как цементные растворы, растворы полимеров, глинистые суспензии, лаки, краски, пасты, бумажная масса, почвы, биологические системы, обладают определенной структурой и потому характеризуются особыми структурно-механическими свойствами.
Деление веществ по агрегатному состоянию на жидкие и твердые в реологии связано с их реакцией на внешнюю силу, т.е. способностью деформироваться под действием внешних сил. Для жидкостей свойственна текучесть или способность к вязкому течению. При вязком течении деформация наступает при ничтожном усилии; она необратима (не исчезает при снятии нагрузки) и зависит от длительности воздействия. Тела, способные к деформации при ничтожно малой нагрузке, называются вязкими.
Твердому телу свойственны обратимые деформации, полностью исчезающие при снятии внешнего напряжения. Различают два основных вида деформации: растяжение (сжатие) и сдвиг.
Реологические свойства дисперсных систем в значительной степени зависят от агрегатного состояния и свойств дисперсионной среды. Однако наличие дисперсной фазы может существенно изменять эти свойства под влиянием сил сцепления между частицами дисперсной фазы и их взаимодействия с дисперсионной средой. По интенсивности указанных взаимодействий среди дисперсных систем могут быть выделены две основные группы: свободнодисперсные и связнодисперсные системы.
В свободнодисперсных системах частицы дисперсной фазы не связаны между собой и способны независимо перемещаться в дисперсионной среде. Такие бесструктурные системы проявляют способность к вязкому течению и качественно ведут себя как чистая дисперсионная среда (жидкость или газ). Сюда относятся разбавленные эмульсии и суспензии коллоидные растворы (золи). В связнодисперсных системах частицы дисперсной фазы образуют непрерывные пространственные сетки (структуры); они теряют способность к поступательному движению, сохраняя лишь способность к колебательному движению. К ним относятся гели, студни, концентрированные суспензии (пасты) и эмульсии, а также пены и порошки. Такие системы проявляют некоторые свойства твердых тел – способны сохранять форму при небольших нагрузках, обладают прочностью, часто упруги. Однако вследствие малой прочности связей между отдельными элементами сетки такие системы легко разрушаются – обратимо (приобретая способность течь) и необратимо (проявляя хрупкость). Существует также ряд переходных систем, получивших название «структурированные жидкости». В структурированных жидкостях частицы дисперсной фазы склонны к сильному взаимодействию, но концентрация их недостаточна для создания единой пространственной сетки. Эти системы способны течь, имеют малый модуль упругости, но течение их не подчиняется законам течения идеальных жидкостей, а период релаксации велик и приближается к значениям, характерным для твердых тел. [8, с.381]
Наиболее подробно остановимся на оптических свойствах коллоидных систем.
Тема № 5 Оптические свойства коллоидных систем
(лабораторная работа)
Наблюдение светорассеяния
ОБОРУДОВАНИЕ: Фотоэлектроколориметр(ФЭК) ,кюветы, электрическая лампа
РЕАКТИВЫ: бульоны, дистиллированная вода
1) В две кюветы с плоскопараллельными стенками одинакового объема налить воду и бульон соответственно и поставить их на одинаковом расстоянии от листа бумаги (экрана), сзади поместить электрическую лампу (перпендикулярно) и наблюдать явление опалесценции. В первом случае (в кювете вода) конус Тиндаля не наблюдается, а во втором – в результате рассеивания света частицами бульона наблюдается конус Тиндаля
2) Работа проводится по инструкции, прилагаемой к ФЭКу.
Тема № 6 Пищевые продукты (на примере мяса).
Коллоидные системы имеют огромное значение в практической жизни человека. Продукты питания, сырье, полуфабрикаты относятся к этим системам – творог, сыры, хлеб, мука, какао-порошок, сухое молоко, сливочное масло, соки, шампанское, бульоны и т.п.
Наиболее подробно мы изучим бульоны, которые приготовлены из разных видов мяса.
Более 9/10 всего мясного сырья представляют три вида: говядина, свинина, баранина. Мясо других видов животных (курятина, буйволятина, конина, верблюжатина, оленина и др.) специфично для отдельных регионов страны.
Состав и качество мясного сырья зависят от многих факторов, в том числе от породы, возраста, пола, условий кормления и т. д.
Однако состав мясного сырья может сильно изменяться в зависимости от разделки – различаются для говядины, свинины, баранины.
Мясные продукты являются основным источником животного белка, жира, витаминов группы В1, В2, РР и особенно В12. Вместе с тем в мясе довольно мало содержится витаминов С и А.
Мясо содержит также значительное количество легкоусвояемых форм важнейших минеральных веществ. Из таблицы видно, что в нем содержится много фосфора, железа, цинка – важнейших биоэлементов. При этом важно подчеркнуть, что эти элементы в отличие от растительных продуктов находятся в легкоусвояемой форме, например, железо усваивается из мясных продуктов в три раза лучше, чем из растительных.
Роль химических элементов в составе мясных продуктов для организма человека
В состав мяса входит не так много химических элементов таблицы Менделеева. Например, одним из значительных источников Cr для человека является говядина, свинина, куриные ножки. Также Cr необходим больным диабетом, т.к. он «сотрудничает» с инсулином. А Cu содержится в печени и почках крупнорогатого скота; он предупреждает появление злокачественной опухоли. Еще в почках крупнорогатого скота находится Se. Чем меньше содержание Se в крови, тем выше вероятность заболевания раком. У Se есть способность вынуждать организм вырабатывать антитела, значит, иммунитет в случае угрозы инфекции.
Наиболее распространенным металлом в говяжьем мясе является Zn. Он необходим для формирования костей, витамин А не действует без Zn, он проявляет антоксичное действие на клетки, влияет на умственное развитие.
Тема № 7 Определение свежести мяса
(лабораторная работа)
Объектом исследования работы являются коллоидные растворы куриного, говяжьего и свиного бульонов, сваренных в дистиллированной и водопроводной воде. Чтобы проверить устойчивость коллоидных систем на влияние окружающей среды провела ряд опытов: на качество полуфабрикатов, из которых приготовлен бульон.
Методика эксперимента
1) реакция с сульфатом меди (II)
При определении запаха и вкуса исследуют не только мясо, но и приготовленный из него бульон. Проведение реакций на определение свежести мяса через бульон.ОБОРУДОВАНИЕ: мясорубка, водяная баня, штатив, коническая колба на 150-200 мл, химический стакан, градуированная пипетка, пробирка, часовое стекло и воронка с ватой.
РЕАКТИВЫ: 50 %-ный водный раствор сульфата меди.
ТЕХНИКА ОПРЕДЕЛЕНИЯ: для получения однородной средней пробы образцы мяса трижды пропускают через мясорубки с диаметром равным 2 мм (отверстий решетки). Фарш тщательно перемешивают, 20 г фарша помещают в коническую колбу, заливают 60 мл дистиллированной воды и тщательно перемешивают. Содержимое колбы закрывают часовым стеклом и ставят на кипящую водяную баню на 10 минут. Полученный говяжий бульон фильтруют через плотный слой ваты не менее 0,5 см, пробирку помещают в стакан с холодной водой. Если после фильтрации в бульоне остаются хлопья белка, то его дополнительно фильтруют через фильтровальную бумагу. В пробирку наливают 2 мл бульона и добавляют 3 капли 5 % водного раствора сульфата меди (II), встряхивают и ставят в штатив, через 5 минут отмечают результаты реакции.
Если бульон прозрачный или в нем образуется небольшая муть – полуфабрикаты свежие; появление в бульоне хлопьев свидетельствует о начальных признаках порчи полуфабриката. Если в бульоне выпадает желеобразный осадок сине-голубого или зеленоватого цвета, полуфабрикаты несвежие.
2) определение сероводорода.
РЕАКТИВЫ: раствор нитрата свинца (II) (4%-ного), гидроксид калия, кусочек мяса.
ТЕХНИКА ОПРЕДЕЛЕНИЯ: в раствор нитрата свинца (II) (4%-ного) приливают 30%-ный раствор гидроксида калия до растворения образующегося белого осадка. В небольшой химический стакан кладут кусочек испытуемого мяса. Стакан покрывают фильтровальной бумагой, которую в середине пропитывают 2-3 каплями полученного реактива. В случае присутствия сероводорода, через 110-15 минут на бумаге, где был нанесен реактив, появляется бурое пятно. Это указывает на выделение сероводорода , который образуется при гниении мяса.
3) Определение свежести мяса с помощью метиленовой синей.
РЕАКТИВЫ: метиленовый синий, кусочек мяса.
ТЕХНИКА ОПРЕДЕЛЕНИЯ: мелко изрубленное мясо кладут в пробирку и заливают дистиллированной водой. Пробирку закрывают пробкой, сильно встряхивают и оставляют на полчаса при комнатной температуре. Затем приливают в пробирку 0,5 мл 0,5%-ного раствора красителя метиленового синего и нагревают в стакане с горячей водой до 40-50°С. если мясо свежее, то оно не обесцвечивает метиленовую синюю в течение часа. Если же краситель обесцвечивается полностью или наполовину, то мясо не считается свежим. [4, 132]
Тема № 8 Определение кальция в мясе(лабораторная работа)
Приборы: аналитические, технические весы, муфельная печь, электрическая плитка, эксикатор, водяная баня, бюретка, пипетки, мерная, коническая колба, тигель, воронка, шпатель.
Реактивы: раствор комплексона III (0,010000 моль/л, раствор NaOH (2,0моль/л, раствор HCI(25,0%), мурексид, индикаторная бумага «конго».
Пробоподготовка. Массу навески анализируемого мясного продукта – мясо (3-5)г помещают в тигель, предварительно обуглив ее на электрической плитке, затем тигель помещают в муфельную печь. Содержимое тигля сжигают при 450-500˚С до постоянной массы, которую контролируют взвешиванием на аналитических весах. Перед взвешиванием тигель охлаждают в эксикаторе 20 мин. После сжигания тигель с золой помещают на кипящую водяную баню и для растворения золы добавляют 5 мл раствора НСI. Полученный раствор фильтруют через обеззоленный фильтр в мерную колбу. Тигель и фильтр 2-3 раза промывают дистиллированной водой, промывные воды собирают в мерную колбу. Раствор доводят до метки дистиллированной водой.
Анализ фильтрата. Бюретку заполняют титрованным раствором комплексона III.
Пипеткой отбирают 5,00 мл фильтрата и помещают в коническую колбу. Раствор нейтрализуют по индикаторной бумаге «конго», прибавляя по каплям раствор NaOH до розового окрашивания бумаги. Затем в коническую колбу вносят на кончике шпателя индикатор мурексид, приливают 2,00 мл раствора NaOH и титруют окрашенный в розовый цвет раствор титрованным раствором комплексона III до перехода окраски в фиолетовую.
Расчет. Масовую долю кальция (ŵ, %) рассчитывают по формуле:
Ŵ = c(1/1 H2Y2-)x V(H2Y2-)x M(1/1Ca2+)x Vk x100/ m x Vn,
где c(1/1 H2Y2-) – концентрация титранта, моль/л; V(H2Y2-) – объем титранта, затраченный на анализ, мл; Vk – вместимость мерной колбы, мл; m – масса навески продукта, г; Vn – объем пробы фильтрата, взятый для анализа, мл; M(1/1Ca2+) – масса эквивалента кальция, г/моль.
Тема № 9 Определение кислотно-щелочной среды бульона
(лабораторная работа)
Методика эксперимента
1) Определение рН бульона с помощью универсального индикатора
ОБОРУДОВАНИЕ: бюкс.
РЕАКТИВЫ: универсальный индикатор, бульоны.
ТЕХНИКА ОПРЕДЕЛЕНИЯ: отфильтровать бульоны, затем в бюксы налить бульоны и опустить 3 полоски универсального индикатора. Через некоторое время вынуть индикаторы и отметить результаты по шкале кислотности. Если рн 7, то среда в бульоне щелочная, рН = 7 – нейтральная, рН
2) определение рН бульона рН-метром
ОБОРУДОВАНИЕ: рН-метр, химические стаканы на 50 мл.
РЕАКТИВЫ: буферные растворы, бульоны.
ТЕХНИКА ОПРЕДЕЛЕНИЯ: работа проводится по интсрукции, прилагаемой к рН-метру.
Тема №10 Коагуляция коллоидных растворов
Коллоидные системы обладают высокоразвитой поверхностью раздела на границе дисперсная фаза – жидкость. Это приводит к избытку свободной пограничной (межфазной) энергии. Поэтому в коллоидных системах постоянна тенденция к самопроизвольному уменьшению межфазной энергии. В связи с этим, когда при измерении какого-либо из условий мицеллы золя приходят между собой в соприкосновение, они соединяются друг с другом и образуют более крупные частицы. Этот процесс укрупнения носит название коагуляции
Изменения состояния коллоидных систем, связанные с уменьшением степени дисперсности твердой фазы, проходят две стадии: 1) укрупнение частиц и 2) выделение твердой фазы. Степень коагуляции может быть различной, и процесс коагуляции коллоида на той или другой стадии является легкообратимым процессом. При этом не обязательно, чтобы при агрегации частиц с самого начала можно было наблюдать какие-либо внешние изменения в золе (изменение цвета, помутнение, выпадение осадка и т.д.). Этот период называется периодом скрытой коагуляции в отличие от периода явной коагуляции, когда процесс агрегации приводит к таким изменениям системы, которые могут быть обнаружены визуально. Коагуляцию можно вызвать действием на коллоидную систему агентов, различных по своей природе, например: длительным диализом, добавлением электролитов, добавлением неэлектролитов, механическим воздействием (размешиванием или встряхиванием), сильным охлаждением или нагреванием, пропусканием электрического тока, действием лучистой энергии. Иногда коагуляция происходит в результате химических изменений, протекающих в золе. Во всех случаях причиной коагуляции является уменьшение связи частиц с окружающей их дисперсионной средой. Поскольку главным условием устойчивости коллоидных растворов является их электрический заряд, постольку и основным методом их коагулирования будут различные приемы снятия их зарядов. Чаще всего для этой цели пользуются воздействием на коллоидный раствор электролитов. Многочисленные исследования явления коагуляции показали, что почти все электролиты, взятые в достаточном количестве, способны коагулировать коллоидные растворы.
Прибавление к коллоидному раствору электролита влечет за собой увеличение концентрации противоионов во всех слоях.
Связь мицелл с окружающей их дисперсионной средой при этом уменьшается и наступает коагуляция. Явная коагуляция наступает, когда концентрация электролита начинает превышать некоторую минимальную величину. Наименьшая концентрация электролита, вызывающая коагуляцию за определенный промежуток времени и выраженная в миллимолях на 1 л (ммоль/л), называется порогом коагуляции золя данным электролитом.
Коагулирующей частью электролита является один из его ионов – тот, который несет заряд, противоположный по знаку заряду коллоидной частицы. Например, для коагуляции гидроксида железа (III), частицы которого несут положительный заряд, коагулирующим ионом электролита является его анион. Величина заряда коагулирующего иона обусловливает порог коагуляции данного коллоида. При этом величина порога коагуляции тем меньше, чем выше заряд коагулирующего иона. Следовательно, коагулирующее действие электролита возрастает с увеличением заряда иона, знак которого противоположен знаку заряда коллоидной частицы.
 Коагуляция
Коагуляция
под действием физических факторов под действием химических факторов
а) спонтанная; а) под действием б) в результате механического воздействия; электролита
в) под действием температур б) взаимная коагуляция
Тема № 11 Коагуляция. Определение пороговой концентрации
(лабораторная работа)
Визуальный метод определения порога коагуляции.
При визуальном методе исследования порог коагуляции определяют по помутнению золя за данный промежуток времени при сопоставлении контрольной и исследуемой пробирок. В соответствующих таблицах отмечают наличие коагуляции знаком «+», отсутствие коагуляции знаком «-»
ОБОРУДОВАНИЕ: пробирки, мерные пипетки.
РЕАКТИВЫ: Ag+, Ca+, Mg2+, Zn2+, Fe2+, Fe3+, Cd2+, Pb2+, Co2+, Cr3+, бульоны.
ТЕХНИКА ОПРЕДЕЛЕНИЯ: отфильтровать бульоны. В пробирки с бульоном, сваренных на дистиллированной водопроводной воде, добавить 1 мл раствора катиона. Эту операцию проводить столько раз, сколько катионов. Если при взаимодействии бульона с катионами выпадает осадок, то реакцию необходимо повторять с добавлением к 1 мл бульона по каплям раствора катиона такое количество раз, пока не произойдет коагуляция. [ 6, 78-79]
Тема №12. Значение коагуляции.
Явление коагуляции используется в пищевой, фармацевтической промышленности, в кондитерском производстве, в мыловарении, хлебопечении, в процессах брожения и др. Образование почвенных коллоидов происходит на основе взаимной коагуляции различных органо-минеральных соединений.
Процессы коагуляции и защиты имеют большое значение для жизнедеятельности организмов, так как коллоидные системы клеток и биологических жидкостей подвержены коагуляции и воздействию электролитов. Согласно правилу Шульца-Гарди в организме необходимо поддерживать не только постоянство концентрации электролитов, но и их качественный состав. Про приготовлении физиологических растворов необходимо учитывать заряд ионов. Так, раствор, приготовленный не из NaCI, а из MgCI2, будет обладать более сильным коагулирующим действием.
Явление антагонизма и синергизма электролитов отражается на биологических объектах. Так, известно, что рост пшеницы подавляется 0,12М растворами NaCI и CaCI2, но при определенном соотношении этих электролитов их действие будет обратное.
Защитное действие широко распространено в природе. В почвах, например, содержатся высокомолекулярное органические соединения (гумус), которые оказывают защитное действие по отношению к почвенным коллоидам. Это приводит к тому, что защищенные гумусом коллоидные системы в почве не коагулируют и могут вымываться из почвы, что обедняет ее полезными элементами.
Причиной образования камней в почках и печени может быть недостаток в организме защитных веществ. Многие гидрофобные коллоидные частицы в крови и биологических жидкостях защищены белками от коагуляции. Так, белки крови защищают капельки жира, холестерина и другие гидрофобные вещества. Снижение степени защиты приводит к коагуляции, например, к отложению холестерина и кальция в стенках кровеносных сосудов. Измерение золотого числа спинно-мозговой жидкости служит для определения некоторых заболеваний.
В медицине для искусственного получения солей различных веществ пользуются явлением защиты. Коллоидные препараты серебра – колларгол, протаргол – это коллоидные растворы, защищенные белковыми веществами. [5, c. 188]
Также коллоидная химия играет большую роль в разработке эффективных методов охраны окружающей среды.
Одна из главных проблем в этой области – очистка воды от различных загрязнений. Характерный пример – загрязнение водоемов и рек белковыми веществами, содержащими в сточных водах предприятий пищевой промышленности. Особенно эффективная очистка достигается с помощью пен, обладающих определенными коллоидно-химическими характеристиками (устойчивость, размер газовых пузырьков и т.д.). Другой пример – загрязнение поверхности воды нефтью при авариях танкеров. Нефтяное пятно может распространяться на очень большие расстояния от места аварии. Законы коллоидной химии и поверхностных явлений позволяют рекомендовать возможные приемы блокирования растекания нефти и ее сбора. [ 8, с.11]
Тема № 13. Грубодисперсные системы.
К грубодисперсным системам относят дисперсные системы, размеры частиц дисперсной фазы которых несколько превышают размеры коллоидных частиц (1х10-5м) и которые можно увидеть в обычном микроскопе, без дополнительного мощного бокового освещения.
Типичные грубодисперсные системы подразделяются на такие группы: дымы, пены, порошки, туманы, суспензии и эмульсии. Следует отметить, что дымы и туманы – это пограничные дисперсные системы, поскольку в них содержатся и частицы дисперсной фазы коллоидных размеров.
Все грубодисперсные системы седиментационно неустойчивы; они не принимают участия в броуновском движении, а передвигаются лишь под действием силы тяжести.
Грубодисперсные системы широко распространены. Например, молоко, животное масло, майонез, сметана, яичные желток, нефть, млечный сок растений – каучуконосов, охлаждающие эмульсии, которые используются при холодной обработке металлов.
В последнее время широкое распространение в технике и хозяйственной деятельности получили специально разработанные высококонцентрированные суспензии (пасты). Их получают либо осаждением более разбавленных поверхностно-активных суспензий, либо механическим растиранием порошков ПАВ с малыми количествами жидкостей. При этом, для предотвращения структурирования и образования твердых осадков (монолитов) в пасты также добавляют гидрофильные полимеры, например, полиакриламид и его сополимеры.
Сильно развитая поверхность и особые свойства порошков обуславливают их широкое применение в строительстве (гипс, цемент, известь, мел, сухие минеральные красители и т.п.), в сельском хозяйстве (минеральные и микроудобрения, инсекто-фунгидцидные дусты), в пищевой промышленности (крахмал, мука, сахарная пудра), в энергетике (пылевидное топливо), в медицине (порошкообразное лекарство, присыпки) и т.д.
Таким образом, грубодисперсные системы имеют огромное значение в технике, хозяйственной деятельности, строительстве, пищевой промышленности и т.д.
Тема № 14. Высокомолекулярные соединения.


ВМС:
природные синтетически
(крахмал, белок, каучук, шелк и т.д) (синтетические каучуки,
резины, искусственные волокна)
Свойства ВМС:
осмотическое давление;
диффузия;
седиментация;
вязкость.
Растворение ВМС – это процесс молекулярного диспергирования, который ведет к образованию истинных растворов.
В растворах ВМС отсутствует основной признак коллоидных систем – это гетерогенность, т.е. при растворении ВМС нет раздела фаз. Несмотря на то, что ВМС имеют большую массу растворы их гомогенны и однофазны.
3. Растворение ВМС состоит из двух стадий:
а) набухание (поглощение полимером значительного количества растворителя).
б) собственно растворения.
Заключительный семинар
На заключительном семинаре учащиеся выступают со своими рефератами, докладами, газетами.
Примерный перечень тем рефератов на выбор учащихся: «Интересные факты из истории коллоидной химии», «Значение коллоидных систем в практической жизни человека», «Эмульсии и их применение», «Биологическое значение коагуляции», «Суспензии» и т.д. Учащиеся могут предложить также свои темы рефератов.
Оформление газет делают по группам.
Приложение №4
Таблица №2
Наблюдения за кислотно-щелочной средой бульона
| Бульон | Куриный | Свиной | Говяжий | |||||||
| Вода | Дист. | Водопр. | Очищ. | Дист. | Водопр. | Очищ. | Дист. | Водопр. | Очищ. | |
| рН | 7,5 | 6,4 | 7,4 | 7,2 | 6,85 | 6,65 | 7 | 7 | 7,1 | |
Приложение № 5
Таблица №6
Определение пороговой концентрации в бульонах
| № | Бульон | Вода | С пор (Ag+), ммоль/л | С пор (Pb2+), ммоль/л |
| 1 | куриный | дистиллированная | 1,40 | 0,21 |
| 2 | куриный | Водопроводная | 3,50 | 0,28 |
| 3. | куриный | очищенная | 4,90 | 0,49 |
| 4. | свиной | дистиллированная | 6,30 | 0,70 |
| 5. | свиной | Водопроводная | 9,10 | 1,50 |
| 6. | свиной | очищенная | 5,60 | 0,56 |
| 7. | говяжий | дистиллированная | 4,20 | 0,56 |
| 8. | говяжий | Водопроводная | 3,90 | 0,42 |
| 9. | говяжий | очищенная | 4,90 | 0,63 |
Аршанский Е.Я. Подготовка будущего учителя химии к работе в классах педагогического профиля // Химия. Методика преподавания. – 2005. - №1. – С.23-26.
Балезин С.А., Ерофеев Б.В., Подобаев Н.И. Основы физической и коллоидной химии. - М.: Просвещение, 1975. - С. 338-340, (397с.).
Выбор методов обучения в средней школе./Под ред. Ю.К. Бабанского. М., 1981. – 47- 54, (с. 237)
Гроссе Э., Вайсмантель Х. Химия для любознательных. - Л.: «Химия», 1985. - С.69-70, (230с.).
Дидактика средней школы./Под ред. М.Н. Скаткина. 2-е изд. М., 1982. – С. 14, 57 68-84, (с.368).
Дулицкая Р.А., Фельдман Р.И. Практикум по физической и коллоидной химии. - М.: Высшая школа, 1978. - С.264, (295с.).
Ермаков Д.С., Муравлянская Ю.Д., Рыбкина Т.И. Элективные курсы по химии для профильного обучения // Химия. Методика преподавания. – 2005. - №5. С.61-66.
Заплишный В.Н. Физическая и коллоидная химия: учебник для сельскохозяйственных вузов/Министерство сельского хозяйства РФ. – Краснодар: ГУП «Печатный двор Кубани», 2001. – С. 287, 293-295, (344с.)
Коллоидная химия и научно-технический прогресс / И.В. Петрянов-Соколов. – М.: Наука, 1998. – С. 116-118, (180с.).
Коровин Н.В. Общая химия. – М.:Высш. шк., 1978. - С.249-250, (557с.).
Кузнецов В.В., Усть-Качкинцев В.Ф. Физическая и коллоидная химия. – М.: Высшая школа, 1976. - С. 215-223.
Кукушкин Ю.Н. Химия вокруг нас. - М.: «Высшая школа», 1992. - С.68, (191с.).
Куписевич Ч. Основы общей дидактики. М., 1986.- С. 117-128 (с.341).
Лабораторные работы и задачи по коллоидной химии. – Под ред. Ю.Г. Фролова, А.Г. Гродского. – М.: «Химия», 1986. – С.159-162, (216с.)
Лернер И.Я. Дидактические основы методов обучения. М., 1981.- С. 43-56 (259).
Макаров К. А. Химия и медицина. - М.: Просвещение, 1981. - С.25-26, (147с.).
Нифантьев Э.Е., Парамонова Н.Г. Основы прикладной химии: Учебное пособие для студ. пед. вузов – М.: Гуманит. изд. центр ВЛАДОС, 2002. – С. 111-120, 132, (144с.).
Ротмистрова Г.Б., Никольский И.В., Климов И.И. Пособие к курсу физической и коллоидной химии. – М.: Просвещение, 1975. - С. 160-163, 187-188, (230с.).
Русецкая О.П. Элективный курс «Мы в мире химии», Химия в школе. – 2005.- С.37
Рыбакова Ю.С. Лабораторные работы по физической и коллоидной химии: Учебное пособие для техникумов торговли и обществ. Питания. – М.: Высшая школа, 1989. – С. 66-70, 78-80, ( 111с.).
Сборник программ элективных курсов по химии для учащихся 9-х классов. – Уфа: НИМЦ при ГУНО, 2005. – 40с.
Скурихин И. М. Все о пище с точки зрения химика. - М.: «Высшая школа», 1991. - С.163-166, 264-265, (287с.).
Сумм Б.Д. Коллоидная химия: вчера, сегодня, завтра // Химия в школе. – 2003. - №3. С. 6-12.
Физическая и коллоидная химия: Учеб. пособие для студентов хим. и биол. спец. пед. ин-тов / Д.П. Добычин, Л.И. Каданер, В.В. Серпинский и др. – М.: Просвещение, 1986. – С. 380-382, (463с.).
Харлампович Г.Д., Семенов А.С., Попов В.А. Многоликая химия. – М.: Просвещение, 1992. - С.11-13, (157с.).
Шимилт Л. Химия и обеспечение человека пищей. - М.: Мир, 1986. - С.115-116, (168с.).
Щукин Е.Д., Перцов А.В., Амелина Е.А. Коллоидная химия. – М.: Высшая школа, 1992.
Элективные курсы в профильном обучении: Образовательная область «Естествознание» /Министерство образования РФ - Национальный фонд подготовки кадров. – М.: Вита-Пресс, 2004. 96с. http: // www.ntf.ru/rus/index/htm
Эмануэль Н.М., Занков Г.Е. Химия и пища. – М.: «Наука», 1986. - С.145-147, (158с.).
Яковлев А.Г. Практикум по физической и коллоидной химии. М.: Высшая школа, 1967. - С.101, (127с.).
Результаты эксперимента учащихся
В таблице приведены результаты эксперимента учащихся по коагуляции бульонов
Сводная таблица по результатам эксперимента учащихся
| Ф.И.уч-ся, | С пор (Ag+), ммоль/л | С пор (Pb2+), ммоль/л |
| Байбикова С., гов. бульон в очищ. воде | 4,20 | 0,54 |
| Богданова А. гов. бульон в водопр. воде | 3,77 | 0,32 |
| Зайнуллина А. гов. бульон в водопр. воде | 3,25 | 0,18 |
| Исаева К. гов. бульон в очищ. воде | 4,11 | 0,48 |
| Сорокина Е. гов. бульон в водопр. воде | 3,90 | 0,24 |
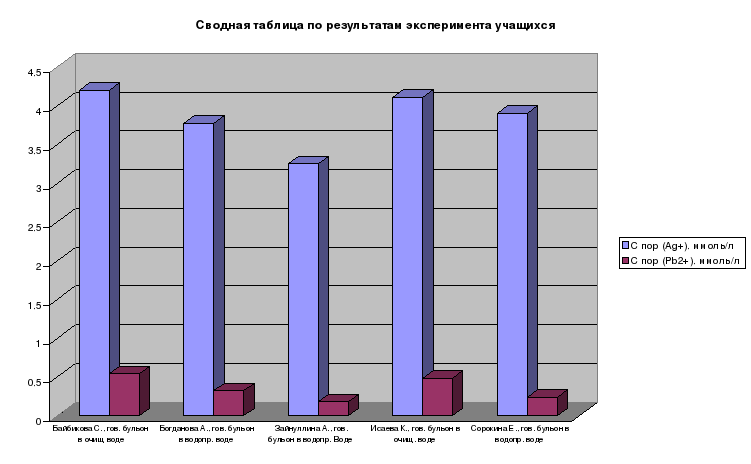 По результатам эксперимента учащихся выяснено, что коагуляцию бульонов вызывали только катионы серебра и свинца. Самый высокий порог коагуляции наблюдался у говядины, сваренной в очищенной воде, а самый низкий у говядины, сваренной в водопроводной воде.
По результатам эксперимента учащихся выяснено, что коагуляцию бульонов вызывали только катионы серебра и свинца. Самый высокий порог коагуляции наблюдался у говядины, сваренной в очищенной воде, а самый низкий у говядины, сваренной в водопроводной воде.
ВЫВОДЫ
1. Изучена литература по профильному обучению, в частности элективные курсы и обнаружено, что они играют важную роль при обучении химии, но материала по этой теме недостаточно для учителя.
2. Проанализировано 14 источников литературы по строению, свойствам, значению коллоидных систем и выяснено, что материала по данной теме достаточно, но она не систематизирована для учителя химии.
3. Проведен эксперимент на определение качества и свежести бульонов, что доказывает не зависимость качества и свежести мяса от кислотно-щелочной среды бульона, которые были приготовлены в водопроводной, очищенной, дистиллированной воде, а зависит от качества мяса.
4. Экспериментально доказано, что бульоны – коллоидные растворы по свету рассеивания (эффект Фарадея-Тиндаля).
5. Определена величина рН исследуемых бульонов. Самый высокий уровень рН равный 7,5 у бульона, сваренного из мяса курицы в дистиллированной воде, а самый низкий уровень рН =6,4 – у курицы, сваренной в водопроводной воде. Таким образом, куриный бульон оказался наиболее чувствительным к воздействиям кислотно-щелочной среде бульона.
6. Исследовано влияние некоторых металлов на коллоидные системы бульонов, из которых следует, что только тяжелые металлы (серебро, свинец) оказывают влияние на коагуляцию.
7. Разработан элективный курс по теме «Коллоидная химия в условиях профилизации средней школы» и апробирован во время педагогической практики в лицее № 96 г. Уфы.

 Получите свидетельство
Получите свидетельство Вход
Вход











 Роль элективных курсов по химии (103.15 KB)
Роль элективных курсов по химии (103.15 KB)
 0
0 1456
1456 9
9 Нравится
0
Нравится
0





