Рабочая программа
по химии с региональным компонентом для 9-го класса
(на основе авторской программы О.С.Габриелян )
(2 часа в неделю, 68 часов)
Пояснительная записка
Курс химии 9 класса рассчитан на 68 часов (2 часа в неделю).
Рабочая программа составлена на основе:
Закона Российской Федерации «Об образовании» №273-ФЗ от 21 декабря 2012 года;
Федерального базисного учебного плана для образовательных учреждений Российской Федерации, утверждённый приказом МО РФ от 09.03.2004 № 1312 «Об утверждении федерального базисного учебного плана и примерных учебных планов для образовательных учреждений РФ, реализующих программы общего образования» с изменениями и дополнениями;
Приказа МОиН РФ от 21 марта 2014 года № 253 «Об утверждении федеральных перечней учебников, рекомендованных (допущенных) к использованию в образовательном процессе в образовательных учреждениях, реализующих образовательные программы общего образования и имеющих государственную аккредитацию, на 2014-2015 учебный год»;
Постановления Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека и Главного государственного санитарного врача РФ от 29.12.2010 № 189 «Об утверждении СанПин 2.4.2.2821-10 «Санитарно-эпидемиологические требования к условиям и организации обучения в общеобразовательных учреждениях».
Федеральный государственный образовательный стандарт основного общего образования (6-9 кл.) 17 декабря 2010 года.
Авторской программы для общеобразовательных школ по химии 9 класс. О.С.Габриелян Программы для общеобразовательных учреждений. Химия 8-11 класс- М, Дрофа, 2013 г
Федеральный базисный учебный план для образовательных учреждений Российской Федерации отводит 35 часов для обязательного изучения биологии в 9 классе ( 2 часа в неделю)
Количество учебных недель- 35 ч
Количество плановых контрольных работ-
Количество лабораторных работ-
Изучение химии на ступени основного общего образования направлено на достижение следующих целей:
применение полученных знаний и умений для безопасного использования веществ и материалов в быту, сельском хозяйстве и на производстве, решения практических задач в повседневной жизни, предупреждения явлений, наносящих вред здоровью человека и окружающей среде.
В содержании курса 9 класса в начале обобщённо раскрыты сведения о свойствах классов веществ - металлов и неметаллов, а затем подробно освещены свойства щелочных и щелочноземельных металлов и галогенов. Наряду с этим в курсе раскрываются также и свойства отдельных важных в народнохозяйственном отношении веществ. Заканчивается курс знакомством с органическими соединениями, в основе отбора которых лежит идея генетического развития органических веществ от углеводородов до биополимеров (белков и углеводов).
Химия как и другие естественные науки, не только изучает природу, но и обеспечивает человека знаниями для практической деятельности, развития материального производства. С этой точки зрения привлечение местного краеведческого материала на уроках химии для объяснения химических процессов, получения и применения веществ лежат в основе ряда отраслей народного хозяйства нашей республики, а продукты химической промышленности используются во всех отраслях производства, в медицине и повседневной жизни.
Национально – региональный компонент в обучении дает возможность учителю химии знакомить учащихся с местными предприятиями, деятельность которых связана с процессом, с вопросами загрязнения и конкретных мер по защите окружающей среды своего региона, района, села, дает возможность развивать познавательный интерес к химии.
Основное содержание учебного предмета химии определяется федеральной программой средней общеобразовательной школы и государственным общеобразовательным стандартом. Региональный компонент вводится в содержание предмета при изучении применения, свойств и получения веществ, решении задач.
Количество часов, выделяемых на национально – региональный компонент, занимает 20 %
| № урока | Тема урока | Тема национально-регионального компонента |
| 7 | Физичекие свойства металлов | Физические свойства металлов их значение в развитии республики Бурятия. |
| 9 | Получение металлов | Термическая обработка и закалка металлов на предприятиях. Цеха бывшего металлообрабатывающего предприятия г Петровск-Забайкальска. |
| 10 | Коррозия металлов и методы борьбы с ней | . Коррозия металлов и методы борьбы с ней. (примеры на местном материале) |
| 11 | Сплавы и их значение | . Сплавы, применяемые для изготовления сельскохозяйственных машин. Оборудования. |
| 14 | Щелочноземельные металлы | . Содержание магния и кальция в организме человека. Участие ионов кальция в процессе свертывания крови. |
| 27 | Общая характеристика неметаллов | Состав воздуха региона. Основные техногенные загрязнители атмосферы региона (оксиды углерода, серы, азота). Способы очистки газообразных выбросов на предприятиях региона. |
| 32 | Общая характеристика халькогенов. Кислород | Образование озона в природе родного края, значение озона для сохранения жизни на Земле. Озон – сильнейший окислитель и токсикант. ПДК озона в атмосферном воздухе. Применение озона для обеззараживания воды и дезинфекции воздуха в помещениях. |
| 34 | Соединения серы. Серная кислота | Кислоты в природе. Кислотные дожди, их происхождение. Примеры применения кислот в быту, промышленности. Сероводород в природе. Курорт Горячинск. ПДК сероводорода в атмосфере и сточных водах республики. |
| 35 | Соли серной кислоты | Соли в природе. Соли в составе минеральной воды. Примеры применения солей в быту и на промышленных предриятиях области. Месторождения минеральных и горных пород в регионе. |
| 41 | Соли азотной кислоты | Понятие о нитратном отравлении организма человека |
| 45 | Кислородные соединения углерода | Оксиды углерода как загрязняющие вещества, их ПДК в атмосфере. Отравляющее действие угарного газа на организм человека – образование карбоксигемоглобина. Источники загрязнения атмосферы в селе, районе, регионе. |
| 46 | Кремний как простое вещество | Роль кремния в организме растений, животных и человека. Силикатная промышленность республики Бурятия: стекло, цемент, керамика. Цементный завод – зона повышенной концентрации пыли. Силикоз. Природоохранные мероприятия, проводимые в стекольной и цементной отраслях промышленности. |
Содержание тем учебного курса (70 часов, 2 часа в неделю)
| № п/п | Название раздела | Темы раздела | Кол-во лаб работ | Кол во конт раб |
|
| Повторение основных вопросов курса 8 кл (4 час) | Характеристика элемента по его положению в периодической системе химических элементов Д. И. Менделеева. Свойства оксидов, кислот, оснований и солей в свете теории электролитической диссоциации и процессов окисления-восстановления. Генетические ряды металла и неметалла. Понятие о переходных элементах. Амфотерность. Генетический ряд переходного элемента. Периодический закон и периодическая система химических элементов Д. И. Менделеева | . 1. Получение гидроксида цинка и исследование его свойств. |
|
| Тема 1 | Металлы (22 ч) | Положение металлов в периодической системе химических элементов Д. И. Менделеева. Металлическая кристаллическая решетка и металлическая химическая связь. Общие физические свойства металлов. Сплавы, их свойства и значение. Химические свойства металлов как восстановителей. Электрохимический ряд напряжений металлов и его использование для характеристики химических свойств конкретных металлов. Способы получения металлов: пиро-, гидро- и электрометаллургия. Коррозия металлов и способы борьбы с ней. | 2. Ознакомление с образцами металлов. З. Взаимодействие металлов с растворами кислот и солей. 4. Ознакомление с образцами природных соединений: а) натрия; б) кальция; в) алюминия; г) железа. 5. Получение гидроксида алюминия и его взаимодействие с растворами кислот и щелочей. 6. Качественные реакции на ионы Fe2+ и Fе3+.
|
|
| Тема 2 | Практикум №1 Свойства металлов и их соединений (3 ч) | . Осуществление цепочки химических превращений металлов. 2. Получение и свойства со-единений металлов. З. Решение экспериментальных задач на распознавание и получение веществ. |
|
|
| Тема 3 | Неметаллы (26 ч)
| Общая характеристика неметаллов: положение в периодической системе Д. И. Менделеева, особенности строения атомов, В о д о р о д. О б щ а я х а р а к т е р и с т и к а г а л о г е н о в. С е р а. А з о т. Ф о с ф о р У г л е р о д. К р е м н и й. | 7. Качественная реакция на хлорид-ион. 8. Качественная реакция на сульфат-ион. 9. Распознавание солей аммония. 10. Получение углекислого газа и его распознавание. 11. Каче-ственная реакция на карбонат-ион. 12. Ознакомление с природными силикатами. 13. Ознакомление с продукцией силикатной промышленности. |
|
| Тема 4 | Практикум № 2 Свойства неметаллов и их соединений (3 ч) | Свойства неметаллов и их соединений | 4. Решение экспериментальных задач по теме «Подгруппа кислорода». 5.Решение эксперимен-тальных задач по теме «Подгруппы азота и углерода». 6. Получение, собирание и распознавание газов. |
|
| Тема 5
| Органические соединения (16 ч) | Вещества органические и неорганические, относительность понятия «органические вещества». Причины многообразия органических соединений. Химическое строение органических соединений. Молекулярные и структурные формулы органических веществ. | . 14. Изготовление моделей молекул углеводородов. 15. Свойства глицерина. 16. Взаимодействие глюкозы с гидроксидом меди (II) без нагревания и при нагревании. 17. Взаимодействие крахмала с иодом. |
|
Требования к уровню подготовки учащихся:
В результате изучения химии ученик должен
знать
химическую символику: знаки химических элементов, формулы химических веществ и уравнения химических реакций;
важнейшие химические понятия: атом, молекула, химическая связь, вещество и его агрегатные состояния, классификация веществ, химические реакции и их классификация, электролитическая диссоциация;
основные законы химии: сохранения массы веществ, постоянства состава, периодический закон;
уметь
• называть: знаки химических элементов, соединения изученных классов, типы химических реакций;
• объяснять: физический смысл атомного (порядкового) номера химического элемента, номеров группы и периода, к которым он принадлежит в периодической системе Д.И. Менделеева; закономерности изменения свойств элементов в пределах малых периодов и главных подгрупп; причины многообразия веществ; сущность реакций ионного обмена;
• характеризовать: химические элементы (от водорода до кальция) на основе их положения в периодической системе Д.И. Менделеева и особенностей строения их атомов; связь между составом, строением и свойствами веществ; общие свойства неорганических и органических веществ;
• определять: состав веществ по их формулам; принадлежность веществ к определенному классу соединений; валентность и степень окисления элементов в соединениях;
• составлять: формулы оксидов, водородных соединений неметаллов, гидроксидов, солей; схемы строения атомов первых двадцати элементов периодической системы; уравнения химических реакций;
• обращаться с химической посудой и лабораторным оборудованием;
• распознавать опытным путем: кислород, водород, углекислый газ, аммиак; растворы кислот и щелочей, хлорид-, сульфат-, карбонат-ионы, ионы аммония;
• вычислять: массовую долю химического элемента по формуле соединения; массовую долю растворенного вещества в растворе; количество вещества, объем или массу по количеству вещества, объему или массе реагентов или продуктов реакции;
использовать приобретенные знания и умения в практической деятельности и повседневной жизни для:
• безопасного обращения с веществами и материалами;
• экологически грамотного поведения в окружающей среде, школьной лаборатории и в быту.
Конкретные требования к уровню подготовки выпускников основной школы определены для каждой темы.
Повторение основных вопросов курса 8 класса и введение в курс 9 класса
Знать:
- периодический закон;
- важнейшие химические понятия: электролитическая диссоциация, окислитель и восстановитель, окисление и восстановление, амфотерность.
Уметь:
- объяснять физический смысл атомного (порядкового) номера химического элемента, номеров группы и периода, к которым элемент принадлежит в периодической системе Д. И. Менделеева;
- объяснять закономерности изменения свойств элементов в пределах малых периодов и главных подгрупп;
- объяснять сущность реакций ионного обмена;
- характеризовать химические свойства основных классов неорганических веществ;
- определять возможность протекания реакций ионного обмена;
- составлять уравнения химических реакций.
Подготовка к ГИА: 1.1; 1.2; 1.2.2; 1.3; 1.4; 1.6; 2.4; 2.5; 2.6; 3.2.1; 3.3.
Подготовка к ЕГЭ: 1.1; 1.5; 2.1; 2.3
Тема 1. Металлы
Знать:
- положение металлов в периодической системе Д.И.Менделеева;
- общие физические и химические свойства металлов и основные способы их получения;
- основные свойства и применение важнейших соединений щелочных и щелочноземельных металлов, алюминия;
- качественные реакции на важнейшие катионы.
Уметь:
- характеризовать общие свойства металлов на основе положения их в электрохимическом ряду напряжения металлов;
- давать определения и применять следующие понятия: сплавы, коррозия металлов, переходные элементы, амфотерность;
- вычислять массовую долю выхода продукта реакции от теоретически возможного;
- обращаться с лабораторным оборудованием;
- соблюдать правила техники безопасности;
- распознавать важнейшие катионы.
Подготовка к ГИА: 1.1; 1.3; 1.5; 1.6; 2.4; 2.5; 2.6; 3.1; 3.2; 4.1; 4.2; 4.4.
Подготовка к ЕГЭ: 1.1; 1.2; 1.3; 1.5; 2.1; 2.2; 2.3.
Тема 2. Неметаллы
Знать:
- положение неметаллов в периодической системе Д.И.Менделеева;
- устройство простейших приборов для получения и собирания газов: водорода, аммиака, кислорода, углекислого газа;
- качественные реакции на важнейшие анионы.
Уметь:
- объяснять явление аллотропии;
- характеризовать свойства галогенов и важнейших химических элементов – серы, азота, фосфора, углерода и кремния;
- вычислять массу или объем продукта реакции по известной массе или объему одного из исходных веществ, содержащего примеси;
- вычислять массу, объем и количество вещества по известным данным об исходных веществах, одно из которых дано в избытке;
- обращаться с лабораторным оборудованием;
- соблюдать правила техники безопасности;
- определять: хлорид-ионы, сульфат-ионы, карбонат – ионы, ионы аммония.
Подготовка к ГИА: 1.1; 1.2; 1.3; 1.4; 2.5; 3.1; 3.2; 4.2; 4.3; 4.4
Подготовка к ЕГЭ: 1.1; 1.2; 1.3; 1.5; 2.1; 2.2; 2.3
Тема 3. Органические соединения
Знать:
- причины многообразия углеродных соединений (изомерию);
- виды связей (одинарную, двойную, тройную);
- важнейшие функциональные группы органических веществ;
- номенклатуру основных представителей групп органических веществ;
- иметь понятие об альдегидах, сложных эфирах, жирах, аминокислотах, белках и углеводах.
Уметь:
- составлять формулы изомеров основных классов органических веществ;
- находить, определять из предложенных формул изомеры и гомологи.
Подготовка к ГИА: 3.4
Подготовка к ЕГЭ: 1.4; 1.5; 2.1; 2.2; 2.3
Тема 4. Обобщение знаний по химии за курс основной школы
Знать:
важнейшие химические понятия: химическая реакция, классификация реакций, электролит и неэлектролит, электролитическая диссоциация, окислитель и восстановитель, окисление и восстановление.
Уметь характеризовать
- химические элементы (от водорода до кальция) на основе их положения в периодической системе Д. И. Менделеева и особенностей строения их атомов;
- связь между составом, строением и свойствами веществ;
- химические свойства основных классов неорганических веществ.
Уметь определять:
- состав веществ по их формулам, принадлежность веществ к определенному классу соединений;
- типы химических реакций;
- валентность и степень окисления элемента в соединениях;
- тип химической связи в соединениях;
- возможность протекания реакций ионного обмена; составлять:
- формулы неорганических соединений изученных классов;
- схемы строения атомов первых 20 элементов периодической системы Д.И. Менделеева;
- уравнения химических реакций.
Подготовка к ГИА:1.1; 1.3; 1.6; 2.1; 2.2; 3.2
Подготовка к ЕГЭ: 1.1; 1.2; 1.5; 2.3
.
Учебно-методический комплект и дополнительная литература
1. Габриелян О. С., Воскобойникова Н. П., Яшукова А. В. Настольная книга учителя. Химия. 8 кл.: Методическое пособие. - М.: Дрофа, 2007.
2. Габриелян О. С., Остроумов И. Г. Настольная книга учителя. Химия. 9 кл.: Методическое пособие. - М.: Дрофа, 2007.
3. Химия. 8 кл.: Контрольные и проверочные работы к учебнику О. С. Габриеляна «Химия. 8» / О. С. Габриелян, П. Н. Березкин, А. А. Ушакова и др. - М.: Дрофа, 2007.
4. Химия. 9 кл.: Контрольные и проверочные работы к учебнику О. С. Габриеляна «Химия. 9» / О. С. Габриелян, П. Н. Березкин, А. А. Ушакова и др. - М.: Дрофа, 2007.
5. Габриелян О. С., Смирнова Т. В. Изучаем химию в 8 кл.: Дидактические материалы. - М.: Блик плюс, 2004.
6. Габриелян О. С., Остроумов И. Г. Изучаем химию в 9 кл.: Дидактические материалы. М.: Блик плюс, 2004.
7. Габриелян О. С., Рунов Н. Н., Толкунов В. И. Химический эксперимент в школе. 8 кл. - М.: Дрофа, 2006.
8. Габриелмн О. С., Яшукова А. В. Тетрадь для лабораторных опытов и практических работ. 8 кл. К учебнику О. С. Габриеляна «Химия. 8 класс». М.: Дрофа, 2006-2008.
9. Габриелян О. С., Воскобойникова Н. П. Химия в тестах, задачах, упражнениях. 8-9 кл. - М.: Дрофа, 2007.
Тематическое планирование по химии 9 класс
| № п/п | Кол час | Тема урока | По плану | Фактически |
|
|
| Повторение основных вопросов курса 8 класса (4 ч) |
|
|
| 1 | 1 | Характеристика элемента на основании его положения в периодической системе химических элементов Д.И.Менделеева. | 03.09 | 03.09 |
| 2 | 1
| Характеристика химического элемента по кислотно-основным свойствам образуемых им соединений | 04.09 | 04.09 |
| 3 | 1 | Амфотерные оксиды и гидроксиды Генетический ряд металла и неметалла | 10.09 | 10.09 |
| 4 | 1 | Периодический закон и Периодическая система химических элементов Д.И.Менделеева. | 11.09 | 11.09 |
|
|
| Тема21. Металлы (23 часа) |
|
|
| 5+ | 1 | Положение металлов в периодической системе химических элементов Д.И.Менделеева, строение их атомов. | 17.09 | 17.09 |
| 6 | 1 | Металлическая кристаллическая решетка и металлическая химическая связь. | 18.09 | 18.09 |
| 7 | 1 | Физические свойства металлов* | 24.09 | 01.10 |
| 8 | 1 | Химические свойства металлов, как восстановителей Электрохимический ряд напряжений металлов. | 26.09 |
| 9 | 1 | Получение металлов.* | 01.10 | 02.10 |
| 10 | 1 | Коррозия металлов и методы борьбы с ней. * | 02.10 |
| 11 | 1 | Сплавы, их свойства и значение* | 08.10 | 08.10 |
| 12 | 1 | Щелочные металлы – простые вещества, их физические и химические свойства | 09.10 | 09.10 |
| 13 | 1 | Важнейшие соединения щелочных металлов, их свойства и применение в народном хозяйстве. | 15.10 | 15.10 |
| 14 | 1 | Щелочноземельные металлы - простые вещества, их строение и физические.* | 17.10 |
|
| 15 | 1 | Химические свойства щелочноземельных металлов. | 22.10 |
|
| 16 | 1 | Важнейшие соединения щелочноземельных металлов, их свойства и применение в народном хозяйстве. | 24.10
|
|
| 17 | 1 | Проверочная работа | 29.10 |
|
| 18+ | 1 | Алюминий. Строение атома, физические и химические свойства | 31.10 |
|
| 19 | 1 | Соединения алюминия, их амфотерный характер | 11.10 |
|
| 20 | 1 | Важнейшие соли алюминия. Применение алюминия и его соединений. | 14.10 |
|
| 21 | 1 | Железо. Строение атома, физические и химические свойства. | 19.11 |
|
| 22 | 1 | Генетические ряды Fe2+ и Fе3+. Качественные реакции на Fе2+ и Fе3+. Значение железа, его соединений и сплавов в природе и народном хозяйстве | 21.11 |
|
| 23 | 1 | Контрольная работа № 1 по теме «Металлы». | 25.11 |
|
|
|
| Практикум №1 Свойства металлов и их соединений (3 ч) |
|
|
| 24 | 1 | П/р№1«Осуществление цепочки химических превращений» | 28.11 |
|
| 25 | 1 | П/р№2«Получение и свойства соединений металлов» | 03.12 |
|
| 26 | 1 | П/р№3«Экспериментальные задачи по распознаванию и получению веществ» | 05.12 |
|
|
|
| Неметаллы (28 ч) |
|
|
| 27 | 1 | Общая характеристика неметаллов. Кислород, озон, воздух.* | 10.12 |
|
| 28 | 1 | Водород, его физические и химические свойства. | 12.12 |
|
| 29 | 1 | Общая характеристика галогенов. Галогены – простые вещества | 17.12 |
|
| 30 | 1 | Соединения галогенов. | 19.12 |
|
| 31 | 1 | Получение и применение галогенов | 24.12 |
|
| 32 | 1 | Общая характеристика халькогенов. Кислород. * | 26.12 |
|
| 33 | 1 | Сера – простое вещество. | 14.01 |
|
| 34 | 1 | Соединения серы. Серная кислота* | 16.01 |
|
| 35 | 1 | Соли серной кислоты, их применение в народно хозяйстве. Качественная реакция на сульфат-ион.* | 21.01 |
|
| 36 | 1 | Азот – простое вещество | 23.01 |
|
| 37 | 1 | Аммиак. | 28.01 |
|
| 38 | 1 | Соли аммония. | 30.01 |
|
| 39 | 1 | Кислородные соединения азота | 04.02 |
|
| 40 | 1 | Азотная кислота и её свойства. | 06.02 |
|
| 41 | 1 | Соли азотной кислоты.* | 11.02 |
|
| 42
| 1
| Фосфор. Биологическое значение фосфора, его применение | 13.02 |
|
| 43 | 1 | Оксид фосфора (V). Ортофосфорная кислота и её соли. | 18.02 |
|
| 44 | 1 | Углерод, его физические и химические свойства. | 20.02 |
|
| 45 | 1 | Кислородные соединения углерода. Угольная кислота Карбонаты.* | 25.02 |
|
| 46 | 1 | Кремний, как простое вещество. * | 27.02 |
|
| 47 |
| Соединения кремния. Применение кремния и его соединений. Значение. | 04.03 |
|
| 48 | 1 | Повторение и обобщение темы «Неметаллы» | 06.03 |
|
| 49 | 1 | Контрольная работа №2 «Неметаллы» | 11.03 |
|
|
| Практикум №2 Свойства металлов и их соединений (3 ч) |
|
|
| 50 | 1 | Практическая работа № 4. Экспериментальные задачи по теме: «Подгруппа кислорода» | 13.03 |
|
| 51 | 1 | Практическая работа № 5 Решение экспериментальных задач по теме «Подгруппы азота и углерода». | 18.03 |
|
| 52 | 1 | Практическая работа № 6. Получение, собирание и распознавание газов. | 20.03 |
|
|
|
| Органические вещества (14 ч.) |
|
|
| 53 | 1 | Предмет органической химии. | 01.04 |
|
| 54 | 1 | Предельные углеводороды (метан, этан). | 03.04 |
|
| 55 | 1 | Непредельные углеводороды (этилен, ацитилен). | 08.04 |
|
| 56 | 1 | Ароматические углеводороды. Бензол. | 10.04 |
|
| 57 | 1 | Спирты.* | 15.04 |
|
| 58 | 1 | Альдегиды | 17.04 |
|
| 59 | 1 | Карбоновые кислоты. | 22.04 |
|
| 60 | 1 | Биологически важные вещества: жиры, белки, углеводы. | 24.04 |
|
| 61 | 1 | Полимеры * | 29.04 |
|
| 62 | 1 | Контрольная работа по теме№3 «Органические вещества» | 01.05 |
|
|
|
| Повторение и обобщение знаний за курс основной школы (12 ч.) |
|
|
| 63 | 1 | Периодический закон и периодическая система химических элементов Д.И.Менделеева в свете учения о строении атома. | 06.05 |
|
| 64 | 1 | Строение веществ. | 08.05 |
|
| 65 | 1 | Классификация химических реакций. | 13.05 |
|
| 66 | 1 | Классификация веществ. | 15.05 |
|
| 67 | 1 | Годовая контрольная работа | 20.05 |
|
| 68 | 1 | Заключительный урок | 22.05 |
|
*Национально-региональный компонент
Тематическое планирование по химии, 9 класс
(2 часа в неделю, всего 70 ч.)
УМК О.С. Габриеляна
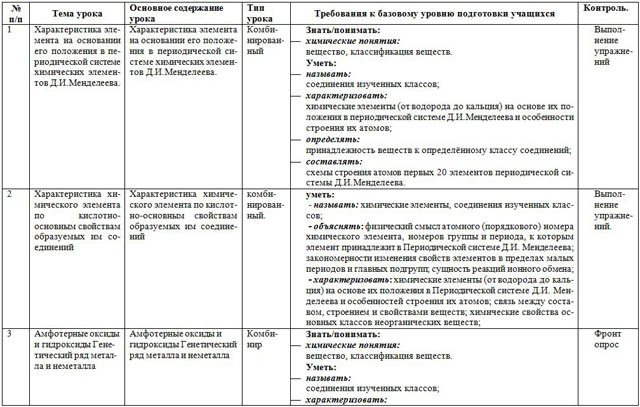
| № п/п | Тема урока | Основное содержание урока | Тип урока | Требования к базовому уровню подготовки учащихся | Контроль. |
| 1 | Характеристика элемента на основании его положения в периодической системе химических элементов Д.И.Менделеева. | Характеристика элемента на основании его положения в периодической системе химических элементов Д.И.Менделеева. | Комбинированный | Знать/понимать: вещество, классификация веществ. Уметь: соединения изученных классов; химические элементы (от водорода до кальция) на основе их положения в периодической системе Д.И.Менделеева и особенности строения их атомов; принадлежность веществ к определённому классу соединений; схемы строения атомов первых 20 элементов периодической системы Д.И.Менделеева. | Выполнение упражнений |
| 2 | Характеристика химического элемента по кислотно-основным свойствам образуемых им соединений | Характеристика химического элемента по кислотно-основным свойствам образуемых им соединений | комбинированный. | уметь: - называть: химические элементы, соединения изученных классов; - объяснять: физический смысл атомного (порядкового) номера химического элемента, номеров группы и периода, к которым элемент принадлежит в Периодической системе Д.И. Менделеева; закономерности изменения свойств элементов в пределах малых периодов и главных подгрупп; сущность реакций ионного обмена; - характеризовать: химические элементы (от водорода до кальция) на основе их положения в Периодической системе Д.И. Менделеева и особенностей строения их атомов; связь между составом, строением и свойствами веществ; химические свойства основных классов неорганических веществ; | Выполнение упражнений. |
| 3 | Амфотерные оксиды и гидроксиды Генетический ряд металла и неметалла | Амфотерные оксиды и гидроксиды Генетический ряд металла и неметалла | Комбинир | Знать/понимать: вещество, классификация веществ. Уметь: соединения изученных классов; химические элементы на основе их положения в периодической системе Д.И.Менделеева и особенности строения их атомов; генетический ряд металла, неметалла; - осуществлять превращения по указанному ряду.
| Фронт опрос |
| 4 | Периодический закон и Периодическая система химических элементов Д.И.Менделеева. | Периодический закон и периодическая система химических элементов Д. И. Менделеева в свете учения о строении атома. Их значение | Комбинир | Знать/понимать: химический элемент, атом; Периодический закон. Уметь: химические элементы по их символам; физический смысл атомного (порядкового) номера химического элемента, номеров группы и периода, к которым элемент принадлежит в периодической системе Д.И.Менделеева; закономерности изменения свойств элементов в пределах малых периодов главных подгрупп. | Работа по вариантам. |
| 5 | Положение металлов в периодической системе химических элементов Д.И.Менделеева, строение их атомов. | Положение металлов в периодической системе химических элементов Д. И. Менделеева. | Изучения и первич закрепления знаний | Уметь: положение металлов в периодической системе химических элементов Д.И.Менделеева и особенности строения их атомов.
| Выполнение упражнений |
| 6 | Металлическая кристаллическая решетка и металлическая химическая связь. | Металлическая кристаллическая решетка и металлическая химическая связь. | Изучения и первич закрепления знаний | Знать/понимать: - понятия: особенности строения атомов металлов; металлическая кристаллическая решётка; металлическая химическая связь. Уметь: схему образования связи. | Выполнение упражнений |
| 7 | Физические свойства металлов | Физические свойства металлов | Изучения и первич закрепления знаний | Знать/понимать: - понятия: общие физические свойства металлов; связь между физическими свойствами и строением металлов. | Тест |
| 8 | Химические свойства металлов, как восстановителей Электрохимический ряд напряжений металлов. | Химические свойства металлов, как восстановителей Электрохимический ряд напряжений металлов. | Изучения и первич закрепления знаний | Уметь: химические свойства металлов; уравнения реакций, характеризующие химические свойства металлов в свете представлений об окислительно-восстановительных реакциях и их положения в электрохимическом ряду напряжений (взаимодействие с неметаллами, кислотами и солями). | Выполнение упражнений |
| 9 | Получение металлов. | Способы получения металлов | Изучения и первич закрепления знаний | Уметь: уравнения реакций, характеризующие способы получения металлов в свете представлений об окислительно-восстановительных реакциях и их положения в электрохимическом ряду напряжений. | Тест |
| 10 | Коррозия металлов и методы борьбы с ней. | Коррозия металлов и методы борьбы с ней. | Изучения и первич закрепления знаний | Знать/понимать: - понятия: коррозия; способы борьбы с коррозией. Уметь: химические свойства металлов; уравнения реакций, характеризующие химические свойства металлов в свете представлений об окислительно-восстановительных реакциях. | Индивид задание |
| 11 | Сплавы, их свойства и значение | Сплавы, их свойства и значение | Изучения и первич закрепления знаний | Знать/понимать: окислитель и восстановитель, окисление и восстановление. Уметь: уравнения реакций восстановления металлов из их оксидов водородом, оксидом углерода (II), алюминием. | Выполнение упражнений |
| 12 | Щелочные металлы – простые вещества, их физические и химические свойства | Щелочные металлы – простые вещества, их физические и химические свойства | Изучения и первич закрепления знаний | Уметь: соединения щелочных металлов (оксиды, гидроксиды, соли); щелочные металлы (литий, натрий, калий) по их положению в периодической системе химических элементов Д.И.Менделеева; связь между составом, строением и свойствами щелочных металлов; уравнения химических реакций, характеризующие свойства щелочных металлов, их оксидов и гидроксидов; NaCI – консервант пищевых продуктов. закономерности изменения свойств щелочных металлов в пределах главной подгруппы; сходства и различия в строении атомов щелочных металлов;
| Выполнение упражнений |
| 13 | Важнейшие соединения щелочных металлов, их свойства и применение в народном хозяйстве. | Важнейшие соединения щелочных металлов, их свойства и применение в народном хозяйстве. | Изучения и первич закрепления знаний | Уметь: соединения щелочноземельных металлов (оксиды, гидроксиды, соли); закономерности изменения свойств щелочноземельных металлов в пределах главной подгруппы; сходства и различия в строении атомов щелочноземельных металлов; щелочноземельные металлы по их положению в периодической системе химических элементов Д.И.Менделеева; связь между составом, строением и свойствами щелочноземельных металлов; уравнения химических реакций, характеризующие свойства щелочноземельных металлов, их оксидов и гидроксидов. | Выполнение упражнений |
| 14 | Щелочноземельные металлы - простые вещества, их строение и физические. | Щелочноземельные металлы - простые вещества, их строение и физические. | Изучения и первич закрепления знаний | Выполнение упражнений |
| 15 | Химические свойства щелочноземельных металлов. | Химические свойства щелочноземельных металлов.Связь между строением и свойствами | Изучения и первич закрепления знаний | Выполнение упражнений |
| 16 | Важнейшие соединения щелочноземельных металлов, их свойства и применение в народном хозяйстве. | Важнейшие соединения щелочноземельных металлов, их свойства и применение в народном хозяйстве. | Изучения и первич закрепления знаний |
|
| 17 | Проверочная работа | Проверочная работа | Самост раб |
| Самост рабрта. |
| 18 | Алюминий. Строение атома, физические и химические свойства | Алюминий. Строение атома, физические и химические свойства | Изучения и первич закрепления знаний | Уметь: соединения алюминия по их химическим формулам; алюминий по его положению в периодической системе химических элементов Д.И.Менделеева; физические и химические свойства алюминия; уравнения химических реакций, характеризующие свойства алюминия. | Выполнение упражнений |
| 19 | Соединения алюминия, их амфотерный характер | Соединения алюминия, их амфотерный характер | Изучения и первич закрепления знаний | Выполнение упражнений |
| 20 | Важнейшие соли алюминия. Применение алюминия и его соединений. | Важнейшие соли алюминия. Применение алюминия и его соединений. | Изучения и первич закрепления знаний | Выполнение упражнений |
| 21 | Железо. Строение атома, физические и химические свойства. | Железо. Строение атома, физические и химические свойства. | Изучения и первич закрепления знаний | Уметь: соединения железа по их химическим формулам; особенности строения атома железа по его положению в периодической системе химических элементов Д.И.Менделеева; физические и химические свойства железа, оксидов железа (II) и (III); области применения железа; уравнения химических реакций, характеризующие свойства железа – простого вещества, оксидов железа (II) и (III). | Тест |
| 22 | Генетические ряды Fe2+ и Fе3+. Качественные реакции на Fе2+ и Fе3+. Значение железа, его соединений и сплавов в природе и народном хозяйстве | Генетические ряды Fe2+ и Fе3+. Качественные реакции на Fе2+ и Fе3+. Значение железа, его соединений и сплавов в природе и народном хозяйстве | Изучения и первич закрепления знаний |
| Выполнение упражнений |
| 23 | Контрольная работа № 1 по теме «Металлы». |
| Обобщ знан |
| Контрольная работа. |
| 24 | «Осуществление цепочки химических превращений» | «Осуществление цепочки химических превращений» | Практ раб | Уметь: химические свойства металлов и их соединений; уравнения химических реакций, характеризующие свойства металлов и их соединений; с химической посудой и лабораторным оборудованием; безопасного обращения с веществами. | Цепочка превращений |
| 25 | «Получение и свойства соединений металлов» | «Получение и свойства соединений металлов» | Прак раб | Прак работа. Оформ рез |
| 26 | «Экспериментальные задачи по распознаванию и получению веществ» | «Экспериментальные задачи по распознаванию и получению веществ» | Прак раб | Оформлен работы. |
| 27 | Общая характеристика неметаллов. Кислород, озон, воздух. | Общая характеристика неметаллов. Кислород, озон, воздух. | Изучения и первич закрепления знаний | Знать/понимать: знаки химических элементов-неметаллов. Уметь: химические элементы-неметаллы по их символам; закономерности изменения свойств неметаллов в пределах малых периодов и главных подгрупп; неметаллы малых периодов на основе их положения в периодической системе химических элементов Д.И.Менделеева; особенности строения атомов неметаллов; связь между составом, строением (кристаллические решётки) и свойствами неметаллов – простых веществ; тип химической связи в соединениях неметаллов. | Выполнение упражнений |
| 28 | Водород, его физические и химические свойства. | Водород, его физические и химические свойства. | Изучения и первич закрепления знаний | Знать/понимать: химический элемент, атом, молекула, относительная атомная и молекулярная массы, окислитель и восстановитель, окисление и восстановление. Уметь: двойственное положение водорода в периодической системе химических элементов Д.И. Менделеева; физические свойства водорода; химические свойства водорода в свете представлений об окислительно-восстановительных реакциях; уравнения химических реакций, характеризующие свойства водорода; водород среди других газов; безопасного обращения с водородом. | Фронт и индивид опрос. |
| 29 | Общая характеристика галогенов. Галогены – простые вещества | Общая характе¬ристика галоге¬нов. Галогены – простые вещества. Степень окисления | Изучения и первич закрепления знаний | Знать/понимать: знаки химических элементов-галогенов, формулы простых веществ – галогенов. Уметь: закономерности изменения свойств галогенов в пределах главной подгруппы; особенности строения атомов галогенов; физические и химические свойства галогенов: взаимодействие с металлами, водородом, растворами солей галогенов; степень окисления галогенов в соединениях; тип химической связи в соединениях галогенов; уравнения химических реакций, характеризующие свойства галогенов; безопасного обращения с хлором. | Выполнение упражнений |
| 30 | Соединения галогенов. | Соединения галогенов | Изучения и первич закрепления знаний | Знать/понимать: формулы галогеноводородов, галогеноводородных кислот. Уметь: соединения галогенов по их химических формулам; химические свойства соляной кислоты; химические формулы галогеноводородов и галогенидов; уравнения химических реакций, характеризующие свойства соляной кислоты и хлоридов; соляную кислоту среди растворов веществ других классов; хлорид-ион среди других ионов.
| Выполнение упражнений |
| 31 | Получение и применение галогенов | Получение и применение галогенов | Изучения и первич закрепления знаний | Уметь: - использовать приобретённые знания в прак-тической деятельности и повседневной жизни для: критической оценки информации о применении в бы-ту йода (спиртовой раствор) и поваренной соли | Оформление рабо-ты. |
| 32 | Общая характеристика халькогенов. Кислород. | Общая характеристика халькогенов. Кислород. | Изучения и первич закрепления знаний | Знать/понимать: химический элемент, атом, молекула, относительная атомная и молекулярная массы, окислитель и восстановитель, окисление и восстановление. Уметь: строение атома кислорода по его положению в периодической системе химических элементов Д.И.Менделеева; физические свойства кислорода; химические свойства кислорода: взаимодействие с простыми веществами (металлами и неметаллами), сложными веществами; тип химической связи в молекуле кислорода и в оксидах; степень окисления атома кислорода в соединениях; уравнения химических реакций, характеризующие свойства кислорода; кислород среди других газов; безопасного обращения с кислородом (условия горения и способы его прекращения). | Выполнение упражнений |
| 33 | Сера – простое вещество. | Сера – простое вещество. | Изучения и первич закрепления знаний | Знать/понимать: формулы оксида серы (IV) и оксида серы (VI). Уметь: строение атома серы по её положению в периодической системе химических элементов Д.И. Менделеева; закономерности изменения свойств элементов (кислорода и серы) в пределах главной подгруппы; физические свойства серы; химические свойства серы (взаимодействие с металлами, кислородом, водородом) в свете представлений об окислительно-восстановительных реакциях; тип химической связи в соединениях серы; степень окисления атома серы в соединениях; уравнения химических реакций, характеризующие свойства серы; экологически грамотного поведения (для удаления и обезвреживания разлитой ртути). оксиды серы по их химическим формулам; физические свойства оксидов серы; химические свойства оксидов серы (как типичных кислотных оксидов); принадлежность оксидов серы к кислотным оксидам; степень окисления атома серы и тип химической связи в оксидах; уравнения химических реакций взаимодействия оксидов с водой, с основными оксидами, щелочами; экологически грамотного поведения в окружающей среде (кислотные дожди). | Выполнение упражнений |
| 34 | Соединения серы. Серная кислота | Соединения серы. Серная кислота | Изучения и первич закрепления знаний | Знать/понимать: формулу серной кислоты. Уметь: серную кислоту и сульфаты по их химическим формулам; физические свойства концентрированной серной кислоты; химические свойства серной кислоты в свете теории электролитической диссоциации и окислительно-восстановительных реакций; народнохозяйственное значение серной кислоты и её солей; принадлежность серной кислоты и её солей к соответствующим классам неорганических соединений; валентность и степень окисления серы в серной кислоте и в сульфатах; химические формулы сульфатов; уравнения химических реакций, характеризующие свойства разбавленной серной кислоты; уравнения химических реакций, характеризующие свойства концентрированной серной кислоты (взаимодействие с медью); серную кислоту среди растворов веществ других классов; сульфат-ион среди других ионов; безопасного обращения с концентрированной серной кислотой (растворение). | Выполнение упражнений. Тест по вариантам |
| 35 | Соли серной кислоты, их применение в народно хозяйстве. Качественная реакция на сульфат-ион. | Соли серной кислоты, их применение в народно хозяйстве. Качественная реакция на сульфат-ион. | Изучения и первич закрепления знаний | Выполнение упражнений |
| 36 | Азот – простое вещество | Азот – простое вещество |
| Изучения и первич закрепления знаний | Выполнение упражнений |
| 37 | Аммиак. | Аммиак. |
| Изучения и первич закрепления знаний | Индивид задание. |
| 38 | Соли аммония. | Соли аммония. |
| Изучения и первич закрепления знаний | Выполнение упражнений |
| 39 | Кислородные соединения азота | Кислородные соединения азота | Изучения и первич закрепления знаний | Знать/понимать: формулы оксида азота (II) и оксида азота (IV). Уметь: оксиды азота по их химическим формулам; физические свойства оксидов азота; химические свойства оксида азота (IV) (как типичного кислотного оксида); принадлежность оксидов азота к соответствующему классу неорганических соединений; степень окисления атома азота и тип химической связи в оксидах; уравнения химических реакций, характеризующие свойства оксида азота (IV); | Табл |
| 40 | Азотная кислота и её свойства. | Азотная кислота и её свойства. | Изучения и первич закрепления знаний | Знать/понимать: формулу азотной кислоты. Уметь: физические свойства азотной кислоты; химические свойства азотной кислоты в свете теории электролитической диссоциации и окислительно-восстановительных реакций; народнохозяйственное значение азотной кислоты; принадлежность азотной кислоты к соответствующему классу неорганических соединений; валентность и степень окисления азота в азотной кислоте; уравнения химических реакций, характеризующие свойства разбавленной азотной кислоты; уравнения химических реакций, характеризующие свойства концентрированной азотной кислоты (взаимодействие с медью); азотную кислоту среди растворов веществ других классов; безопасного обращения с концентрированной азотной кислотой. соли азотной кислоты по их химическим формулам; химические свойства солей азотной кислоты (разложение при нагревании); химические формулы нитратов; уравнения химических реакций, характеризующие свойства нитратов;
| Самост работа |
| 41 | Соли азотной кислоты. | Соли азотной кислоты. | Изучения и первич закрепления знаний | Знать/понимать: состав удобрений; критической оценки информации о нитратах (проблема их содержания в сельскохозяйственной продукции). | табл |
| 42
| Фосфор. Биологическое значение фосфора, его применение | Фосфор. Биологическое значение фосфора, его применение | Изучения и первич закрепления знаний | Уметь: строение атома фосфора по его положению в периодической системе химических элементов Д.И. Менделеева; закономерности изменения свойств элементов (азота и фосфора) в пределах главной подгруппы; химические свойства фосфора (взаимодействие с металлами, кислородом) в свете представлений об окислительно-восстановительных реакциях; тип химической связи в соединениях фосфора; степень окисления атома фосфора в соединениях; уравнения химических реакций, характеризующие свойства фосфора. | Самост раб |
| 43 | Оксид фосфора (V). Ортофосфорная кислота и её соли. | Оксид фосфора (V). Ортофосфорная кислота и её соли. | Изучения и первич закрепления знаний | Знать/понимать: формулы оксида фосфора (V) и ортофосфорной кислоты. Уметь: оксид фосфора (V), ортофосфорную кислоту и её соли по их химическим формулам; химические свойства оксида фосфора (V), ортофосфорной кислоты в свете теории электролитической диссоциации; народнохозяйственное значение фосфатов; принадлежность оксида фосфора (V), ортофосфорной кислоты и её солей к соответствующим классам неорганических соединений; валентность и степень окисления атома фосфора в оксиде фосфора (V), ортофосфорной кислоте и в фосфатах; химические формулы фосфатов; уравнения химических реакций, характеризующие свойства оксида фосфора (V) как типичного кислотного оксида; уравнения химических реакций, характеризующие свойства ортофосфорной кислоты. | Выполнение упражнений |
| 44 | Углерод, его физические и химические свойства. | Углерод, его физические и химические свойства. | Изучения и первич закрепления знаний | Уметь: строение атома углерода по его положению в периодической системе химических элементов Д.И. Менделеева; химические свойства углерода (взаимодействие с металлами, оксидами металлов, водородом, кислородом) в свете представлений об окислительно-восстановительных реакциях; тип химической связи в соединениях углерода; степень окисления атома углерода в соединениях; уравнения химических реакций, характеризующие свойства углерода. | Выполнение упражнений |
| 45 | Кислородные соединения углерода. Угольная кислота Карбонаты. | Кислородные соединения углерода. Угольная кислота Карбонаты. | Изучения и первич закрепления знаний | Знать/понимать: формулы оксида углерода (II) и оксида углерода (IV). формулу угольной кислоты Уметь: оксиды углерода по их химическим формулам; соли угольной кислоты по их химическим формулам физические свойства оксидов углерода; химические свойства оксида углерода (IV) (как типичного кислотного оксида); народнохозяйственное значение карбонатов; принадлежность оксидов углерода к определённому классу соединений; степень окисления атома углерода и тип химической связи в оксидах; степень окисления углерода в угольной кислоте;
уравнения химических реакций, характеризующие свойства оксида углерода (IV); химические формулы карбонатов и гидрокарбонатов; уравнения химических реакций превращения карбонатов в гидрокарбонаты и наоборот углекислый газ среди других газов; карбонат-ион среди других ионов безопасного обращения с оксидом углерода (II). | Табл. |
| 46 | Кремний, как простое вещество. | Кремний, как простое вещество. | Изучения и первич закрепления знаний | Знать/понимать: формулы оксида кремния (IV) и кремниевой кислоты. Уметь: оксид кремния (IV), кремниевую кислоту и её соли по их химическим формулам; химические свойства оксида кремния (IV), кремниевой кислоты в свете теории электролитической диссоциации; народнохозяйственное значение силикатов; принадлежность оксида кремния (IV), кремниевой кислоты и её солей к определённым классам неорганических соединений; валентность и степень окисления атома кремния в оксиде кремния (IV), кремниевой кислоте и в силикатах; химические формулы силикатов; уравнения химических реакций, характеризующие свойства кремния, оксида кремния (IV) и кремниевой кислоты. | Выполнение упражнений |
| 47 | Соединения кремния Применение кремния и его соединений. Значение | Соединения кремния Применение кремния и его соединений. Значение | Изучения и первич закрепления знаний | Табл. |
| 48 | Повторение и обобщение темы «Неметаллы» | Повторение и обобщение темы «Неметаллы» | Изучения и первич закрепления знаний | Уметь: химические свойства веществ, образованных элементами подгрупп азота и углерода; уравнения химических реакций, характеризующие свойства веществ, образованных элементами подгрупп азота и углерода; с химической посудой и лабораторным оборудованием; безопасного обращения с веществами. |
|
| 49 | Контрольная работа №2 «Неметаллы» |
| Обобщ раб |
|
|
|
| Практикум №2
Свойства металлов и их соединений (3 ч) |
|
|
|
|
| 50 | Практическая работа № 4. Экспериментальные задачи по теме: «Подгруппа кислорода» | Решение эксперемент задач | Прак работа | Уметь: химические свойства веществ, образованных элементами подгрупп азота и углерода; уравнения химических реакций, характеризующие свойства веществ, образованных элементами подгрупп азота и углерода; с химической посудой и лабораторным оборудованием; безопасного обращения с веществами. Уметь: способы получение, собирания и распознавания важнейших газов; уравнения химических реакций получения газов; с химической посудой и лабораторным оборудованием; безопасного обращения с веществами. | Оформ работы |
| 51 | Практическая работа № 5 Решение экспериментальных задач по теме «Подгруппы азота и углерода». | Решение эксперемент задач | Прак работа | Оформ работы |
| 52 | Практическая работа № 6. Получение, собирание и распознавание газов. | По¬лучение, соби¬рание и распо¬знавание газов. | Прак работа | Оформ работы |
| 53 | Предмет органической химии. | Предмет органической химии. | Изучения и первич закрепления знаний | Знать/понимать: вещество, классификация веществ. Уметь: строение атома углерода; связь между составом и строением органических веществ; валентность и степень окисления углерода в органических соединениях. | Фронт опрос |
| 54 | Предельные углеводороды (метан, этан). | Предельные углеводороды (метан, этан). | Изучения и первич закрепления знаний | Знать/понимать: формулы метана и этана. Уметь: метан и этан по их химическим формулам; связь между составом, строением и свойствами метана и этана; химические свойства метана (горение), этана (горение и дегидрирование); принадлежность метана и этана к предельным углеводородам; уравнения реакций, характеризующие химические свойства метана и этана (горение, дегидрирование); безопасного обращения с метаном (природным газом). | Индивид задание |
| 55 | Непредельные углеводороды (этилен, ацитилен). | Непредельные углеводороды (этилен, ацитилен). | Изучения и первич закрепления знаний | Знать/понимать: формулу этилена. Уметь: этилен по его химической формуле; связь между составом, строением и свойствами этилена; химические свойства этилена (горение, взаимодействие с водой, бромом); принадлежность этилена к непредельным углеводородам; уравнения реакций, характеризующие химические свойства этилена (горение, взаимодействие с водой, бромом). | Выполнение упражнений |
| 56 | Ароматические углеводороды. Бензол. | Ароматические углеводороды. Бензол. | Изучения и первич закрепления знаний | Знать/понимать: формулу бензола. Уметь: бензол по его химической формуле; связь между составом, строением и свойствами бензола; химические свойства определять: принадлежность этилена к непредельным углеводородам; уравнения реакций, характеризующие химические свойства бензола. | Выполнение упражнений |
| 57 | Спирты. | Спирты. | Изучения и первич закрепления знаний | Знать/понимать: формулы метанола, этанола и глицерина. Уметь: спирты (метанол, этанол, глицерин) по их химическим формулам; связь между составом и свойствами спиртов; химические свойства метанола и этанола (горение); принадлежность метанола, этанола и глицерина к классу спиртов; уравнения реакций, характеризующие химические свойства метанола и этанола (горение); критической оценки информации о метаноле и этаноле. | Тест. |
| 58 | Альдегиды | Альдегиды | Изучения и первич закрепления знаний | Знать/понимать: формулы уксусного и муравьиного альдегидов. Уметь: альдегиды по их химическим формулам; связь между составом, строением и свойствами альдегидов; принадлежность уксусного и муравьиного альдегидов к определённому классу органических соединений; уравнения реакций, характеризующие химические свойства уксусного и муравьиного альдегидов | Выполнение упражнений |
| 59 | Карбоновые кислоты. | Карбоновые кислоты. | Изучения и первич закрепления знаний | Знать/понимать: формулы уксусной и стеариновой кислот. Уметь: уксусную и стеариновую кислоту по их химическим формулам; связь между составом, строением и свойствами кислот; химические свойства уксусной кислоты (общие с другими кислотами); принадлежность уксусной и стеариновой кислот к определённому классу органических соединений; уравнения реакций, характеризующие химические свойства уксусной кислоты (общие с другими кислотами); безопасного обращения с уксусной кислотой. | Выполнение упражнений |
| 60 | Биологически важные вещества: жиры, белки, углеводы. | Биологически важные вещества: жиры, белки, углеводы. | Изучения и первич закрепления знаний | Уметь: нахождение в природе и применение жиров; состав, физические свойства и применение глюкозы, крахмала и целлюлозы; физические свойства белков и их роль в организме. | Сообщение |
| 61 | Полимеры | Полимеры | Изучения и первич закрепления знаний |
| Табл. |
| 62 | Контрольная работа по теме «Органические вещества» |
| Обобщ урок |
| Самост раб |
|
| Повторение и обобщение знаний за курс основной школы (12 ч.) |
|
|
|
|
| 63 | Периодический закон и периодическая система химических элементов Д.И.Менделеева в свете учения о строении атома. | Периодический закон и периодическая система химических элементов Д.И.Менделеева в свете учения о строении атома. | Повторение. комбинир урок | Знать/понимать: химический элемент, атом; Периодический закон. Уметь: химические элементы по их символам; физический смысл атомного (порядкового) номера химического элемента, номеров группы и периода, к которым элемент принадлежит в периодической системе Д.И.Менделеева; закономерности изменения свойств элементов в пределах малых периодов главных подгрупп. | Выполнение упражнений |
| 64 | Строение веществ. | Строение веществ. Атом, молекула, ион, химическая связь. | Повторение. комбинир урок | Знать/понимать: атом, молекула, ион, химическая связь. Уметь: связь между составом, строением и свойствами веществ; тип химической связи в соединениях. | Выполнение упражнений |
| 65 | Классификация химических реакций. | Классификация химических реакций. Типы химических реакций; | Повторение. комбинир урок | Знать/понимать: уравнения химических реакций; химическая реакция, классификация реакций. Уметь: типы химических реакций; возможность протекания реакций ионного обмена; уравнения химических реакций. | Выполнение упражнений |
| 66 | Классификация веществ. | Классификация веществ. | Повторение. комбинир урок | Знать/понимать: формулы химических веществ; вещество, классификация веществ, электролит и неэлектролит, окислитель и восстановитель. Уметь: соединения изученных классов; сущность реакций ионного обмена; химические свойства простых веществ и основных классов неорганических соединений; состав веществ по их формулам; принадлежность веществ к определённому классу соединений; формулы неорганических соединений изученных классов. | Выполнение упражнений |
| 67 | Выполнение упражнений по теме |
| Повторение |
|
|
| 68 | Годовая контрольная работа |
| Обобщ урок |
|
|
| 69, 70 | Резервное время. |
|
|
|
|

 Получите свидетельство
Получите свидетельство Вход
Вход











 Рабочая программа по химии (9-е классы) (0.35 MB)
Рабочая программа по химии (9-е классы) (0.35 MB)
 0
0 568
568 46
46 Нравится
0
Нравится
0







