Рабочая программа по химии 8 класс
(2 часа в неделю, всего 70 часов,
из них 3 часа – резервное время)
УМК О.С. Габриеляна
Пояснительная записка
Изучение химии на ступени основного общего образования направлено на достижение следующих целей:
применение полученных знаний и умений для безопасного использования веществ и материалов в быту, сельском хозяйстве и на производстве, решения практических задач в повседневной жизни, предупреждения явлений, наносящих вред здоровью человека и окружающей среде.
Концепции, заложенные в содержании учебного материала.
Рабочая программа по химии построена на основе концентрического подхода. Это достигается путем вычленения укрупненной дидактической единицы. Количество часов на каждую тему определено в соответствии с контингентом обучающихся данного класса.
В рабочей программе нашли отражение цели и задачи изучения химии на ступени основного общего образования, изложенные в пояснительной записке Примерной программы по химии. В ней так же заложены возможности предусмотренного стандартом формирования у обучающихся общеучебных умений и навыков, универсальных способах деятельности и ключевых компетенций. Принципы отбора основного и дополнительного содержания связаны с преемственностью целей образования на различных ступенях и уровнях обучения, логикой внутрипредметных связей, а так же возрастными особенностями учащихся.
Основное содержание курса химии 8 класса составляют сведения о химическом элементе и формах его существования – атомах, изотопах, ионах, простых веществах и важнейших соединениях элемента, некоторых закономерностях протекания реакций и их классификации.Курс 8 класса начинается темой «Введение». В теме «Атомы химических элементов» рассматриваются атомы как форма существования химических элементов, состав атомных ядер, взаимодействие атомов между собой, виды связей, в теме «Простые вещества» - положение металлов и неметаллов в ПС Д.И. Менделеева, общие физические свойства металлов, важнейшие простые вещества – неметаллы, простые вещества и сложные и их свойства, постоянные величины Авогадро, молярный объем. В теме «Соединения химические соединения» рассматривается степень окисления, составление формул, основные классы неорганических веществ, смеси. Заканчивается изучение химии 8 класса темой «Растворение. Растворы. Свойства растворов электролитов».
Исходными документами для составления рабочей программы явились:
-федеральный компонент государственного стандарта общеобразовательных учреждений, утвержденный приказом Министерства Российской Федерации № 1089 от 05.03.2004г;
-федеральный базисный учебный план для основного общего образования, утвержденный приказом Минобразования РФ №1312 от 09.03.2004г;
-федеральный перечень учебников, рекомендованных (допущенных) Миннистерством образования к использованию в образовательном процессе в ОУ, реализуемых образовательные программы основного общего образования на 20010/11 учебный год, утвержденный Приказом МО РФ № 822 от 23.12.2009г;
-Письмо Минобразования России от 01.04.2005 № 03-47 «О перечне УМК для оснащения образовательных учреждений» (http://www.vestnik.edu.ru)
-Примерной программы основного общего образования по химии (базовый уровень);
-авторской программы О.С.Габриеляна, соответствующей Федеральному компоненту Государственного стандарта общего образования и допущенной Министерством образования и науки Российской Федерации (О.С.Габриелян Программа курса химии для 8-11 классов общеобразовательных учреждений / О.С.Габриелян. – 7-е издание, переработанное и дополненное – М.: Дрофа, 2010г.).
В авторскую программу внесены следующие изменения:
В авторскую программу внесены следующие изменения:
1.Увеличено число часов на изучение тем:
- «Введение» 5 часов вместо 4 часов за счет включения практических работ №1 и №2.
- Тема 3 «Соединения химических элементов» до 15 часов вместо 12 часов за счет включения практических работ №3 и №5.
- Тема №4 «Изменения, происходящие с веществами» 11 часов вместо 10 часов за счет включения практической работы №4.
- Тема №6 «Растворение. Растворы. Свойства растворов электролитов» 21 час вместо 18 часов за счет включения практических работ №7, 8, 9. Практическая работа №6 исключена, т.к. опыты из этой работы повторяются в практической работе №7.
Таким образом, практические работы, составляющие тему 5 и тему 7, распределены по другим темам курса в соответствии с изучаемым материалом (нумерация практических работ по учебнику О.С. Габриеляна 2005г. издания)
2.Уменьшено число часов на изучение темы 11 «Атомы химических элементов» с 10 часов до 8 часов, т.к. понятие об изотопах рассматривается на уроке «Основные сведения о строении атомов».
3.Из авторской программы исключена часть учебного материала, который отсутствует в обязательном минимуме содержания основных образовательных программ для основной школы, также исключены некоторые демонстрационные опыты и лабораторные работы из-за недостатка времени на их выполнение при 2 часах в неделю.
Срок реализации рабочей программы 1 год.
Уровень программы - базовый. Учитывая продолжительность учебного года (34 недели), планирование составлено на 70 часов в год. Объем учебной нагрузки согласно учебного плана школы на 2012/13 учебный год 2 часа в неделю. Количество часов в неделю на изучение предмета согласно программе - 2 часа.
Формы и методы, технологии обучения.
Реализация данной программы рассчитана на использование традиционных технологий образования, а так же методов современных образовательных технологий. С использованием следующих форм работы, таких как лекция, беседа, рассказ, инструктаж, демонстрация, упражнения, решение задач, работа с книгой. Методов: проблемный метод, проектный метод, развивающее обучение, информационно-комуникативные методы, объяснительно-иллюстративный метод; репродуктивный метод; метод проблемного изложения; частичнопоисковый, или эвристический метод; исследовательский метод.
В реализации данной программы используются следующие средства:
учебно-лабораторное оборудование;
учебно-производственное оборудование;
учебно-наглядные пособия;
мультимединое оборудование;
организационно-педагогические средства (учебные планы, экзаменационные билеты, карточки-задания, учебные пособия и т.п.)
Контроль за уровнем ЗУН представляет проведение практических работ, контрольных работ, как в традиционной, так и в тестовой формах.
Обоснование выбора УМК для реализации рабочей учебной программы.
Авторской программе соответствует учебник: «Химия 8 класс»
О.С.Габриелян - рекомендовано Министерством образования и науки РФ / 10-е издание, переработанное – М.: Дрофа, 2009.
Данный учебно-методический комплект, обеспечивающий реализацию программы - это целостная система, в ее состав входят учебная программа и учебник для учащихся.
Учебники данного автора включены в Федеральный перечень учебников, рекомендованных (допущенных) Министерством образования и науки Российской Федерации к использованию в образовательном процессе в общеобразовательных учреждениях, на текущий учебный год.
Рекомендуемая литература по учебной дисциплине подразделяется на основную и дополнительную. Перечень основной литературы включает издания, содержание которых конкретизирует знания обучаемых по основным вопросам, изложенным в программе.
Дополнительный список соответствует рекомендуемым автором учебной программы.
ОСНОВНОЕ СОДЕРЖАНИЕ БАЗОВОГО КУРСА ХИМИИ
8 КЛАСС
(2/3 ч в неделю; всего 68/102 ч)
Введение (4/6 ч)
Химия — наука о веществах, их свойствах и превращениях.
Понятие о химическом элементе и формах его существования: свободных атомах, простых и сложных веществах.
Превращения веществ. Отличие химических реакций от физических явлений. Роль химии в жизни человека. Хемофилия и хемофобия.
Краткие сведения из истории возникновения и развития химии. Период алхимии. Понятие о философском камне. Химия в ХVI в. Развитие химии на Руси. Роль отечественных ученых в становлении химической науки - работы М. В. Ломоносова, А. М. Бутлерова, Д. И. Менделеева.
Химическая символика. Знаки химических элементов и происхождение их названий. Химические формулы. Индексы и коэффициенты. Относительные атомная и молекулярная массы. Расчет массовой доли химического элемента по формуле вещества.
Периодическая система химических элементов Д. И. Менделеева, ее структура: малые и большие периоды, группы и подгруппы (главная и побочная). Периодическая система как справочное пособие для получения сведений о химических элементах.
Расчетные задачи. 1. Нахождение относительной молекулярной массы вещества по его химической формуле. 2. Вычисление массовой доли химического элемента в веществе по его формуле.
Тема 1
Атомы химических элементов (1 0/13 ч)
Атомы как форма существования химических элементов. Основные сведения о строении атомов. Доказательства сложности строения атомов. Опыты Резерфорда. Планетарная модель строения атома.
Состав атомных ядер: протоны и нейтроны. Относительная атомная масса. Взаимосвязь понятий «протон», «нейтрон», «относительная атомная масса».
Изменение числа протонов в ядре атома - образование новых химических элементов.
Изменение числа нейтронов в ядре атома - образование изотопов. Современное определение понятия «химический элемент». Изотопы как разновидности атомов одного химического элемента.
Электроны. Строение электронных оболочек атомов химических элементов №1-20 периодической системы Д. И. Менделеева. Понятие о завершенном и незавершенном электронном слое (энергетическом уровне).
Периодическая система химических элементов Д. И. Менделеева и строение атомов: физический смысл порядкового номера элемента, номера группы, номера периода.
Изменение числа электронов на внешнем электронном уровне атома химического элемента - образование положительных и отрицательных ионов. Ионы, образованные атомами металлов и неметаллов. Причины изменения металлических и неметаллических свойств в периодах и группах.
Образование бинарных соединений. Понятие об ионной связи. Схемы образования ионной связи.
Взаимодействие атомов химических элементов-неметаллов между собой - образование двухатомных молекул простых веществ. Ковалентная неполярная химическая связь.
Электронные и структурные формулы.
Взаимодействие атомов химических элементов-неметаллов между собой - образование бинарных соединений неметаллов. Электроотрицательность. Понятие о ковалентной полярной связи.
Взаимодействие атомов химических элементов-металлов между собой - образование металлических кристаллов. Понятие о металлической связи.
Демонстрации. Модели атомов химических элементов. Периодическая система химических элементов Д. И. Менделеева.
Тема 2
Простые вещества (7/9 ч)
Положение металлов и неметаллов в периодической системе химических элементов Д. И. Менделеева. Важнейшие простые вещества - металлы: железо, алюминий, кальций, магний, натрий, калий. Общие физические свойства металлов.
Важнейшие простые вещества - неметаллы, образованные атомами кислорода, водорода, азота, серы, фосфора, углерода. Способность атомов химических элементов к образованию нескольких простых веществ - аллотропия. Аллотропные модификации кислорода, фосфора и олова. Металлические и неметаллические свойства простых веществ. Относительность деления простых веществ на металлы и неметаллы.
Постоянная Авогадро. Количество вещества. Моль. Молярная масса. Молярный объем газообразных веществ. Кратные единицы количества вещества — миллимоль и киломоль, миллимолярная и киломолярная массы вещества, миллимолярный и киломолярный объемы газообразных веществ.
Расчеты с использованием понятий «количество вещества», «молярная масса», «молярный объем газов», «постоянная Авогадро».
Расчетные задачи. 1. Вычисление молярной массы веществ по химическим формулам. 2. Расчеты с использованием понятий «количество вещества», «молярная масса», «молярный объем газов», «постоянная Авогадро».
Демонстрации. Получение озона. Образцы белого и серого олова, белого и красного фосфора. Некоторые металлы и неметаллы количеством вещества 1 моль. Модель молярного объема газообразных веществ.
Тема 3
Соединения химических элементов (12/16 ч)
Степень окисления. Определение степени окисления элементов по химической формуле соединения. Составление формул бинарных соединений, общий способ их называния. Бинарные соединения: оксиды, хлориды, сульфиды и др. Составление их формул. Представители оксидов: вода, углекислый газ и негашеная известь. Представители летучих водородных соединений: хлороводород и аммиак.
Основания, их состав и названия. Растворимость оснований в воде. Таблица растворимости гидроксидов и солей в воде. Представители щелочей: гидроксиды натрия, калия и кальция. Понятие о качественных реакциях. Индикаторы. Изменение окраски индикаторов в щелочной среде.
Кислоты, их состав и названия. Классификация кислот. Представители кислот: серная, соляная и азотная. Изменение окраски индикаторов в кислотной среде.
Соли как производные кислот и оснований. Их состав и названия. Растворимость солей в воде. Представители солей: хлорид натрия, карбонат и фосфат кальция.
Аморфные и кристаллические вещества.
Межмолекулярные взаимодействия. Типы кристаллических решеток: ионная, атомная, молекулярная и металлическая. Зависимость свойств веществ от типов кристаллических решеток.
Вещества молекулярного и немолекулярного строения. Закон постоянства состава для веществ молекулярного строения.
Чистые вещества и смеси. Примеры жидких, твердых и газообразных смесей. Свойства чистых веществ и смесей. Их состав. Массовая и объемная доли компонента смеси. Расчеты, связанные с использованием понятия доля.
Расчетные задачи. 1. Расчет массовой и объемной долей компонентов смеси веществ. 2. Вычисление массовой доли вещества в растворе по известной массе растворенного вещества и массе растворителя. 3. Вычисление массы растворяемого вещества и растворителя, необходимых для приготовления определенной массы раствора с известной массовой долей растворенного вещества.
Демонстрации. Образцы оксидов, кислот, оснований и солей. Модели кристаллических решеток хлорида натрия, алмаза, оксида углерода (IV). Взрыв смеси водорода с воздухом. Способы разделения смесей, дистилляция воды.
Лабораторные опыты. 1. Знакомство с образцами веществ разных классов.
2. Разделение смесей.
Тема 4
Изменения, происходящие с веществами (10/13 ч)
Понятие явлений как изменений, происходящих с веществами. Явления, связанные с изменением кристаллического строения вещества при постоянном его составе, физические явления. Физические явления в химии: дистилляция, кристаллизация, выпаривание и возгонка веществ, центрифугирование.
Явления, связанные с изменением состава вещества, - химические реакции. Признаки и условия протекания химических реакций. Понятие об экзо- и эндотермических реакциях. Реакции горения как частный случай экзотермических реакций, протекающих с выделением света.
Закон сохранения массы веществ. Химические уравнения. Значение индексов и коэффициентов. Составление уравнений химических реакций.
Расчеты по химическим уравнениям. Решение задач на нахождение количества вещества, массы или объема продукта реакции по количеству вещества, массе или объему исходного вещества. Расчеты с использованием понятия «доля», когда исходное вещество дано в виде раствора с заданной массовой долей растворенного вещества или содержит определенную долю примесей.
Реакции разложения. Понятие о скорости химических реакций. Катализаторы. Ферменты.
Реакции соединения. Каталитические и некаталитические реакции. Обратимые и необратимые реакции.
Реакции замещения. Электрохимический ряд напряжений металлов, его использование для прогнозирования возможности протекания реакций между металлами и растворами кислот. Реакции вытеснения одних металлов из растворов их солей другими металлами.
Реакции обмена. Реакции нейтрализации. Условия протекания реакций обмена в растворах до конца.
Типы химических реакций (по признаку «число и состав исходных веществ и продуктов реакции») на примере свойств воды. Реакция разложения - электролиз воды. Реакции соединения - взаимодействие воды с оксидами металлов и неметаллов. Понятие «гидроксиды». Реакции замещения - взаимодействие воды с щелочными и щелочноземельными металлами. Реакции обмена (на примере гидролиза сульфида алюминия и карбида кальция).
Расчетные задачи. 1. Вычисление по химическим уравнениям массы или количества вещества по известной массе или количеству вещества одного из вступающих в реакцию веществ или продуктов реакции. 2. Вычисление массы (количества вещества, объема) продукта реакции, если известна масса исходного вещества, содержащего определенную долю примесей. 3. Вычисление массы (количества вещества, объема) продукта реакции, если известна масса раствора и массовая доля растворенного вещества.
Демонстрации. Примеры физических явлений; а) плавление парафина; б) возгонка иода или бензойной кислоты; в) растворение перманганата калия; г) диффузия душистых веществ с горящей лампочки накаливания. Примеры химических явлений: а) горение магния, фосфора; б) взаимодействие соляной кислоты с мрамором или мелом; в) получение гидроксида меди (II); г) растворение полученного гидроксида в кислотах; д) взаимодействие оксида меди (II) с серной кислотой при нагревании; е) разложение перманганата калия; ж) взаимодействие разбавленных кислот с металлами; з) разложение пероксида водорода; и) электролиз воды.
Лабораторные опыты. 3. Сравнение скорости испарения воды и спирта по исчезновению их капель на фильтровальной бумаге. 4. Окисление меди в пламени спиртовки или горелки. 5. Помутнение известковой воды от выдыхаемого углекислого газа. 6. Получение углекислого газа взаимодействием соды и кислоты. 7. Замещение меди в растворе хлорида меди (II) железом.
Тема 5
Практикум № 1
Простейшие операции с веществом (5/6 ч)
1. Правила техники безопасности при работе в химическом кабинете. Приемы обращения с лабораторным оборудованием и нагревательными приборами. 2. Наблюдения за изменениями, происходящими с горящей свечой, и их описание.
3. Анализ почвы и воды. 4. Признаки химических реакций. 5. Приготовление раствора сахара и определение массовой доли его в растворе.
Тема 6
Растворение. Растворы.
Свойства растворов электролитов (18/26 ч)
Растворение как физико-химический процесс. Понятие о гидратах и кристаллогидратах. Растворимость. Кривые растворимости как модель зависимости растворимости твердых веществ от температуры. Насыщенные, ненасыщенные и пересыщенные растворы. Значение растворов для природы и сельского хозяйства.
Понятие об электролитической диссоциации. Электролиты и неэлектролиты. Механизм диссоциации электролитов с различным типом химической связи. Степень электролитической диссоциации. Сильные и слабые электролиты.
Основные положения теории электролитической диссоциации. Ионные уравнения реакций. Условия протекания реакции обмена между электролитами до конца в свете ионных представлений.
Классификация ионов и их свойства.
Кислоты, их классификация. Диссоциация кислот и их свойства в свете теории электролитической диссоциации. Молекулярные и ионные уравнения реакций кислот. Взаимодействие кислот с металлами. Электрохимический ряд напряжений металлов. Взаимодействие кислот с оксидами металлов. Взаимодействие кислот с основаниями - реакция нейтрализации. Взаимодействие кислот с солями. Использование таблицы растворимости для характеристики химических свойств кислот.
Основания, их классификация. Диссоциация оснований и их свойства в свете теории электролитической диссоциации. Взаимодействие оснований с кислотами, кислотными оксидами и солями. Использование таблицы растворимости для характеристики химических свойств оснований. Разложение нерастворимых оснований при нагревании.
Соли, их классификация и диссоциация различных типов солей. Свойства солей в свете теории электролитической диссоциации. Взаимодействие солей с металлами, условия протекания этих реакций. Взаимодействие солей с кислотами, основаниями и солями. Использование таблицы растворимости для характеристики химических свойств солей.
Обобщение сведений об оксидах, их классификации и химических свойствах.
Генетические ряды металлов и неметаллов. Генетическая связь между классами неорганических веществ.
Окислительно-восстановительные реакции. Окислитель и восстановитель, окисление и восстановление.
Реакции ионного обмена и окислительно-восстановительные реакции. Составление уравнений окислительно-восстановительных реакций методом электронного баланса.
Свойства простых веществ - металлов и неметаллов, кислот и солей в свете представлений об окислительно-восстановительных процессах.
Демонстрации. Испытание веществ и их растворов на электропроводность. Движение окрашенных ионов в электрическом поле. Зависимость электропроводности уксусной кислоты от концентрации. Взаимодействие цинка с серой, соляной кислотой, хлоридом меди (II). Горение магния. Взаимодействие хлорной и сероводородной воды.
Лабораторные опыты. 8. Реакции, характерные для растворов кислот (соляной или серной). 9. Реакции, характерные для растворов щелочей (гидроксидов натрия или калия). 10. Получение и свойства нерастворимого основания, например гидроксида меди (II). 11. Реакции, характерные для растворов солей (например, для хлорида меди (II)). 12. Реакции, характерные для основных оксидов (например, для оксида кальция). 13. Реакции, характерные для кислотных оксидов (например, для углекислого газа).
Тема 7
Практикум №2
Свойства растворов электролитов (2/4 ч)1
6. Ионные реакции. 7. Условия протекания химических реакций между растворами электролитов до конца. 8. Свойства кислот, оснований, оксидов и солей. 9. Решение экспериментальных задач.
________
1. При 2 ч в неделю проводятся только практические работы 8 и 9.
Тема 8
Портретная галерея великих химиков (-/6 ч)
Повторение материала 8 класса — основных понятий, законов и теорий через знакомство с жизнью и деятельностью ученых, осуществивших их открытие.
Тема 9
Учебные экскурсии (-/4 ч)
Агрохимлаборатория, аптеки, местное производство.
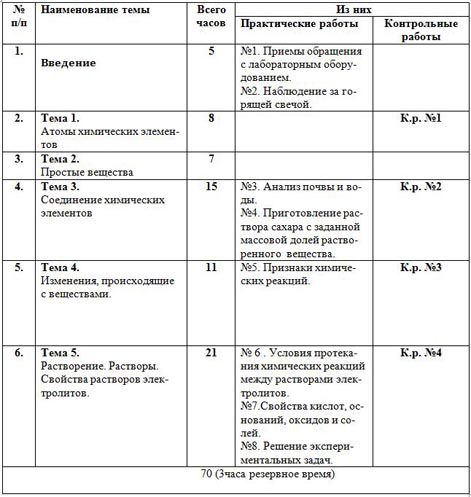
Тематическое планирование по химии, 8 класс,
(2 часа в неделю, всего 70 часов, из них 2 часа – резервное время)
УМК О.С. Габриеляна.
| № п/п | Наименование темы | Всего часов | Из них |
| Практические работы | Контрольные работы |
| 1. | Введение | 5 | №1. Приемы обращения с лабораторным оборудованием. №2. Наблюдение за горящей свечой. |
|
| 2. | Тема 1. Атомы химических элементов | 8 |
| К.р. №1 |
| 3. | Тема 2. Простые вещества | 7 |
|
|
| 4. | Тема 3. Соединение химических элементов | 15 | №3. Анализ почвы и воды. №4. Приготовление раствора сахара с заданной массовой долей растворенного вещества. | К.р. №2 |
| 5. | Тема 4. Изменения, происходящие с веществами. | 11 | №5. Признаки химических реакций.
| К.р. №3 |
| 6. | Тема 5. Растворение. Растворы. Свойства растворов электролитов. | 21 | № 6 . Условия протекания химических реакций между растворами электролитов. №7.Свойства кислот, оснований, оксидов и солей. №8. Решение экспериментальных задач. | К.р. №4 |
| 70 (3часа резервное время) |
Календарно-тематическое планирование 8 класс
| №№ п/п | Дата |
Тема урока | Характеристика деятельности учащихся | Практическая часть | Планируемые результаты |
| Введение |
| 1. |
| Предмет химии. Вещества. Вводный инструктаж по технике безопасности. | Различать предметы изучения естественных наук. Наблюдать свойства веществ и их изменения в ходе химических реакций. Разделять смеси методами отстаивания, фильтрования и выпаривания. Изучить строение пламени исследовательским способом, выдвигая гипотезы и проверяя их экспериментально. Проводить химические опыты с нагреванием. Познавательная деятельность Использование элементов причинно-следственного и структурно-функционального анализа. Исследование несложных реальных связей и зависимостей. Фронтальная, индивидуальная. Работа в тетради, у доски. Рефлексивная деятельность Объективное оценивание своих учебных достижений. Фронтальная , индивидуальная. Работа в тетради, у доски. | Д. Коллекции изделий из алюминия и стекла. | Знать/понимать. -химические понятия: атом, химический элемент, вещество. Уметь -определять: - простые и сложные вещества. |
| 2. |
| Превращения веществ. Роль химии в жизни человека. ХКК ГОС «Роль химии и химических веществ в жизни края». | Д. 1.Взаимодействие соляной кислоты с мрамором. 2.Помутнение «известковой воды». | Знать/понимать -химические понятия: химическая реакция, основные законы химии (закон сохранения массы веществ).
|
| 3. |
| Периодическая система химических элементов Д.И. Менделеева. Знаки химических элементов |
| Уметь -называть: химические элементы по их символу, периоды большие и малые, группы и подгруппы (главные и побочные). |
| 4. | | Химические формулы. Относительная атомная и молекулярная масса |
| Знать/понимать -химические понятия: относительная атомная и молекулярная масса, химическая формула Уметь -определять: качественный и количественный состав вещества по химической формуле -вычислять: относительную молекулярную массу вещества; массовую долю химического элемента по формуле соединения |
| 5 |
| Практические работы: №1. Приемы обращения с лабораторным оборудованием. №2 Наблюдение за горящей свечой. |
| Уметь -обращаться с химической посудой и лабораторным оборудованием.
|
| Тема 1. Атомы химических элементов |
| 6 |
| Основные сведения о строении атомов. Состав атомов. | Различать понятия «молекула», «атом», «химический элемент». Изображать схемы строения атомов 1-3 периодов Периодической системы. Определять понятия «ковалентная связь», «инонная связь», «металлическая связь». | Д. Модели атомов химических элементов. |
|
| 7-8 | | Периодическая система химических элементов Д.И. Менделеева Строение электронных оболочек атомов | Д. Периодическая система химических элементов Д. И. Менделеева |
|
| 9 |
| Ионы. Ионная химическая связь. | Д. Модели кристаллической решетки хлорида натрия. |
|
|
10 |
| Ковалентная связь. | Д. Модели кристаллических решеток алмаза и графита. |
|
| 11 |
| Металлическая химическая связь. |
|
|
|
12 |
| Обобщение и систематизация знаний по темам 1 и 2. |
|
|
| 13 |
| Контрольная работа №1 |
|
|
| Тема 2. Простые вещества |
|
|
14 |
| Простые вещества -металлы. ХКК ГОС «Металлы, металлопроизводство в крае» | Исследовать свойства изучаемых веществ. Проводить расчеты по химическим формулам с использованием молярной массы и молярного объема газа. Познавательная деятельность Использование элементов причинно-следственного и структурно-функционального анализа. Исследование несложных реальных связей и зависимостей. Фронтальная Самостоятельная работа.
| Д. Коллекция металлов. | Уметь: -характеризовать: связь между строением и свойствами металлов -использовать приобретенные знания для критической оценки информации о металлах, используемых в быту |
|
| 15 |
| Простые вещества -неметаллы. | Д. Коллекция неметаллов. | Уметь -характеризовать: положение неметаллов в периодической системе; строение атомов неметаллов. |
|
| 16-17 |
| Количество вещества | Д. Некоторые металлы и неметаллы количеством вещества 1 моль. | Знать/понимать -химические понятия: моль, молярная масса Уметь - вычислять: молярную массу, количество вещества. |
|
| 18-19 |
| Молярный объем газов. |
| Знать/понимать - химическое понятие: молярный объем Уметь - вычислять: по количеству (массе) газообразного вещества его объем, по объему газообразного вещества его количество (массу). |
|
| 20 |
| Обобщение и систематизация знаний по теме «Простые вещества». |
|
|
|
| Тема 3. Соединение химических элементов |
|
|
21 |
| Степень окисления | Исследовать свойства изучаемых веществ, определять степень окисления в бинарных соединениях, основаниях, кислотах и солях. Составлять формулы оксидов, оснований, кислот и солей с использование понятия «степень окисления». Делать выводы из результатов проведенных химических экспериментов. Моделировать строение веществ с кристаллическими решетками. Характеризовать связь между составом, строением и свойствами веществ. Готовить на практике растворы с заданной массовой долей растворенного вещества. Работа с таблицами, с коллекциями. Определять массовую долю химического элемента по формуле соединения, количество вещества, объем или массу вещества по его количеству. Познавательная деятельность Использование элементов причинно-следственного и структурно-функционального анализа. Исследование несложных реальных связей и зависимостей. Рефлексивная деятельность Умение формулировать свои мировоззренческие взгляды Использование мультимедийных ресурсов и компьютерных технологий для обработки и систематизации информации. Работа в парах. Доклады, рефераты | Д. Образцы оксидов, хлоридов, сульфидов. | Уметь - называть: бинарные соединения по их химическим формулам -определять: степень окисления элементов в соединениях. |
|
|
22 |
| Важнейшие классы бинарных соединений. ХКК ГОС «Природные бинарные соединения края» | Д. Образцы оксидов. Растворы хлороводорода и аммиака. | Знать/понимать химическое понятие: оксиды Уметь - называть: оксиды по их формулам - определять: степень окисления элементов в оксидах - составлять: формулы оксидов. |
|
|
23 |
| Основания. | Д. Образцы щелочей и нерастворимых оснований. Изменение окраски индикаторов в щелочной среде. | Знать/понимать –химические понятия: основания, щелочи. Уметь -называть: основания по их формулам -составлять: химические формулы оснований - определять: основания по их формулам.
|
|
|
24 |
| Кислоты. ХКК ГОС «Сернокислотное производство края» | Д. Образцы кислот. Изменение окраски индикаторов в кислой среде. | Знать/понимать -химические понятие: кислота, щелочь. Уметь - называть: кислоты по их формулам -составлять: химические формулы кислот - определять: кислоты по их формулам.
|
|
| 25-26 |
| Соли. ХКК ГОС «Природные соли края» | Д. Образцы солей. | Знать/понимать -химическое понятие: соль Уметь - называть: соли по их формулам -составлять: химические формулы солей - определять: соли по их формулам.
|
|
| 27 |
| Обобщение и систематизация знаний по теме «Соединения химических элементов» |
| Знать/понимать - химическое понятие: классификация веществ Уметь - вычислять: массовую долю химического элемента по формуле соединения, количество вещества, объем или массу вещества по его количеству. |
|
| 28 |
| Аморфные и кристаллические вещества. Кристаллические решетки. | Д. Модели кристаллических решеток. | Знать/понимать -закон постоянства состава веществ Уметь -характеризовать: связь между составом, строением и свойствами веществ. |
|
| 29 |
| Чистые вещества и смеси. ХКК ГОС «Чистые вещества и смеси, получаемые в крае» | Д. Образцы смесей. Л.2. Разделение смеси речного песка и поваренной соли. | Уметь. - обращаться с химической посудой и лабораторным оборудованием.
|
|
| 30 |
| Практическая работа №3. Анализ почвы и воды. ХКК ГОС «Анализ амурской воды» |
| Уметь - обращаться с химической посудой и лабораторным оборудованием. - использовать приобретенные знания для критической оценки информации о воде. |
|
| 31-32 |
| Массовая доля компонентов и смеси. |
| Уметь - вычислять: массовую долю вещества в растворе. |
|
| 33 |
| Практическая работа №4. Приготовление раствора сахара с заданной массовой долей растворенного вещества. |
| Уметь -Использовать приобретенные знания для приготовления растворов заданной концентрации. |
|
| 34 |
| Обобщение и систематизация знаний по теме 2 и 3. |
|
|
|
| 35 |
| Контрольная работа №2.по темам 2 и 3. |
|
|
|
|
| Тема 4. Изменения, происходящие с веществами. |
|
| 36-37 |
| Явления физические и химические. Химические реакции. ХКК ГОС « Применение физических и химических явлений в производстве края» | Наблюдать и описывать химические реакции с помощью естественного языка и языка химии. Проводить наблюдения за химическими реакциями, описывать их с помощью химических уравнений, производить расчеты по химическим уравнениям, определять тип химических реакций по числу вступивших в реакцию веществ и образованных веществ в ходе её. Познавательная деятельность Использование элементов причинно-следственного и структурно-функционального анализа. Исследование несложных реальных связей и зависимостей.
Фронтальная индивидуальная. Работа в парах. | Д.Горения магния Возгонка йода Плавление парафина Л. 4. Окисление меди в пламени спиртовки 5. Помутнение известковой воды
6. Получение углекислого газа. 7. Замещение меди в растворе хлорида меди (II) железом. | Знать/понимать -химические понятия: химическая реакция, классификация реакций (экзотермические и эндотермические реакции).
|
|
| 38 |
| Химические уравнения. |
| Знать/понимать -закон сохранения массы веществ Уметь - составлять: уравнения химических реакций. |
|
| 39-40 |
| Расчеты по химическим уравнениям. |
| Уметь - вычислять: количество вещества, массу или объем по количеству вещества, объему или массе реагентов или продуктов реакции. |
|
| 41-42 |
| Типы химических реакций.
| Д. Химические реакции различных типов. | Знать/понимать - химическое понятие: классификация реакций Уметь -определять: типы химических реакций по числу и составу исходных и полученных веществ. |
|
| 43 |
| Типы химических реакций на примере свойств воды. |
| Уметь - характеризовать: химические свойства воды -составлять: уравнения химических реакций характеризующих химические свойства воды и определять их тип. |
|
|
44 |
| Практическая работа №5. Признаки химических реакций. |
| Уметь - составлять: уравнения химических реакций -использовать: приобретенные знания для безопасного обращения с веществами. |
|
| 45 |
| Обобщение и систематизация знаний по теме 4.
|
|
|
|
|
| 46 |
| Контрольная работа №3. по теме 4. |
|
|
|
| Тема 5. Растворение. Растворы. Свойства растворов электролитов. |
|
| 47 |
| Растворение как физико – химический процесс. Типы растворов. | Проводить наблюдения за поведением веществ в растворах, за химическими реакциями, протекающими в растворах. Давать определения понятий «электролить». «неэлектролит», «электролитическая диссоциация». Конкретизировать понятие «ион», «катион», «анион», «окислитель», «восстановитель», «окислительно-восстановительные реакции». Исследовать свойства растворов электролитов. Характеризовать условия течения реакций в растворах электролитов до конца. Познавательная деятельность Умение самостоятельно организовать свою познавательную деятельность (от постановки цели до получения результатов). Исследование реальных связей и зависимостей. Организация и проведение учебно-исследовательской работы. Учебно-коммуникативная деятельность. Перевод информации из текста в таблицу, умение развернуто обосновывать суждения, приводить доказательства. Объяснение изученных положений на конкретных примерах. Фронтальная. Индивидуальная. Исследовательская
| Д. Растворение безводного сульфата меди (II) в воде. Л. Получение кристаллов солей (домашняя практическая работа). |
|
|
| 48-49 |
| Электролитическая диссоциация. ХКК ГОС «Электролиты, используемые в крае» | Д. Испытание веществ и их растворов на электропроводность. | Знать/понимать - химические понятия: электролит и неэлектролит, электролитическая диссоциация. |
|
| 50 |
| Ионные уравнения реакций | Д. Примеры реакции, идущие до конца. | Уметь - объяснять: сущность реакций ионного обмена - определять: возможность протекания реакций ионного обмена до конца. -составлять: полные и сокращенные ионные уравнения реакций обмена. |
|
| 51 |
| Практическая работа №7.Условия протекания химических реакций между растворами электролитов до конца. |
| Уметь - составлять: полные и сокращенные уравнения реакций обмена. Обращаться с химической посудой, растворами кислот и щелочей. |
|
| 52-53 |
| Кислоты, их классификация и свойства. | Л. 8. Реакции характерные для растворов кислот (соляной и серной) принадлежность веществ к классу кислот. | Уметь - называть кислоты - характеризовать: химические свойства кислот. - определять: возможность протекания типичных реакций кислот. |
|
| 54-55 |
| Основания, их классификация и свойства. | Л.9. реакции характерные для растворов щелочей Л.10. получение и свойства нерастворимого основания. | Уметь - называть основания: - характеризовать: химические свойства оснований. - определять: возможность протекания типичных реакций оснований. |
|
| 56-57 |
| Оксиды, их классификация и свойства | Л. 12. Реакции характерные для основных оксидов Л. 13. Реакции характерные для кислотных оксидов | Уметь - называть оксиды - определять: принадлежность веществ к классу оксидов -характеризовать: химические свойства оксидов. |
|
| 58-59 |
| Соли, их свойства. |
| Уметь - называть соли. - определять: принадлежность веществ к классу солей - характеризовать: химические свойства солей. |
|
| 60 |
| Генетическая связь между классами неорганических соединений |
| Уметь - характеризовать: химические свойства основных классов неорганических веществ - составлять: уравнения химических реакций, характеризующие свойства неорганических веществ. |
|
| 61 |
| Практическая работа №8. Свойства кислот оснований, оксидов и солей. | |
| Уметь. - обращаться с химической посудой и реактивами - распознавать опытным. путем растворы кислот и щелочей. - определять: возможность протекания реакций ионного обмена до конца. |
|
| 62 |
| Обобщение и систематизация знаний по теме 5. |
|
|
|
| 63 |
| Контрольная работа №4 По теме 5. |
|
|
|
| 64 |
| Анализ контрольной работы. |
|
|
|
| 65-66 |
| Окислительно-восстановительные реакции. ХКК ГОС «Окислительно-восстановительные процессы, используемые на производствах края» |
| Знать/понимать - химические понятия: окислитель и восстановитель, окисление и восстановление. - определять: степень окисления элемента в соединении, тип химической реакции по изменению степени окисления химических элементов. |
|
| 67 |
| Практическая работа №9. Решение экспериментальных задач. |
| Уметь - обращаться с химической посудой и реактивами. - характеризовать: химические свойства основных классов неорганических соединений. |
|
| 68-70 |
| Портретная галерея великих химиков. |
|
|
|
Требования к уровню подготовки учеников:
знать
химическую символику: знаки химических элементов, формулы химических веществ и уравнения химических реакций;
важнейшие химические понятия: атом, молекула, химическая связь, вещество и его агрегатные состояния, классификация веществ, химические реакции и их классификация, электролитическая диссоциация;
основные законы химии: сохранения массы веществ, постоянства состава, периодический закон;
уметь
называть: знаки химических элементов, соединения изученных классов, типы химических реакций;
объяснять: физический смысл атомного (порядкового) номера химического элемента, номеров группы и периода, к которым он принадлежит в периодической системе Д.И. Менделеева; закономерности изменения свойств элементов в пределах малых периодов и главных подгрупп; причины многообразия веществ; сущность реакций ионного обмена;
характеризовать: химические элементы (от водорода до кальция) на основе их положения в периодической системе Д.И. Менделеева и особенностей строения их атомов; связь между составом, строением и свойствами веществ; общие свойства неорганических и органических веществ;
определять: состав веществ по их формулам; принадлежность веществ к определенному классу соединений; валентность и степень окисления элементов в соединениях;
составлять: формулы оксидов, водородных соединений неметаллов, гидроксидов, солей; схемы строения атомов первых двадцати элементов периодической системы; уравнения химических реакций;
обращаться с химической посудой и лабораторным оборудованием;
распознавать опытным путем: кислород, водород, углекислый газ, аммиак; растворы кислот и щелочей, хлорид-, сульфат-, карбонат-ионы, ионы аммония;
вычислять: массовую долю химического элемента по формуле соединения; массовую долю растворенного вещества в растворе; количество вещества, объем или массу по количеству вещества, объему или массе реагентов или продуктов реакции;
использовать приобретенные знания и умения в практической деятельности и повседневной жизни для:
безопасного обращения с веществами и материалами;
экологически грамотного поведения в окружающей среде, школьной лаборатории и в быту.
Учебно-методическое обеспечение:
Учебно-методический комплект
Примерная программа основного общего образования по химии (базовый уровень);
Авторская программа О.С.Габриеляна, соответствующая Федеральному компоненту Государственного стандарта общего образования и допущенная Министерством образования и науки Российской Федерации (О.С.Габриелян Программа курса химии для 8-11 классов общеобразовательных учреждений / О.С.Габриелян. – 7-е издание, переработанное и дополненное – М.: Дрофа, 2010г.).
Габриелян О. С., Остроумов И. Г. Настольная книга учителя. Химия. 8 к л.: Методическое пособие. — М.: Дрофа, 2007г
Химия. 8 к л.: Контрольные и проверочные работы к учебнику О. С. Габриеляна «Химия. 8 / О. С. Габриелян, П. Н. Березкин, А. А. Ушакова и др. — М.: Дрофа, 2009г.
Габриелян О. С., Остроумов И. Г. Изучаем химию в 8 к л.: Дидактические материалы. — М.: Блик плюс, 2009г.
Габриелян О. С., Яшукова А. В. Рабочая тетрадь. 8 к л. К учебнику О. С. Габриеляна «Химия. 9». — М.: Дрофа, 2010г.
Габриелян О. С., Воскобойникова Н. П. Химия в тестах, задачах, упражнениях. 8— 9 кл. — М.: Дрофа, 2009г.
Литература для учителя:
Программа О.С.Габриеляна «Программа курса химии для 8-11 классов общеобразовательных школ», М.: «Дрофа», 2010г
О.С.Габриелян «Примерное тематическое планирование уроков химии», 2006г
О.С.Габриелян «Настольная книга учителя химии», М., «Блик и К», 2007г
Литература для учащихся:
О.С.Габриелян «Химия, 8 класс», М., 2009 г
О.С.Габриелян «Мы изучаем химию, 8 класс», М., 2009г
Дополнительная литература:
Энциклопедический словарь юного химика.
Дидактический материал.
Медиаресурсы:
Единые образовательные ресурсы с сайта www. school-coolection.edu.ru
(единой коллекции образовательных ресурсов)
CD «Неорганическая химия», издательство «Учитель»
CD «Органическая химия», издательство «Учитель»
CD «Общая химия», издательство «Учитель»
CD «Химия элементов», издательство «Учитель»
CD Самоучитель «Химия для всех» (8-11 класс)
CD «Химия в школе. Минеральные вещества», электронные тесты.
CD «Химия 8 класс», электронное учебное издание Дрофа, мультимедийное приложение к УМК «Химия 8 класс»
CD «Тренажер по химии, тесты для подготовки к экзаменам», 2 шт.
Материально-техническое и информационно-техническое обеспечение:
Специализированный класс химии (лаборантская, вытяжной шкаф, интерактивная доска).
Стенды:
-«Периодическая система Д.И. Менделеева»
-«Таблица растворимости»
-«Классификация неорганических веществ»
-«Великие ученые-химики»
-«Индикаторы»
-«Техника безопасности»
-Набор портретов ученых-химиков
3. Химическое оборудование и реактивы.
4. Противопожарная сигнализация.
5. Интерактивное оборудование, интернет ресурсы и CD диски.
8

 Получите свидетельство
Получите свидетельство Вход
Вход











 Рабочая программа по химии (8 класс) (0.22 MB)
Рабочая программа по химии (8 класс) (0.22 MB)
 0
0 578
578 5
5 Нравится
0
Нравится
0


