«Рассмотрено» «Согласовано» «Утверждено»
Руководитель НМС заместитель директора по УВР директор
________/ Мартышкина И.В / МБОУ «Лицей №4» МБОУ «Лицей №4»
Протокол №____ от __________/_Старостина Н.Н. ___________/Дуденкова Т.В.
«_____» августа 2013г. «_____» августа 20__г приказ № ___
от «___» августа 2013г
РАБОЧАЯ ПРОГРАММА
ХИМИЯ
Основная ступень, базовый уровень
Баймашкина Татьяна Александровна, высшая квалификационная категория
Муниципальное бюджетное общеобразовательное учреждение
«Лицей №4»
Рузаевского муниципального района Республики Мордовия
Класс: 8 «М» КЛАСС
на 2013-2014 учебный год
Составлена на основе: Рабочая программа составлена на основе Примерной программы основного общего образования по химии,
Москва, Просвещение, 2010
Учебник: Г.Е. Рудзитис, Ф.Г. Фельдман «Химия -8»
ПОЯСНИТЕЛЬНАЯ ЗАПИСКА
Статус документа
Программа по химии составлена на основе федерального компонента государственного стандарта основного общего образования.
Программа конкретизирует содержание стандарта, дает примерное распределение учебных часов по разделам курса и рекомендуемую последовательность изучения тем и разделов с учетом межпредметных и внутрипредметных связей, логики учебного процесса, возрастных особенностей учащихся. В программе определен перечень демонстраций, лабораторных опытов, практических занятий и расчетных задач.
Программа выполняет две основные функции:
Информационно-методическая функция позволяет всем участникам образовательного процесса получить представление о целях, содержании, общей стратегии обучения, воспитания и развития учащихся средствами данного учебного предмета.
Организационно-планирующая функция предусматривает выделение этапов обучения, структурирование учебного материала, определение его количественных и качественных характеристик на каждом из этапов, в том числе для содержательного наполнения промежуточной аттестации учащихся.
Программа является ориентиром для составления авторских учебных программ и учебников. Программа определяет инвариантную (обязательную) часть учебного курса химии в основной школе, за пределами которого остается возможность авторского выбора вариативной составляющей содержания образования. При этом авторы учебных программ и учебников химии могут предложить собственный подход в части структурирования и определения последовательности изучения учебного материала, а также путей формирования системы знаний, умений и способов деятельности, развития и социализации учащихся. Тем самым программа содействует сохранению единого образовательного пространства и предоставляет широкие возможности для реализации различных подходов к построению курса химии в основной школе.
Структура документа
Программа включает три раздела: пояснительную записку; основное содержание с примерным (в модальности «не менее») распределением учебных часов по разделам курса и возможную последовательность изучения тем и разделов; требования к уровню подготовки выпускников основной школы по химии. В программе представлено минимальное по объему, но функционально полное содержание.
Общая характеристика учебного предмета
Основными проблемами химии являются изучение состава и строения веществ, зависимости их свойств от строения, конструирование веществ с заданными свойствами, исследование закономерностей химических превращений и путей управления ими в целях получения веществ, материалов, энергии. Поэтому, как бы ни различались авторские программы и учебники по глубине трактовки изучаемых вопросов, их учебное содержание должно базироваться на содержании примерной программы, которое структурировано по шести блокам: методы познания веществ и химических явлений. Экспериментальные основы химии; вещество; химическая реакция; элементарные основы неорганической химии; первоначальные представления об органических веществах; химия и жизнь. Содержание этих учебных блоков в авторских программах может структурироваться по темам и детализироваться с учетом авторских концепций, но должно быть направлено на достижение целей химического образования.
Цели
Изучение химии в основной школе направлено на достижение следующих целей:
освоение важнейших знаний об основных понятиях и законах химии, химической символике;
овладение умениями наблюдать химические явления, проводить химический эксперимент, производить расчеты на основе химических формул веществ и уравнений химических реакций;
развитие познавательных интересов и интеллектуальных способностей в процессе проведения химического эксперимента, самостоятельного приобретения знаний в соответствии с возникающими жизненными потребностями;
воспитание отношения к химии как к одному из фундаментальных компонентов естествознания и элементу общечеловеческой культуры;
применение полученных знаний и умений для безопасного использования веществ и материалов в быту, сельском хозяйстве и на производстве, решения практических задач в повседневной жизни, предупреждения явлений, наносящих вред здоровью человека и окружающей среде.
Место предмета в базисном учебном плане
Для обязательного изучения учебного предмета «Химия» на этапе основного общего образования федеральный базисный учебный план для образовательных учреждений Российской Федерации отводит 140 часов. В том числе по 70 часов в VIII и IX классах, из расчета – 2 учебных часа в неделю.
Программа рассчитана на 70 учебных часов. Данная рабочая программа составлена на основе программы общеобразовательных учреждений по химии для 8-11 классов и скорректирована на основе многолетнего опыта работы учителя, поэтому внесены некоторые изменения:
глава I «Первоначальные химические понятия» - лабораторная работа№3 «примеры физических и химических явлений», а по учебнику данная работа представляет собой две отдельные лабораторные работы №3,4; лабораторная работа №4 «разложение малахита и реакция замещения», а по учебнику данная работа представляет собой две отдельные лабораторные работы №6,7; учебник предлагает лабораторную работу «ознакомление с образцами простых и сложных веществ, минералов и горных пород», а программа предусматривает эту работу в виде демонстрационного опыта.
глава V «Основные классы неорганических соединений» - по учебнику по теме «свойства кислот» предлагается 7 лабораторных работ, а в моей программе эти же свойства рассматриваются в двух лабораторных работах.
Глава VII «Строение веществ. Химическая связь» - учебник предлагает лабораторную работу «составление моделей молекул и кристаллов веществ с различным видом химических связей», а программа предусматривает эту работу в виде демонстрационного опыта.
Общеучебные умения, навыки и способы деятельности
Программа предусматривает формирование у учащихся общеучебных умений и навыков, универсальных способов деятельности и ключевых компетенций. В этом направлении приоритетами для учебного предмета «Химия» на ступени основного общего образования являются: использование для познания окружающего мира различных методов (наблюдения, измерения, опыты, эксперимент); проведение практических и лабораторных работ, несложных экспериментов и описание их результатов; использование для решения познавательных задач различных источников информации; соблюдение норм и правил поведения в химических лабораториях, в окружающей среде, а также правил здорового образа жизни.
Результаты обучения
Результаты изучения курса «Химия» приведены в разделе «Требования к уровню подготовки выпускников», который полностью соответствует стандарту. Требования направлены на реализацию деятельностного, практикоориентированного и личностно ориентированного подходов; освоение учащимися интеллектуальной и практической деятельности; овладение знаниями и умениями, востребованными в повседневной жизни, позволяющими ориентироваться в окружающем мире, значимыми для сохранения окружающей среды и собственного здоровья.
Рубрика «Знать/понимать» включает требования к учебному материалу, который усваивается и воспроизводится учащимися.
Рубрика «Уметь» включает требования, основанные на более сложных видах деятельности, в том числе творческой: объяснять, характеризовать, определять, составлять, распознавать опытным путем, вычислять.
В рубрике «Использовать приобретенные знания и умения в практической деятельности и повседневной жизни» представлены требования, выходящие за рамки учебного процесса и нацеленные на решение разнообразных жизненных задач.
ТРЕБОВАНИЯ К УРОВНЮ ПОДГОТОВКИ УЧАЩИХСЯ ОСНОВНОЙ ОБЩЕОБРАЗОВАТЕЛЬНОЙ ШКОЛЫ
В результате изучения химии ученик должен
знать / понимать
химическую символику: знаки химических элементов, формулы химических веществ и уравнения химических реакций;
важнейшие химические понятия: химический элемент, атом, молекула, относительные атомная и молекулярная массы, ион, химическая связь, вещество, классификация веществ, моль, молярная масса, молярный объем, химическая реакция, классификация реакций, электролит и неэлектролит, электролитическая диссоциация, окислитель и восстановитель, окисление и восстановление;
основные законы химии: сохранения массы веществ, постоянства состава, периодический закон;
уметь
называть: химические элементы, соединения изученных классов;
объяснять: физический смысл атомного (порядкового) номера химического элемента, номеров группы и периода, к которым элемент принадлежит в периодической системе Д.И. Менделеева; закономерности изменения свойств элементов в пределах малых периодов и главных подгрупп; сущность реакций ионного обмена;
характеризовать: химические элементы (от водорода до кальция) на основе их положения в периодической системе Д.И.Менделеева и особенностей строения их атомов; связь между составом, строением и свойствами веществ; химические свойства основных классов неорганических веществ;
определять: состав веществ по их формулам, принадлежность веществ к определенному классу соединений, типы химических реакций, валентность и степень окисления элемента в соединениях, тип химической связи в соединениях, возможность протекания реакций ионного обмена;
составлять: формулы неорганических соединений изученных классов; схемы строения атомов первых 20 элементов периодической системы Д.И.Менделеева; уравнения химических реакций;
обращаться с химической посудой и лабораторным оборудованием;
распознавать опытным путем: кислород, водород
вычислять: массовую долю химического элемента по формуле соединения; массовую долю вещества в растворе; количество вещества, объем или массу по количеству вещества, объему или массе реагентов или продуктов реакции;
использовать приобретенные знания и умения в практической деятельности и повседневной жизни для:
безопасного обращения с веществами и материалами;
экологически грамотного поведения в окружающей среде;
оценки влияния химического загрязнения окружающей среды на организм человека;
критической оценки информации о веществах, используемых в быту;
приготовления растворов заданной концентрации.
Учебно-методический комплект:
Рудзитис, Г.Е. Химия. 8 класс: учебник для общеобразовательных учреждений / Г.Е.Рудзитис, Ф.Г.Фельдман.- М.: Просвещение, 2013.
Радецкий, А.М. Проверочные работы по химии в 8-11 классах: пособие для учителя / А.М.Радецкий. – М.: Просвещение, 2013.
Примерная программа среднего (полного) общего образования по химии (базовый уровень). Химия: сборник материалов по реализации федерального компонента государственного стандарта общего образования в общеобразовательных учреждениях/ авт.-сост. Е.И.Колусева, В.Е.Морозов.- Волгоград: Учитель, 2006. – 72с.
Дополнительная литература:
Брейгер, Л.М. Нестандартные уроки. Химия. 8, 10, 11 классы / Л.М.Брейгер.- Волгоград: Учитель, 2007.
Ерёмин, В.В. Сборник задач и упражнений по химии: школьный курс / В.В.Ерёмин, - М.:ООО «Издательский дом «Оникс 21 век»; ООО»Издательство «Мир и Образование», 2005.
Шукайло, А.Д. Тематические игры по химии: методическое пособие для учителей / А.Д.Шукайло. – М.: Творческий центр «Сфера», 2003.
Химия в школе: науч.-метод. Журн. –М.:Центрхимпресс, 2007-2010.
Брейгер, Л.М. Методическое пособие для учащихся 8 класса (ответы на экзаменационные вопросы) / Л.М.Брейгер. –Волгоград:Учитель, 2002.
Кушнарёв,А.А. Экспресс-курс по неорганической химии с примерами, задачами, реакциями. 8-9 классы /А.А.Кушнарёв. –М.:Школьная пресса, 2002.
Савин, Г.А. Олимпиадные задания по неорганической химии. 8-9классы / Г.А.Савин. – Волгоград: Учитель, 2003.
Кузьменко, Н.Е. Тесты по химии. 8-11 классы: учебное пособие / Н.Е. Кузьменко, В.В.Ерёмин. – М.:Экзамен, 2006.
MULTIMEDIA – поддержка предмета
Библиотека электронных наглядных пособий. Химия 8-11 классы. – ГУ РЦ ЭМТО «Кирилл и Мефодий», 2003
Дидактический и раздаточный материал. Карточки. 8-9 классы. – Волгоград: Издательство «Учитель», 2012
Интерактивный учебно-методический образовательный комплекс. Химия, 8-9 классы.
Мультимедийное учебное пособие нового образца. Химия, 8 класс – М.: Просвещение, 2004.
Образовательная коллекция. «Химия для всех-XXI. Решение задач» - ЗАО «1С», 2004
CD-ROM «Химия для гуманитариев. Элективный курс» - Волгоград: Издательство «Учитель», 2012
Учебное электронное издание. Химия (8-11 классы). Виртуальная лаборатория. – Лаборатория систем мультимедиа, МарГТУ, 2004
http://files.school-collection.edu.ru
http://festival.1september.ru
При оформлении рабочей программы были использованы следующие условные обозначения:
-- урок изучения новых знаний УИНЗ
-- урок закрепления знаний УЗЗ
-- урок обобщения и систематизации знаний УОИСЗ
-- урок контроля УК
-- комбинированный урок КУ
-- дидактические материалы ДМ
-- упражнение упр.
-- страница с.
-- Периодическая система химических
элементов Д.И.Менделеева ПС
--практическая работа п/р
-- контрольная работа к/р
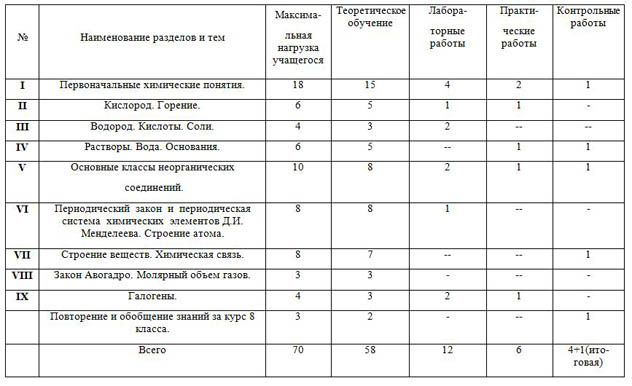
Тематическое планирование по дисциплине_____Химия________________
| № | Наименование разделов и тем | Максима- льная нагрузка учащегося |
|
| Теоретическое обучение | Лабора- торные работы
| Практи- ческие работы | Контрольные работы |
| I | Первоначальные химические понятия. | 18 | 15 | 4 | 2 | 1 |
| II | Кислород. Горение. | 6 | 5 | 1 | 1 | - |
| III | Водород. Кислоты. Соли. | 4 | 3 | 2 | -- | -- |
| IV | Растворы. Вода. Основания. | 6 | 5 | -- | 1 | 1 |
| V | Основные классы неорганических соединений. | 10 | 8 | 2 | 1 | 1 |
| VI | Периодический закон и периодическая система химических элементов Д.И. Менделеева. Строение атома. | 8 | 8 | 1 | -- | - |
| VII | Строение веществ. Химическая связь. | 8 | 7 | -- | -- | 1 |
| VIII | Закон Авогадро. Молярный объем газов. | 3 | 3 | - | -- | - |
| IX | Галогены. | 4 | 3 | 2 | 1 | - |
|
| Повторение и обобщение знаний за курс 8 класса. | 3 | 2 | - | -- | 1 |
|
| Всего | 70 | 58 | 12 | 6 | 4+1(ито-говая) |
Лабораторные работы 8 класс.
№1. Рассмотрение веществ с различными физическими и химическими свойствами.
№2. Разделение смеси с помощью магнита.
№3. Примеры химических и физических явлений.
№4. Разложение малахита, реакция замещения.
№5. Ознакомление с образцами оксидов.
№6. Получение водорода и изучение его свойств.
№7. Взаимодействие водорода с оксидом меди 2.
№8. химические свойства кислот.
№9. Химические свойства оснований.
№10. Амфотерность гидроксида цинка.
№11. Реакции, характерные для соляной кислоты.
№12. Вытеснение галогенов друг другом из растворов их соединений, распознавание галогенидов.
Практические работы 8 класс.
Правила техники безопасности при работе в химическом кабинете. Приёмы обращения с лабораторным штативом и спиртовкой. Знакомство с химической посудой. Изучение строения пламени.
Очистка загрязненной поваренной соли.
Получение и свойства кислорода.
Приготовление растворов солей с определённой массовой долей растворённого вещества.
Решение экспериментальных задач по теме «Важнейшие классы неорганических веществ».
Получение соляной кислоты и её свойства
Минимальные требования к оснащению
для реализации практической части программы
| Тема практической работы | Лабораторное оборудование |
| Правила ТБ при работе в химическом кабинете. Приемы обращения с лабораторным штативом, со спиртовкой, электронагревателем; изучение строения пламени. | Инструкция по технике безопасности, штатив с лапкой и кольцом, пробиркодержатель, асбестовая сетка, пробирка, химический стакан, фарфоровая чашка, спиртовка (или электронагреватель), лучина, спички. |
| Очистка загрязненной поваренной соли
| Смесь соли с песком, химический стакан, 20-30 мл воды, стеклянная палочка, фильтр, фильтровальная воронка, фарфоровая чашка, спиртовка (или электронагреватель), спички, штатив с кольцом. |
| Получение и свойства кислорода. | Штатив, пробирка с пробкой и газоотводной трубкой, пероксид водорода, оксид марганца (IV), лучинка, 2 пробирки для собирания кислорода, кристаллизатор с водой, уголек, кусочек серы, 2 ложечки для сжигания веществ. |
| Приготовление раствора с заданной массовой долей растворенного вещества | Поваренная соль, весы, колба коническая, стеклянная палочка, воронка фильтровальная, мерный цилиндр. |
| Решение экспериментальных задач по теме «Важнейшие классы неорганических соединений». | Пробирки, спиртовка, пробиркодержатель, растворы хлорида натрия, гидроксида натрия, соляной кислоты, магниевая стружка, раствор хлорида меди (II). |
| Получение соляной кислоты и опыты с ней. | Пробирка с пробкой и газоотводной трубкой, пробирка с водой, поваренная соль, концентрированная серная кислота, спиртовка. 6 пробирок с раствором соляной кислоты, лакмусовая бумажка, гранула цинка, кусочек меди, оксид меди (II), свежеприготовленный гидроксид меди (II), карбонат кальция (мел), спиртовка, пробиркодержатель. 3 пробирки, по 1-2 мл растворов соляной кислоты, хлорида натрия, хлорида кальция, раствор нитрата серебра (I), концентрированная азотная кислота, пипетки. |
Содержание учебной дисциплины
70 ч/год (2 ч/неделю)
В курсе 8 класса учащиеся знакомятся с первоначальными химическими понятиями: химический элемент, атом, молекула, простые и сложные вещества, физические и химические явления, валентность; закладываются простейшие навыки в написании знаков химических элементов, химических формул простых и сложных веществ, составлении несложных уравнений химических реакций; даются понятия о некоторых химических законах: атомно-молекулярном учении, законе постоянства состава, законе сохранения массы вещества; на примере кислорода и водорода углубляются сведения об элементе и веществе. Учащиеся изучают классификацию простых и сложных веществ, свойства воды, оксидов, кислот, оснований, солей; закрепляют практические навыки, необходимые при выполнении практических и лабораторных работ. Изучаются структура Периодической системы химических элементов Д.И. Менделеева, периодический закон, виды химической связи.
МЕТОДЫ ПОЗНАНИЯ ВЕЩЕСТВ И ХИМИЧЕСКИХ ЯВЛЕНИЙ.
ЭКСПЕРИМЕНТАЛЬНЫЕ ОСНОВЫ ХИМИИ.
Тема 1. Первоначальные химические понятия (18ч.).
Химия как часть естествознания. Химия – наука о веществах, их строении, свойствах и превращениях. Тела. Вещества. Свойства вещества. Чистые вещества и смеси .Физические и химические явления.
Атомы. Молекулы. Вещества молекулярного и немолекулярного строения. Химический элемент. Язык химии. Знаки химических элементов. Относительная атомная масса.
Простые и сложные вещества. Химические формулы простых и сложных веществ. Относительная молекулярная масса. Расчёты по формуле.
Валентность. Определение валентности по формуле. Составление формул по валентности (бинарные соединения). Атомно-молекулярное учение. Роль М.В.Ломоносова и Д.Дальтона в создании основ атомно-молекулярного учения.
Закон сохранения массы веществ. Химические уравнения. Типы химических реакций. Понятие о классификации химических реакций. Реакции соединения, разложения, замещения, обмена.
Количества вещества. Моль – единица количества вещества. Число Авогадро. Молярная масса.
Расчётные задачи. Вычисление молярной массы по формуле, вычисление массы и количества вещества.
Демонстрации.
Занимательные опыты, различные виды химической посуды, предметы, сделанные из различных веществ, приборы для измерения массы, плотности жидкости, температуры, твёрдости.
Однородные и неоднородные смеси, способы разделения смесей.
Физические и химические явления (растирание сахара в ступке, кипение воды, горение свечи, изменение цвета и выпадение осадка при взаимодействии различных веществ и др.)
Соединение железа с серой; фотографии молекул различных веществ, сделанные под электронным микроскопом).
Опыт, иллюстрирующий закон сохранения массы веществ.
Разложение малахита при нагревании, горение серы в кислороде и другие типы химических реакций.
Видеофильм «Химические элементы».
Видеофильм «Химия. 8 класс. Ч.1» («Первоначальные химические понятия»).
Компакт-диск 2Химия. 8 класс».
Компакт-диск «Вещества и их превращения».
Плакат «Количественные величины в химии».
Лабораторные опыты
Рассмотрение веществ с различными физическими и химическими свойствами;
Разделение смесей.
Примеры химических и физических явлений .
Разложение малахита, реакция замещения.
Практические занятия
Правила техники безопасности при работе в химическом кабинете. Приёмы обращения с лабораторным штативом и спиртовкой. Знакомство с химической посудой. Изучение строения пламени.
Очистка загрязненной поваренной соли.
Расчётные задачи.
Вычисление по химической формуле вещества: относительной молекулярной массы, отношения масс, массовых долей элементов.
Вычисление молярной массы вещества по формуле, массы и количества вещества.
Тема 2. Кислород. Оксиды. Горение. (6ч.).
Кислород как химический элемент и простое вещество. Физические и химические свойства. Получение и применение.
Окисление. Оксиды. Круговорот кислорода в природе. Понятие о катализаторе.
Воздух, его состав. Горение веществ в воздухе. Условия возникновения и прекращения горения, меры по предупреждению пожаров. Экзо- и эндотермические реакции. Закон сохранения массы и энергии. Охрана воздуха от загрязнений. Расчёты по химическим уравнениям.
Демонстрации.
Ознакомление с физическими свойствами кислорода.
Сжигание в кислороде угля, серы, фосфора, железа.
Разложение пероксида водорода в присутствии катализатора.
Получение кислорода из перманганата калия при разложении.
Количественное определение содержание кислорода в воздухе.
Опыты, выясняющие условия горения.
Ознакомление с различными видами топлива. (Коллекция «Топливо»).
Плакат «Количественные величины в химии».
Видеофильм «Химия. 8 класс. Ч.2» («Кислород. Водород».)
Лабораторные опыты
Ознакомление с образцами оксидов.
Практические занятия
Получение кислорода и его свойства.
Расчётные задачи.
Вычисления по химическим уравнениям массы или количества вещества одного из вступивших или получающихся в результате реакций веществ.
Тема 3.Водорд. Кислоты. Соли. (4ч.).
Водород как химический элемент и простое вещество. Физические и химические свойства. Водород – восстановитель. Получение водорода в лаборатории и в промышленности. Применение водорода как экологически чистого топлива и сырья для химической промышленности. Меры предосторожности при работе с водородом.
Кислоты. Нахождение в природе. Состав кислот. Валентность кислотных остатков. Общие свойства кислот (на примере соляной и серной): изменение окраски индикаторов, взаимодействии с металлами, оксидами металлов. Особые свойства соляной и серной кислот. Меры предосторожности при работе с кислотами. Понятие о вытеснительном ряде металлов.
Сои. Состав солей, их названия. Составление формул солей.
Демонстрации.
Ознакомление с физическими свойствами водорода.
Горение водорода в кислороде и в воздухе.
Взаимодействие водорода с оксидом меди.
Образцы кислот и солей.
Действие растворов кислот на индикаторы.
Видеофильм «Химия. 8 класс. Ч.2» («Кислород. Водород».)
Лабораторные опыты
Получение водорода и изучение его свойств.
2. Взаимодействие водорода с оксидом меди (II).
Расчётные задачи.
Решение различных типов задач.
Тема 4.Вода. Растворы. Основания. (6ч.).
Вода – растворитель. Растворы. Массовая доля растворённого вещества. Состав воды. Физические свойства воды. Химические свойства воды: взаимодействие с металлами (натрием, кальцием), с оксидами металлов 9оксид кальция), оксидами неметаллов (оксиды фосфора и углерода), разложение воды электрическим током.
Основания. Состав оснований. Щёлочи и нерастворимые основания. Физические свойства оснований. Химические свойства щелочей: действие индикаторов, взаимодействие с кислотами (реакция нейтрализации), с оксидами неметаллов. Меры предосторожности при работе со щелочами. Свойства нерастворимых оснований.
Демонстрации.
Взаимодействие воды с металлами (натрий, кальций).
Взаимодействие воды с оксидами кальция, фосфора. Определение полученных растворов индикатором.
Реакция нейтрализации.
Взаимодействие оксида углерода (IV) с раствором гидроксида кальция и твёрдым гидроксидом натрия.
Видеофильм «Химия. 8 класс. Ч.3» (Вода. Растворы. Основания.)
Практические занятия
Приготовление растворов солей с определённой массовой долей растворённого вещества.
Расчётные задачи.
Вычисление массовой доли и массы вещества в растворе.
Вычисление по химическим уравнениям массы по известному количеству вещества одногт и з вступивших или получающихся в реакции веществ.
Тема 5.Основные классы неорганических веществ. (10ч.).
Состав и строение оксидов, кислот, оснований, солей. Классификация, физические и химические свойства оксидов, кислот, оснований, солей. Способы получения и области применения оксидов, кислот, оснований, солей.
Генетическая связь между оксидами, кислотами, основаниями, солями.
Демонстрации.
Некоторые химические свойства оксидов, кислот, оснований, солей.
Плакат «Связь между классами неорганических веществ».
Лабораторные опыты
химические свойства кислот.
химические свойства оснований.
Практические занятия
Решение экспериментальных задач по теме «Важнейшие классы неорганических веществ».
Тема 6.Периодический закон и периодическая система химических элементов Д. И. Менделеева. Строение атома. (8ч.).
Классификация химических элементов. Химические элементы, оксиды и гидроксиды которых проявляют амфотерные свойства. Естественные семейства химических элементов: щелочные металлы, галогены, инертные газы. Периодический закон Д. И. Менделеева. Порядковый номер элемента. Состав атомных ядер. Изотопы. Строение электронных оболочек атомов.
Периодическая система химических элементов. Малые и большие периоды. Группы и подгруппы. Характеристика химических элементов главных подгрупп на основании положения в периодической системе и строении атомов.
Значение периодического закона. Жизнь и деятельность Д. И. Менделеева.
Демонстрации.
Взаимодействие натрия с водой; показ образцов щелочных металлов и галогенов.
Таблицы «Элементы и их свойства».
Таблица «Строение атома».
Таблица «Электронные оболочки атомов».
Видеофильм «М.В.Ломоносов, Д.И.Менделеев».
Лабораторные опыты
Взаимодействие гидроксида цинка с растворами кислот и щелочей.
Тема 7.Химическая связь. Строение вещества. (8ч.).
Понятие о химической связи и причины её образования. Электроотрицательность. Ковалентная полярная и неполярная связи. Ионная связь. Кристаллические решётки.
Степень окисления. Окислительно-восстановительные реакции. Окислитель. Восстановитель.
Демонстрации.
Модели пространственных решёток поваренной соли, графита, твёрдого оксида углерода (IV).
Видеофильм «Химия.8 класс.»
Компакт-диск «Химия. 8 класс.»
Тема 8.Галогены. (3ч.).
Положение галогенов в периодической системе элементов и строение их атомов. Хлор: нахождение в природе, физические, химические свойства, применение.
Хлороводород. Соляная кислота и ее соли. Сравнительная характеристика галогенов.
Демонстрации:
видеофильм «Химия. 8 класс»
Лабораторный опыты:
Реакции, характерные для соляной кислоты.
Вытеснение галогенов друг другом из растворов их соединений, распознавание галогенидов.
Практические занятия
Получение соляной кислоты и её свойства.
Повторение. (3ч.).
| № п/п | Тема урока | Кол-во часов | Тип урока | Химический эксперимент (оборудование) | Требования к уровню подготовки учащихся | Планируемая дата | Фактическая дата |
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
|
1.1 | Тема 1. Первоначальные химические понятия (18ч.).
Предмет химии. Правила техники безопасности. Вещества и их свойства. |
1 |
УИНЗ |
Демонстрации: - различные виды химической посуды; - предметы, сделанные из разных веществ; - приборы для измерения веса, плотности, жидкости, температуры; Лабораторный опыт №1: рассмотрение веществ с различными физическими свойствами. |
Знать определение предмета химии, определение вещества, свойств веществ. Уметь описывать вещества по их физическим свойствам. |
05.09.13. |
|
| 1.2. | Практическая работа №1. Правила техники безопасности при работе в химическом кабинете. Ознакомление с лабораторным оборудованием. | 1 | УЗЗ | Практическая работа №1. | Знать правила работы в химическом кабинете. Уметь обращаться с лабораторным оборудованием, химической посудой. | 09.09.13. |
|
| 1.3. | Чистые вещества и смеси. Способы разделения смесей. | 1 | КУ | Демонстрации: - однородные и неоднородные смеси; - (фильтрование, выпаривание, хромотография). Лабораторный опыт №2. - способы разделения смесей | Знать отличие чистого вещества от смеси, способы разделения смесей, иметь представление о материалах. Уметь различать однородные и неоднородные смеси. | 12.09.13. |
|
| 1.4. | Практическая работа №2. Очистка загрязнённой поваренной соли. | 1 | УЗЗ | Практическая работа №2. | Знать правила обращения с лабораторным оборудованием, способы разделения однородных и неоднородных смесей. Уметь проводить разделение смесей фильтрованием и выпариванием. | 16.09.13. |
|
| 1.5. | Физические и химические явления. Химические реакции. | 1 | КУ | Лабораторный опыт №3. - физические явления (растирание сахара в ступке, нагревание стеклянной трубки и т.д.); -химические явления (горение свечи, нагревание сахара, взаимодействие щёлочи с фенолфталеином, взаимодействие серной кислоты с хлоридом бария и т.д.)
| Знать определение физических и химических явлений, признаки химических реакций, условия их возникновения и течения реакций. Уметь отличать физические и химические явления, определять признаки химических реакций, условия их возникновения. | 19.09.13 |
|
| 1.6. | Молекулы и атомы. Вещества молекулярного немолекулярного строения. Простые и сложные вещества. | 1 | КУ | Демонстрации: - взаимодействие железа с серой. - ознакомление с образцами простых и сложных веществ. | Знать определение атома, молекулы, определение простого и сложного вещества, отличие смеси и сложного вещества.. Уметь различать вещества молекулярного и немолекулярного строения, различать простые и сложные вещества, смеси и сложные вещества..
| 23.09.13. |
|
| 1.7. | Химический элемент. Относительная атомная масса химических элементов. | 1 | УИНЗ | Демонстрации: - период. система; - видеофильм « Хим.элементы» | Знать определение химического элемента, 26 знаков химических элементов ,определение относительной атомной массы. Уметь отличать понятия «химический элемент» и «простое вещество». | 26.09.13. |
|
| 1.8. | Знаки химических элементов. Закон постоянства состава вещества.
| 1 | КУ | Демонстрации: - видеофильм «Химия.8класс. ч.1 (Первоначальные химические понятия»); - компакт-диск «Химия. 8класс». | Знать определение закона постоянства состава. | 30.09.13. |
|
|
1.9. |
Химические формулы, Относительная молекулярная масса. Что показывает химический знак, химическая формула. |
1 |
КУ |
Демонстрации: - видеофильм «Химия.8класс. ч.1 (Первоначальные химические понятия»); - компакт-диск «Химия. 8класс». |
Знать что такое химическая формула, относительная молекулярная масса. Уметь давать по плану описание вещества и выполнять расчёты по формуле. |
04.10.13. |
|
| 1.10. | Расчёты по химическим формулам. | 1 | КУ |
| Уметь выполнять расчёты по формуле. | 07.10.13. |
|
| 1.11. | Валентность. Составление химических формул по валентности. | 1 | КУ | Демонстрации: - видеофильм «Химия.8класс. ч.1 (Первоначальные химические понятия»);
| Знать определение понятия «валентность». Уметь определять валентность по формуле, состоящей из двух элементов, составлять формулы по валентности. | 11.10.13. |
|
| 1.12. | Определение химической формулы по валентности. | 1 | КУ |
| Знать определение понятия «валентность». Уметь составлять формулы по валентности. | 14.10.13. |
|
| 1.13. | Химические уравнения. Закон сохранения массы вещества. | 1 | КУ | Демонстрации: Опыт, иллюстрирующий закон сохранения массы веществ. | Знать основные положения атомно-молекулярного учения, роль М.В. Ломоносова и Д. Дальтона в создании этого учения. | 17.10.13. |
|
| 1.14. | Уравнения химических реакций. | 1 | КУ | Демонстрации: - компакт-диск «Вещества и их превращения». | Знать определение химических уравнений, значение коэффициента в химических уравнениях. Уметь составлять химические уравнения, расставлять коэффициенты.
| 21.10.13. |
|
| 1.15. | Типы химических реакций. | 1 | КУ | Демонстрации: Горение серы в кислороде; Взаимодействие оксида меди(2) с серной кислотой. Лабораторный опыт №4 - разложение малахита при нагревании; -взаимодействие железа с раствором хлорида меди (2). | Знать определение реакций разложения, соединения, замещения, обмена. Уметь определять типы химических реакций по химическим уравнениям. | 24.10.13. |
|
| 1.16. | Количество вещества. Моль – мера количества вещества. Молярная масса. | 1 | УИНЗ | Демонстрации: - некоторых веществ (металлов, неметаллов, их соединений) количеством 1 моль. | Знать определение количества вещества, моль, числа Авогадро. Уметь определять по формуле число молей по количеству структурных частиц и наоборот.
| 28.10.13. |
|
| 1.17. | Расчёты по химическим уравнениям. Решение типовых задач. | 1 | КУ | Демонстрации: - плакат «Количественные величины в химии». | Знать определение молярной массы, формулу для расчёта. Уметь вычислять массу данного вещества, если известно количество вещества, и наоборот. | 31.10.13. |
|
| 1.18. | Контрольная работа №1. «Первоначальные химические понятия». | 1 | УК |
| Уметь применять знания, умения, навыки, полученные в ходе изучения данной темы, при выполнении к/р. | 11.11.13. |
|
|
2.1 | Тема 2. Кислород.Оксиды. Горение. (6ч.)
Кислород, его общая характеристика, нахождение в природе, получение. |
1 |
КУ |
Демонстрации: - получение кислорода из перманганата калия. |
Знать способы получения кислорода в лаборатории и промышленности, понятие «катализатор», его роль, области применения.
|
14.11.13. |
|
| 2.1 | Физические, химические свойства кислорода. Оксиды. Окисление. Применение кислорода. Круговорот кислорода в природе. | 1 | КУ | Демонстрации: -сжигание в кислороде угля, серы, фосфора, железа; - ознакомление с физическими свойствами кислорода. Лабораторный опыт №5: ознакомление с образцами оксидов. | Знать физические и химические свойства кислорода. Уметь составлять формулы оксидов, называть их ,составлять уравнения реакций получения оксидов, рассказывать о круговороте
| 18.11.13. |
|
| 2.3 | Практическая работа №3. Получение и свойства кислорода. | 1 | УЗЗ | Практическая работа | Знать правила обращения с лабораторным оборудованием, способы получения кислорода. Уметь получать кислород в лабораторных условиях. | 21.11.13. |
|
| 2.4 | Состав воздуха. Горение веществ на воздухе и в кислороде. | 1 | КУ | Демонстрации: - количественное определение содержания кислорода в воздухе; - опыты, выясняющие условия горения. | Знать состав воздуха, условия возникновения и прекращения горения, меры по предупреждению пожаров. Уметь составлять уравнения горения сложных веществ (с уравниванием коэффициентов). | 25.11.13. |
|
| 2.5 | Тепловой эффект химических реакций. Термохимические уравнения. | 1 | УИНЗ | Демонстрации: - сжигание в кислороде различных веществ | Знать понятие теплового эффекта, определение экзо- и эндотермических реакций. Уметь различать экзо- и эндотермические реакции, записывать тепловой эффект для данной реакции. | 26.11.13. |
|
| 2.6 | Расчёты по термохимическим уравнениям. | 1 | КУ | Демонстрации: плакат «Количественные величины в химии». | Уметь вычислять тепловой эффект по известной массе вещества, и наоборот. | 02.12.13. |
|
|
3.1 | Тема 3. Водород. Кислоты. Соли. (4ч.)
Общая характеристика водорода. Нахождение водорода в природе и его получение. Применение.
|
1 |
КУ |
Лабораторный опыт №6: - получение водорода при взаимодействии раствора кислоты с цинком. |
Знать области применения водорода и способы получения его в лаборатории и в промышленности. Уметь собирать водород вытеснением воздуха, доказывать его наличие, проверять на чистоту. |
05.12.13. |
|
| 3.2 | Физические и химические свойства водорода. | 1 | КУ | Демонстрации: - ознакомление с физическими свойствами водорода; - горение водорода в кислороде; Лабораторный опыт№7: взаимодействие водорода с оксидом меди(2). | Знать состав молекулы водорода, определение восстановителя. Уметь давать характеристику водорода как элемента и как простого вещества, описывать физические и химические свойства водорода, записывать уравнения реакций. | 09.12.13. |
|
| 3.3 | Состав кислот. Соли. | 1 | КУ | Демонстрации: - образцов кислот и солей. | Знать состав кислот и солей, определение кислоты и соли. Уметь составлять химические формулы солей, давать им название, сравнивать по составу кислоты и соли. | 12.12.13. |
|
|
3.4 |
Общие свойства кислот. Взаимодействие кислот с оксидами металлов. Реакция обмена. |
1 |
УИНЗ |
Демонстрации: - действие индикатора на растворы кислот; - взаимодействие кислот с металлами (железом, медью, цинком); - взаимодействие кислот с оксидами металлов. |
Знать определение индикатора, химические свойства кислот. Уметь составлять уравнения реакций кислот с различными металлами, оксидами металлов, объяснять происхождение явлений с точки зрения атомно-молекулярного учения. | 16.12.13. |
|
|
4.1 | Тема 4. Вода. Растворы. Основания. (6ч.)
Вода – растворитель. Растворы.
|
1 |
КУ |
Демонстрации: - очистка воды перегонкой; - разделение смесей веществ с помощью делительной воронки. |
Знать способы очистки воды. Понятия «растворы», «растворитель», «дистиллированная вода», меры по охране воды от загрязнений. Уметь объяснять процесс растворения с точки зрения атомно-молекулярного учения. |
19.12.13. |
|
| 4.2 | Концентрация растворов, массовая доля растворённого вещества. | 1 | УИНЗ | Демонстрации: - видеофильм «Химия. 8 класс. ч.3» (Вода, растворы, основания)
| Знать определение растворимости, массовой доли растворённого вещества. Уметь вычислять массовую долю и массу вещества в растворе. | 23.12.13. |
|
| 4.3 | Практическая работа №4. «Приготовление раствора соли с определённой массовой долей вещества». | 1 | УЗЗ | Практическая работа | Уметь приготавливать раствор соли с определённой массовой долей растворённого вещества. Уметь решать задачи на определение массовой доли и массы растворённого вещества. | 27.12.13. |
|
|
4.4 |
Вода. Физические и химические свойства воды. |
1 |
КУ |
Демонстрации: - синтез воды; - взаимодействие воды с металлами (натрием, кальцием); - взаимодействие воды с оксидами кальция и фосфора; - исследование полученных растворов с помощью индикаторов. |
Знать количественный и качественный состав воды. Состав основания, химические и физические свойства воды, понятие об анализе и синтезе как методах определения состава веществ. Уметь составлять уравнения реакций, доказывать химические свойства воды. | 13.01.14. |
|
| 4.5 | Состав оснований, их классификация. | 1 | КУ |
Демонстрации: - реакция нейтрализации; - взаимодействие оксида углерода(4) с раствором гидроксида кальция и твёрдым гидроксидом натрия; - разложение гидроксида меди (2) при нагревании. - ознакомление со свойствами гидроксида натрия и гидроксида меди (20. | Знать определение оснований, классификацию, физические свойства, реакцию нейтрализации. Уметь составлять формулы оснований по валентности металла, определять щёлочи с помощью индикаторов, составлять уравнения реакций. Характеризующие химические свойства оснований. | 16.01.14. |
|
| 4.6 | Контрольная работа №2. по темам 2-4. | 1 | УК |
| Уметь применять знания, умения, навыки, полученные в ходе изучения тем 2-4, при выполнении к/р. | 20.01.14. |
|
|
|
5.1 | Тема 5. Основные классы неорганических веществ (10ч.)
Состав и строение оксидов. Классификация. Свойства оксидов.
|
1 |
КУ |
Демонстрации: - взаимодействие основных оксидов с кислотами; - ознакомление с образцами оксидов.
|
Знать классификацию неорганических соединений, определение и классификацию оксидов, их строение, свойства. Уметь классифицировать по составу и свойствам неорганические вещества, доказывать химические свойства кислотных и основных оксидов, записывать уравнения реакций. |
23.01.14. |
|
| 5.2 | Состав и строение кислот. Классификация и химические свойства. | 1 | КУ | Демонстрации: - некоторых свойств кислот. Лабораторный опыт№8: - действие индикатора на растворы кислот; - взаимодействие кислот с металлами (железом, медью, цинком); - взаимодействие кислот с оксидами металлов. | Знать определение кислот, их классификацию, физические свойства. Уметь доказывать химические свойства кислот, записывать уравнения химических реакций. | 27.01.14. |
|
| 5.3 | Состав и строение оснований. Классификация и получение. Физические и химические свойства оснований. | 1 | КУ | Демонстрации: - некоторых свойств оснований. Лабораторный опыт№9: - свойства растворимых и нерастворимых оснований; - взаимодействие щелочей с кислотами; - взаимодействие нерастворимых оснований с кислотами; - разложение гидроксида меди (2) при нагревании. | Знать определение и классификацию оснований, физические свойства. Уметь доказывать химические свойства оснований, записывать уравнения реакций. | 30.01.14. |
|
| 5.4- 5.5 | Состав и строение солей. Способы получения солей. Физические и химические свойства солей. | 2 | КУ | Демонстрации: - некоторых свойств солей.
| Знать определение и классификацию солей (некоторые способы получения солей). Уметь доказывать химические свойствасолей, записывать уравнения реакций. | 03.02.14. – 06.02.14. |
|
| 5.6-5.7 | Генетическая связь между классами неорганических веществ. | 2 | КУ | Демонстрации: - плакат «Связь между классами неорганических веществ» | Знать понятие генетической связи, уметь осуществлять превращения. Уметь применять ЗУН при выполнении тренировочных заданий и упражнений.
| 10.02.14. – 13.02.14. |
|
| 5.8 | Практическая работа №6. «Решение экспериментальных задач по теме: «Важнейшие классы неорганических соединений»». | 1 | УЗЗ | Практическая работа | Уметь применять теоретические и практические ЗУН, полученные в ходе изучения темы 5, при выполнении практической работы. | 17.02.ё14. |
|
| 5.9 | Обобщение и систематизация знаний по теме 5. | 1 | УОИСЗ | Демонстрации: - плакат «Связь между классами неорганических веществ» | Уметь применять ЗУН при выполнении тренировочных заданий и упражнений. Уметь составлять технологическую карту для п/р6. | 20.02.14. |
|
| 5.10 | Контрольная работа №3. по теме 5. | 1 | УК |
| Уметь применять теоретические и практические ЗУН, полученные при изучении тем ы 5, на контрольной работе. | 24.02.14. |
|
|
6.1 | Тема 6. Периодический закон и периодическая система химических элементов Д.И.Менделеева. Строение атома. (8ч.)
Классификация химических элементов. Амфотерность. |
1 |
КУ |
Лабораторный опыт№10: - взаимодействие гидроксида цинка с растворами кислот и щелочей.
|
Знать определение амфотерности оксида и гидроксида, первые попытки классификации химических элементов. Уметь экспериментально доказывать амфотерность гидроксида.
|
27.02.14. |
|
| 6.2 | Периодический закон Д.И.Менделеева. Порядковый номер. Периодическая система химических элементов. | 1 | УИНЗ | Демонстрации: - периодическая система; - транспаранты «Элементы и их свойства». | Знать определение периодического закона, определение периода, значение порядкового номера (физический смысл), определение периода, физический смысл номера периода, определение группы, физический смысл номера группы. Уметь объяснять изменение свойств элементов и их соединений, знать причину этого ,описывать химические элементы, исходя из положения в периоде и в группе с учётом строения атома, объяснять изменение свойств в периоде в группе (главной подгруппе).
| 03.03.14. |
|
| 6.3 | Строение атома. Состав атомных ядер. Изотопы. | 1 | КУ | Демонстрации: - периодическая система; - транспаранты «Элементы и их свойства». | Знать строение атома, состав атомного ядра, определение изотопов, три вида излучений. Уметь описывать химический элемент с точки зрения строения атома, находить черты сходства и отличия у изотопов.
| 06.03.14. |
|
| 6.4-6.5 | Строение электронных оболочек атомов. | 2 | УИНЗ | Демонстрации: - периодическая система; - транспаранты «Электронные оболочки атомов»; - таблицы «Электронные оболочки атомов». | Знать расположение электронов по слоям, формы электронных орбиталей, знать о периодичеких изменениях химических свойств в зависимости от числа электронов в наружном слое. Уметь записывать строение атомов элементов первых четырёх периодов, записывать электронные формулы и электронные ячейки для атомов элементов этих периодов. | 10.03.14. – 13.03.14. |
|
| 6.6 | Состояние электронов в атомах. Периодическое изменение свойств химических элементов в периодах и в главных подгруппах. | 1 | УИНЗ | Демонстрации: - периодическая система; - транспаранты «Электронные оболочки атомов»; - таблицы «Электронные оболочки атомов». | Знать формы электронных орбиталей, знать о периодичеких изменениях химических свойств в зависимости от числа электронов в наружном слое. Уметь записывать электронные формулы и электронные ячейки для атомов элементов этих периодов. | 17.03.14. |
|
| 6.7 | Характеристика химических элементов главной подгруппы на основании положения в периодической системе и строения атома. | 1 | КУ | Демонстрации: - периодическая система; - план характеристики химического элемента. | Уметь давать характеристику по плану данного химического элемента главной подгруппы по его положению в периодической системе и строению атома. | 20.03.14. |
|
| 6.8 | Значение периодического закона. Жизнь и деятельность Д.И. Менделеева. | 1 | КУ | Демонстрации: - видеофильм «М.В.Ломоносов. Д.И.Менделеев». | Знать роль периодического закона для развития науки, техники, для обобщения известных фактов и открытия новых; знать основные этапы жизни и деятельности Д.И.Менделеева. Уметь доказывать основные положения диалектики на примере периодической системы и строения атома. | 31.03.14. |
|
|
7.1 | Тема 7. Химическая связь. Строение вещества. (8ч.)
Электроотрицательность химических элементов. Ковалентная связь. Неполярная и полярная ковалентная связь. |
1 |
УИНЗ |
Демонстрации: - таблица по типам связи. |
Знать определение электроотрицательности ,определение химической связи, ковалентная полярная и неполярная связи, механизм образования связи, энергия связи. Уметь определять различные виды ковалентной связи, записывать схемы образования веществ с ковалентной полярной и неполярной связью. . |
03.04.14. |
|
| 7.2 | Ионная связь (понятие о степени окисления). | 1 | КУ | Демонстрации: - таблица по типам связи. | Знать определение ионной связи, механизм образования связи, понятие о степени окисления. Уметь определять ионную и ковалентную связи в различных веществах, записывать схемы образования веществ с ионной связью.
| 07.04.14. |
|
| 7.3 | Кристаллические решетки. | 1 | КУ | Демонстрации: - «Составление моделей веществ с различной кристаллической решеткой». | Знать определение кристаллической решётки, типы кристаллических решёток. Уметь определять типы кристаллических решёток. | 10.04.14. |
|
| 7.4 | Степень окисления. Правила определения степеней окисления элементов. | 1 | УИНЗ | Демонстрации: - таблица степени окисления. | Знать определение степени окисления. Уметь определять степень окисления элементов в различных веществах. | 14.04.14. |
|
| 7.5- 7.6 | Процессы окисления и восстановления. Окислительно-восстановительные реакции. | 2 | КУ | Демонстрации: - транспаранты «Процессы окисления-восстановления». | Знать определение окислительно-восстановительной реакции, окислителя, восстановителя. Уметь определять окислительно-восстановительные реакции, составлять схему электронного баланса, расставлять коэффициенты, используя метод электронного баланса. | 17.04.14. – 21.04.14 |
|
| 7.7 | Обобщение и систематизация знаний по теме6, 7. |
| УОИСЗ | Демонстрации: - видеофильм «Химия. 8 класс» | Уметь применять знания, умения, навыки, полученные при изучении темы 7, при выполнении тренировочных заданий и упражнений.
| 24.04.14. |
|
| 7.8 | Контрольная работа №4. по темам 6,7. | 1 | УК |
| Уметь применять теоретические и практические знания, умения, навыки, полученные при изучении тем 6,7 на контрольной работе. | 28.04.14. |
|
|
8.1 | Тема 8. Закон Авогадро. Молярный обьем газов. (3ч.)
Закон Авогадро. Молярный объем газов.
|
1 |
УИНЗ |
Демонстрации: - плакат «Количественные величины в химии». |
Знать определение закона Авогадро. Уметь вычислять объём газов по известной массе вещества, и наоборот. |
05.05.14. |
|
| 8.2 | Относительная плотность газов.
| 1 | КУ | Демонстрации: - плакат «Количественные величины в химии». | Знать определение закона Авогадро. Уметь вычислять объём газов по известной массе вещества, и наоборот. | 08.05.14. |
|
| 8.3 | Объемные отношения газов при химических реакциях.
| 1 | КУ | Демонстрации: - плакат «Количественные величины в химии». | Знать определение закона Авогадро. Уметь вычислять объём газов по известной массе вещества, и наоборот. | 12.05.14. |
|
|
9.1 |
Тема 9. Галогены. (4ч.)
Положение галогенов в периодической системе элементов и строение их атомов. Хлор: нахождение в природе, физические, химические свойства, применение. |
1 |
УИНЗ |
Демонстрации: - видеофильм «Химия. 8 класс»
|
Знать положение галогенов в периодической системе элементов и строение их атомов. Уметь писать уравнения реакций с участием хлора. |
15.05.14. |
|
| 9.2 | Хлороводород, получение, свойства. Соляная кислота и ее соли.
| 1 | УИНЗ | Лабораторный опыт№11: - распознавание соляной кислоты, хлоридов, бромидов, иодидов и иода.
| Знать положение галогенов в периодической системе элементов и строение их атомов. Уметь писать уравнения реакций с участием соляной кислоты. | 19.05.14. |
|
| 9.3 | Сравнительная характеристика галогенов. | 1 | КУ | Лабораторный опыт№12: - вытеснение галогенами друг друга из растворов их соединений. | Уметь давать сравнительную характеристику галогенам по положению в периодической системе Д.И.Менделеева. | 22.05.14. |
|
| 9.4 | Практическая работа №6. «Получение соляной кислоты и её свойства». | 1 | УЗЗ | Практическая работа | Уметь получать соляную кислоту.
| 26.05.14. |
|
|
| Повторение. (3ч.) Итоговая контрольная работа |
1 |
УК |
|
|
29.05.14. |
|
|
| Итого: |
70 |
| Контрольных работ – 5
| Практических работ – 6; Лабораторных работ -12;
|
|
|

 Получите свидетельство
Получите свидетельство Вход
Вход











 Рабочая программа по химии (8 класс) (96.38 КB)
Рабочая программа по химии (8 класс) (96.38 КB)
 0
0 624
624 10
10 Нравится
0
Нравится
0




