«Рассмотрено» «Согласовано» «Утверждено»
Руководитель НМС заместитель директора по УВР директор
________/ Мартышкина И.В / МБОУ «Лицей №4» МБОУ «Лицей №4»
Протокол №____ от __________/_Старостина Н.Н. ___________/Дуденкова Т.В.
«_____» августа 2013г. «_____» августа 20__г приказ № ___
от «___» августа 2013г
РАБОЧАЯ ПРОГРАММА
ХИМИЯ
Основная ступень, базовый уровень
Баймашкина Татьяна Александровна, высшая квалификационная категория
Муниципальное бюджетное общеобразовательное учреждение
«Лицей №4»
Рузаевского муниципального района Республики Мордовия
Класс: 8 КЛАСС
на 2013-2014 учебный год
Составлена на основе: Рабочая программа составлена на основе Примерной программы основного общего образования по химии,
Москва, Просвещение, 2006
Учебник: Н.Е. Кузнецова «Химия -8»
Поурочное планирование по химии по УМК под редакцией
Н.Е. Кузнецовой (8 – 11 классы)
В перечне учебников, рекомендованных Министерством образования РФ, имеются учебники химии для 8 – 11 классов под редакцией Н.Е. Кузнецовой. В лицее №4 апробировали данные учебники в 8 – 11 классах в течение 8 лет. Выбор данных учебников обусловлен тем, что они способствуют созданию условий для расширения опыта творческой деятельности и поддержания познавательного интереса учащихся на основе проблемно-интегративного подхода. Данное планирование интересно тем, что позволяет организовать в системе работу по формированию общеучебных умений учащихся, экологическому воспитанию, проведению контроля знаний и умений в разных формах, на базовом и расширенном уровнях.
ПОЯСНИТЕЛЬНАЯ ЗАПИСКА
Рабочая программа учебного предмета «химия» составлена в соответствии с требованиями федерального компонента государственного образовательного стандарта общего образования на основе программы по химии для 8-11 классов общеобразовательных учреждений под редакцией Н.Е. Кузнецовой, 2006 год, которая имеет гриф «Допущено Министерством образования и науки Российской Федерации».
Важнейшая особенность данного курса – высокий теоретический уровень, Строгое следование логике принципа развивающего обучения. заложены возможности предусмотренного стандартом формирования у обучающихся общеучебных умений и навыков, универсальных способов деятельности и ключевых компетенций
Практически весь теоретический материал рассматривается на первом году обучения, что позволяет учащимся более осознанно изучать фактический материал – химию элементов и их соединений в конце 8-го и на протяжении всего 9-го класса.
Программа составлена с учётом реализации межпредметных связей с курсом физики 7-го класса, биологии.
Богатый химический эксперимент, введённый в курс, способствует повышению интереса к изучению химии, формированию практических навыков в проведении основных химических операций, приобщению к самостоятельной работе, обучению безопасности и грамотному обращению с веществами в быту и кабинете химии.
Цели изучения предмета химии на данной ступени образования:
Освоение важнейших знаний об основных понятиях и законах химии, химической символике;
Овладение умениями наблюдать химические явления, проводить химический эксперимент. Производить расчеты на основе химических формул веществ и уравнений химических реакций;
Развитие познавательных интересов и интеллектуальных способностей в процессе проведения химического эксперимента, самостоятельного применения знаний в соответствии с возникающими жизненными потребностями;
Воспитание отношения к химии как к одному из фундаментальных компонентов естествознания и элементу общечеловеческой культуры;
Применение полученных знаний и умений для безопасного использования веществ и материалов в быту, сельском хозяйстве и на производстве, решения практических задач в повседневной жизни, предупреждении явлений, наносящих вред здоровью и окружающей среде.
Изучение предмета «химия» способствует решению следующих задач:
Воспитание убеждённости в позитивной роли химии в жизни современного общества, необходимости химически грамотного отношения к своему здоровью и окружающей среде
Подготовка к сознательному выбору профессии в соответствии с личными способностями и потребностями общества.
Формирование умений: обращаться с химическими веществами, простейшими приборами, оборудованием, соблюдать правила техники безопасности, фиксировать результаты опытов, делать обобщения.
Данная программа содержит все темы, включённые в федеральный компонент содержания образования.
Содержание программы носит образовательный характер. При проведении уроков используются беседы, работа в группах, самостоятельная работа.
Место предмета в базисном учебном плане
Учебный материал изучается на базовом уровне в соответствии с лицензией школы. Программа рассчитана на 3 часа в неделю, всего 102 часа в год.
Программа рассчитана на 102 учебных часа. Данная рабочая программа составлена на основе программы общеобразовательных учреждений по химии для 8-11 классов и скорректирована на основе многолетнего опыта работы учителя, поэтому внесены некоторые изменения:
глава I «Химические элементы и вещества в свете атомно-молекулярного учения. » - лабораторная работа№3 «примеры физических и химических явлений», а по учебнику данная работа представляет собой две отдельные лабораторные работы; лабораторная работа «изучение свойств веществ: нагревание воды, нагревание оксида кремния (IV) – данная работа предусматривается в лабораторной работе №3, поэтому как отдельную работу я её исключила.
глава V. «Понятие о газах. Воздух. Кислород. Горение.» - практическая работа №5 «Получение кислорода и изучение его свойств» не предусматривает основная программа, поэтому данную работу провожу в виде демонстрационного опыта.
глава VII. «Основные классы неорганических соединений» - лабораторная работа №10 включает в себя четыре отдельные лабораторные работы по основной программе, в своей рабочей программе я их объединила и провожу как одну; лабораторная работа №11 «свойства кислот» включила в себя отдельные работы « взаимодействие кислот с оксидами, металлами и основаниями», которые предусматривает основная программа; в изучение данной главы включила проведение лабораторной работы №14 «Амфотерность оксида алюминия и гидроксида алюминия», так как в данном разделе присутствует данная тема.
Общеучебные умения, навыки и способы деятельности
Программа предусматривает формирование у учащихся общеучебных умений и навыков, универсальных способов деятельности и ключевых компетенций. В этом направлении приоритетами для учебного предмета «Химия» на ступени основного общего образования являются: использование для познания окружающего мира различных методов (наблюдения, измерения, опыты, эксперимент); проведение практических и лабораторных работ, несложных экспериментов и описание их результатов; использование для решения познавательных задач различных источников информации; соблюдение норм и правил поведения в химических лабораториях, в окружающей среде, а также правил здорового образа жизни.
Результаты обучения
Результаты изучения курса «Химия» приведены в разделе «Требования к уровню подготовки выпускников», который полностью соответствует стандарту. Требования направлены на реализацию деятельностного, практикоориентированного и личностно ориентированного подходов; освоение учащимися интеллектуальной и практической деятельности; овладение знаниями и умениями, востребованными в повседневной жизни, позволяющими ориентироваться в окружающем мире, значимыми для сохранения окружающей среды и собственного здоровья.
Контроль знаний, умений, навыков (текущий, рубежный, итоговый) осуществляется следующим образом:
Текущий контроль осуществляется в виде устного опроса, тестовых работ, проверочных работ, предполагающих развернутый ответ. Письменные работы дифференцированы, включают в себя вопросы как базового, так и повышенного уровней.
Требования к уровню подготовки:
В результате изучения курса химии в 8 классе ученик должен:
знать/понимать
химическую символику: знаки химических элементов, формулы химических веществ и уравнения химических реакций;
важнейшие химические понятия: химический элемент, атом, молекула, относительные атомная и молекулярная массы, химическая связь, вещество, классификация веществ, моль, молярная масса, молярный объем, химическая реакция, классификация реакций, окислитель и восстановитель, окисление и восстановление;
основные законы химии: сохранения массы веществ, постоянства состава вещества, периодический закон:
уметь
называть: химические элементы, соединения изученных классов;
объяснять: физический смысл атомного (порядкового) номера химического элемента. Номеров группы и периода, к которым элемент принадлежит в периодической системе Д.И. Менделеева; закономерности изменения совйств в пределах малых периодов и главных подгрупп;
характеризовать: химические элементы (от водорода до кальция) на основе их положения в периодической системе Д.И. Менделеева и особенностей строения их атомов; связь между строением, составом и свойствами веществ; химические свойства основных классов неорганических веществ;
определять: состав веществ по их формулам, принадлежность веществ к определенному классу соединений, типы химических реакций, валентность и степень окисления элемента в соединениях;
составлять: формулы неорганических соединений изученных классов; схемы строения атомов первых 20 элементов периодической системы Д.И. Менделеева; уравнения химических реакций;
обращаться с химической посудой и лабораторным оборудованием;
распознавать опытным путем кислород, водород, растворы кислот и щелочей;
вычислять: массовую долю химического элемента по формуле соединения; массовую долю вещества в растворе; количество вещества; объем или массу по количеству вещества, объему или массе реагентов или продуктов реакции;
использовать приобретенные знания и умения в практической деятельности и повседневной жизни для:
безопасного обращения с веществами и материалами;
экологически грамотного поведения в окружающей среде;
приготовления растворов заданной концентрации.
При оформлении рабочей программы были использованы следующие условные обозначения при классификации типов уроков:
урок ознакомления с новым материалом (УОНМ);
урок применения знаний и умений (УПЗУ);
комбинированный урок (КУ);
урок-семинар (УС);
урок-лекция (Л)
урок контроля знаний (К);
Дидактические материалы – ДМ.
Демонстрации – ДО, лабораторные опыты – ЛО.
ПСХЭ – периодическая система химических элементов
У – учебник химии
З – задачник по химии
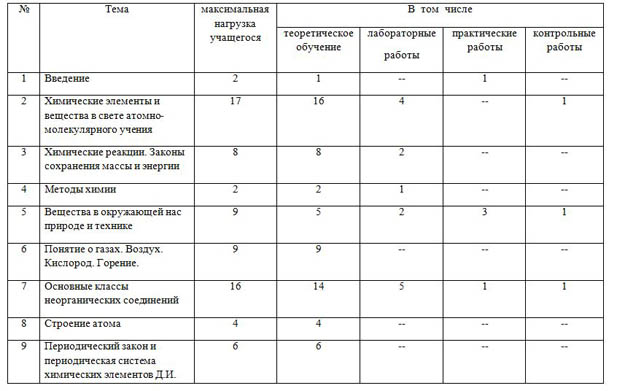
Тематическое планирование по дисциплине_____Химия________________
| № | Тема | максимальная нагрузка учащегося | В том числе |
| теоретическое обучение | лабораторные работы | практические работы | контрольные работы |
| 1 | Введение | 2 | 1 | -- | 1 | -- |
| 2 | Химические элементы и вещества в свете атомно-молекулярного учения | 17 | 16 | 4 | -- | 1 |
| 3 | Химические реакции. Законы сохранения массы и энергии | 8 | 8 | 2 | -- | -- |
| 4 | Методы химии | 2 | 2 | 1 | -- | -- |
| 5 | Вещества в окружающей нас природе и технике | 9 | 5 | 2 | 3 | 1 |
| 6 | Понятие о газах. Воздух. Кислород. Горение. | 9 | 9 | -- | -- | -- |
| 7 | Основные классы неорганических соединений | 16 | 14 | 5 | 1 | 1 |
| 8 | Строение атома | 4 | 4 | -- | -- | -- |
| 9 | Периодический закон и периодическая система химических элементов Д.И. Менделеева | 6 | 6 | -- | -- | -- |
| 10 | Химическая связь и строение вещества в свете электронной теории | 8 | 7 | -- | -- | 1 |
| 11 | Химические реакции в свете электронной теории | 6 | 6 | -- | -- | -- |
| 12 | Водород и его важнейшие соединения | 6 | 5 | -- | 1 | -- |
| 13 | Галогены | 5 | 3 | 3 | 1 | 1 |
| 14 | Обобщение знаний о наиболее важных характеристиках веществ и химических процессов | 4 | 3 | -- | -- | 1 |
| ИТОГО | 102 | 89 | 17 | 7 | 6 |
Лабораторные работы 8 класса
№1 Рассмотрение веществ с разными физическими свойствами на примере меди, железа, цинка, серы, воды, соли.
№2 Испытание твердости веществ с помощью шкалы твердости.
№3 Примеры физических и химических явлений.
№4 Изучение образцов металлов и неметаллов (отношение к нагреванию алюминия, серы, меди).
№5 Признаки протекания химических реакций. Примеры реакций протекающих с выделением газа, осадка, изменение цвета, появление запаха и т.д.
№6 Типы химических реакций. Реакции соединения, разложения, замещения, обмена.
№7 Изменение окраски индикаторов в разных средах.
№8 Приготовление смесей и разделение их.
№9 Сравнение проб воды водопроводной и водоема.
№10 Рассмотрение образцов оксидов. Отношение оксидов к воде.
№11 Свойства кислот.
№12 Свойства растворимых оснований.
№13 Свойства нерастворимых оснований.
№14 Амфотерность (оксид алюминия, гидроксид алюминия).
№15 Свойства соляной кислоты.
№16 Качественные реакции на галогениды.
№17 Галогениды, вытеснение друг друга из растворов солей.
Практические работы 8 класса
Правила техники безопасности при работе в химическом кабинете. Ознакомление с лабораторным оборудованием.
Очистка загрязнённой поваренной соли.
Растворимость веществ
Приготовление раствора соли с определённой массовой долей вещества
Исследование свойств оксидов, оснований, кислот
Получение водорода и исследование его свойств.
Получение соляной кислоты и её свойства.
СОДЕРЖАНИЕ учебной дисциплины
Тема 1. Введение (2 часа)
Химия как часть естествознания. Химия – наука о веществах, их строении, свойствах и превращениях. Вещества в твердом, жидком, газообразном состояниях.
Эксперимент: Правила работы в школьной лаборатории. Лабораторная посуда и оборудование. Правила безопасности. Нагревательные устройства.
Учащиеся должны знать/понимать:
- важнейшие химические понятия: химия как наука, вещество, химическая реакция
- правила безопасного обращения с веществами, нагревательными приборами, химической посудой и простейшим оборудованием
уметь:
- обращаться с химической посудой и химическим оборудованием
использовать приобретенные знания и умения в практической деятельности и повседневной жизни для: - безопасного обращения с веществами и материалами
Тема 2. «Химические элементы и вещества в свете атомно-молекулярного учения» (17 часов)
Атомы и молекулы. Химический элемент. Язык химии. Знаки химических элементов. Химические формулы. Закон постоянства состава. Относительная атомная и молекулярная массы. Атомная единица массы. Количество вещества, моль. Молярная масса. Качественный и количественный состав вещества. Простые и сложные вещества. Периодический закон и периодическая система химических элементов Д.И. Менделеева. Группы и периоды периодической системы. Понятие о валентности. Вычисление массовой доли химического элемента в веществе. Вычисление количества вещества или массы по количеству вещества или массе одного из реагентов или продуктов реакции.
Учащиеся должны знать/ понимать
- важнейшие химические понятия: вещество, простые и сложные вещества, химическая реакция, атом, молекула, химический элемент, относительная атомная масса, относительная молекулярная масса, валентность, количество вещества, моль, молярная масса
- химическую символику: знаки химических элементов, химические формулы
- основные законы химии: постоянства состава вещества
- качественный и количественный состав вещества
уметь:
- называть химические элементы
- характеризовать химические элементы (от водорода до кальция) на основе их положения в периодической системе Д. И. Менделеева
- определять состав веществ по их формулам, валентность
- вычислять количество вещества по массе, массу по количеству вещества, массовую долю химического элемента по формуле соединения
Тема 3. Химические явления в свете атомно-молекулярного учения (8 часов)
Химическая реакция. Условия протекания химических реакций. Сохранение массы веществ при химических реакциях. Классификация химических реакций по различным признакам: числу и составу исходных и полученных веществ, поглощению или выделению энергии. Проведение расчетов на основе уравнений реакций: количества вещества или массы по количеству вещества или массе одного из реагентов или продуктов реакции.
Эксперимент: Проведение химических реакций в растворах. Проведение химических реакций при нагревании.
Учащиеся должны знать/ понимать:
- важнейшие химические понятия: химические реакции, классификация реакций,
- химическую символику: уравнения химических реакций
- основные законы химии: сохранения массы веществ при химических реакциях
- условия возникновения и признаки протекания химических реакций
- классификация химических реакций по числу и составу исходных и полученных веществ, по поглощению или выделению энергии
уметь:
- определять типы химических реакций
- вычислять массу или количество вещества по массе или количеству вещества одного из реагентов или продуктов реакции
- составлять уравнения химических реакций
Тема 4. Методы химии (2часа)
Наблюдение, описание, измерение, эксперимент, моделирование1. Понятие о химическом анализе и синтезе.
Эксперимент: Методы анализа веществ. Определение характера среды. Индикаторы.
Учащиеся должны знать/ понимать:
- методы химии: наблюдение, описание, измерение, эксперимент, моделирование1; химический анализ и синтез
Тема 5. Вещества в окружающей нас природе и технике (9 часов)
Чистые вещества и смеси веществ. Природные смеси: воздух, природный газ, нефть, природные воды. Проведение расчетов массовой доли растворенного вещества в растворе.
Эксперимент: Разделение смесей. Очистка веществ. Фильтрование. Взвешивание. Приготовление растворов. Получение кристаллов солей.
Учащиеся должны знать/ понимать:
- агрегатные состояния вещества
- чистые вещества и смеси веществ
- природные смеси разного агрегатного состояния: воздух, природный газ, нефть, природные воды, растворы
Тема 6. Понятие о газах. Воздух. Кислород. Горение. (9 часов)
Кислород. Озон. Воздух – природная смесь. Молярный объем. Вычисление количества вещества, массы или объема по количеству вещества, массе или объему одного из реагентов или продуктов реакции.
Эксперимент: Получение кислорода. Качественная реакция на кислород.
Учащиеся должны знать/ понимать:
- кислород, озон
уметь:
- вычислять массу, количество вещества или объем по массе, объему или количеству вещества одного из реагентов или продуктов реакции
- составлять формулы оксидов
- распознавать опытным путем кислород
Тема 7. Классы неорганических соединений (16 часов)
Основные классы неорганических веществ. Экспериментальное изучение химических свойств неорганических веществ.
Учащиеся должны знать/ понимать:
- основные классы неорганических веществ
- свойства оксидов, оснований, кислот и солей
уметь:
- определять принадлежность веществ к определенному классу соединений
- составлять формулы гидроксидов, солей
- распознавать опытным путем растворы кислот и щелочей
Тема 8. Строение атома. Ядерные реакции (4 часа)
Строение атома. Ядро (протоны, нейтроны) и электроны. Изотопы. Строение электронных оболочек атомов первых 20 элементов периодической системы Д.И. Менделеева.
Учащиеся должны знать/ понимать:
- важнейшие химические понятия: ядро, протоны, нейтроны, электроны, изотопы
- строение электронных оболочек атомов элементов малых периодов периодической системы химических элементов Д.И. Менделеева
уметь:
- составлять схемы строения атомов первых двадцати элементов периодической системы
Тема 9. Периодический закон и периодическая система химических элементов Д.И. Менделеева (6часов)
Периодический закон и периодическая система химических элементов Д.И. Менделеева. Группы и периоды периодической системы.
Учащиеся должны знать/ понимать:
- важнейшие химические понятия: группы и периоды периодической системы
- периодический закон и периодическая система химических элементов Д.И. Менделеева
уметь:
- объяснять физический смысл атомного (порядкового) номера химического элемента, номеров группы и периода, к которым он принадлежит в периодической системе Д.И. Менделеева;
- объяснять закономерности изменения свойств элементов в пределах малых периодов и главных подгрупп;
- характеризовать химические элементы (от водорода до кальция) на основе их положения в периодической системе Д.И. Менделеева и особенностей строения их атомов
Тема 10. Химическая связь и строение веществ в свете электронной теории (8 часов)
Строение молекул. Химическая связь. Типы химических связей: ковалентная (полярная, неполярная), ионная. Понятие о степени окисления.
Кристаллические и аморфные вещества. Типы кристаллических решеток (атомная, молекулярная, ионная).
Учащиеся должны знать/ понимать:
- важнейшие химические понятия: химическая связь, кристаллические и аморфные вещества
- общее представление о строении молекул
- типы химических связей: ковалентная (полярная и неполярная), ионная, металлическая
- типы кристаллических решеток (атомная, молекулярная, ионная, металлическая)
уметь:
- характеризовать связь между составом, строением и свойствами веществ
Тема 11. Химические реакции в свете электронной теории. Окислительно-восстановительные реакции (6часов)
Окислительно-восстановительные реакции. Окислитель и восстановитель. Классификация химических реакций по различным признакам: изменению степеней окисления химических элементов.
Учащиеся должны знать/ понимать
- важнейшие химические понятия: степень окисления
- классификацию реакций по постоянству или изменению степеней окисления атомов химических элементов
- определять степень окисления элементов в соединениях
Тема 12. Водород и его важнейшие соединения (6 часов)
Водород. Водородные соединения неметаллов. Вода. Экспериментальное изучение химических свойств неорганических веществ. Вычисление количества вещества, массы или объема по количеству вещества, массе или объему одного из реагентов или продуктов реакции.
Эксперимент: Получение водорода. Качественная реакция на водород.
Учащиеся должны знать/ понимать
- водород, водородные соединения неметаллов
- вода
уметь:
- составлять формулы водородных соединений неметаллов
- распознавать опытным путем водород
Тема 13. Галогены (5 часов)
Галогены. Галогеноводородные кислоты и их соли. Экспериментальное изучение химических свойств неорганических веществ.
Учащиеся должны знать/ понимать
- галогены
- галогеноводородные кислоты и их соли
уметь:
- распознавать опытным путем хлорид-ионы
Тема 14. Обобщение знаний о наиболее важных характеристиках веществ и химических процессах. (4 часа)
Строение атома на основе положения в периодической системе. Простые и сложные вещества на примерах водорода, кислорода, оксидов, солей, оснований, кислот. Типы реакций. Охрана труда.
РЕСУРСНОЕ ОБЕСПЕЧЕНИЕ РАБОЧЕЙ ПРОГРАММЫ
Литература
Сборник нормативных документов. Химия/ Сост. Э.Д. Днепров, А.Г. Аркадьев. – М.: Дрофа, 2004.
Программы по химии для 8-11 классов общеобразовательных учреждений /Под ред. Н.Е. Кузнецовой. – М.: Вентана-Граф, 2006.
Химия: Учебник для учащихся 8 класса общеобразовательных учреждений / Кузнецова Н.Е., Титова И.М. и др. – М.: Вентана –Граф, 2005
Кузнецова Н.Е., Левкин А.Н. Задачник по химии. 8 кл. - М.: Вентана-Граф, 2005.
Гара Н.Н., Зуева М.В. В химической лаборатории. 8 кл. Рабочая тетрадь. – М.: Вентана-Граф, 2005.
Медиаресурсы:
Химия для всех – ХХI. Образовательная коллекция 1С.
Виртуальная школа Кирилла и Мефодия. Уроки химии.
Открытая химия. Полный интерактивный курс химии.
Химия для гуманитариев. Элективный курс.
Тесты. Химия. 8 – 11 классы.
Единая коллекция цифровых образовательных ресурсов (www.school-collection.edu.ru)
http://lyceum1.ssu.runnet.ru/~vdovina/sod.html - Сборник расчетных задач для работы на спецкурсе "Решение расчетных химических задач".
http://www.chemistry.narod.ru
Мир Химии. Качественные реакции и получение веществ, примеры. Справочные таблицы. Известные ученые - химики.
Календарно-тематический план
| № п/п | Тема урока | Кол-во часов | Тип урока | Химический эксперимент (оборудование) | Требования к уровню подготовки учащихся | Планируемая дата | Фактическая дата |
|
| Тема 1. Введение – 3 часа |
|
|
|
|
|
|
| 1.1 | Введение. Правила ТБ в кабинете химии. Предмет и задачи химии. | 1 | УОНМ | Демонстрации: ознакомление с природными и синтетическими веществами и материалами | Знать понятие физическое тело, вещество, природные и синтетические вещества и материалы, предмет и задачи химии. умение приводить примеры физических тел и веществ, отвечать на вопросы с использованием содержания текста, заполнять схемы воспроизводящих материал учебника.
| 05.09.13. |
|
| 1.2 | Практическая работа № 1 «Правила техники безопасности при работе в химическом кабинете. Ознакомление с лабораторным оборудованием.» | 1 | УЗЗ | Практическая работа №1. | Знать элементарные правила при работе в кабинете химии, строение пламени. лабораторную посуду. умение обращаться со спиртовкой, лабораторным штативом, зарисовывать и указывать их основные части, слушать учителя, работать по инструкции, фиксировать результаты. зарисовывать лабораторную посуду. | 06.09.13. |
|
|
| Тема 2. Химические элементы и вещества в свете атомно-молекулярного учения 17 часов |
|
|
|
|
|
|
| 2.1 | Понятие «вещество» в физике и химии. | 1 | КУ | ДО: измерение плотности жидкостей ареометром Лабораторный опыт №1: рассмотрение веществ с различными физическими свойствами меди, железа, цинка, серы, воды, соли Лабораторный опыт №2: Испытание твердости веществ с помощью шкалы твердости. | объяснять взаимосвязь химии с другими науками, приводить примеры.
| 09.09.13. |
|
| 2.2 | Описание физических свойств веществ. Физические и химические явления. | 1 | УОНМ | Лабораторный опыт №3: Примеры физических и химических явлений. Лабораторный опыт №4: Изучение образцов металлов и неметаллов (отношение к нагреванию алюминия, серы, меди). | умение приводить примеры физических явлений и х.р., отличать физ. явления от х.р., наблюдать и описывать признаки х.р., умение обращаться с лабораторным оборудованием при проведении Л.О., соблюдая правила Т.Б., работать по инструкции и фиксировать результаты опытов. П.У: объяснять и характеризовать сущность физ. явлений и х.р. | 12.09.13. |
|
| 2.3 | Атомы. Молекулы. Химические элементы. | 1 | УОНМ |
| умение находить по ПС ХЭ х.э., изображать знаки и произносить их по формуле х.э., выполнять упражнения по образцу, работать с учебником.
| 13.09.13. |
|
| 2.4 | Формы существования химических элементов. Простые и сложные вещества. | 1 | КУ | Демонстрации: - взаимодействие железа с серой. - ознакомление с образцами простых и сложных веществ. | отличать простые вещества от сложных, объяснять как строение вещества сказывается на его свойствах, выполнять упражнения по образцу.
| 16.09.13. |
|
| 2.5 | Качественный и количественный состав веществ. Химические формулы. Закон постоянства состава. | 1 | КУ | Д: коллекции металлов и неметаллов
| умение записывать и читать химические формулы, определять информацию по формуле, составлять х .фор- мулы по числу атомов в сложном веществе. | 19.09.13. |
|
| 2.6 | Атомно-молекулярное учение. Вещества молекулярного и немолекулярного строения.
| 1 | УС |
| умение объяснять физические и химические явления с точки зрения АМУ, работать с учебником, отвечать на вопросы с использованием содержания текста (репрод. хар-ра). | 20.09.13. |
|
| 2.7 | Масса атома. Атомная единица массы. Относительная атомная масса.
| 1 | УОНМ | Демонстрации: - период. система; - видеофильм « Хим.элементы» | Знать определение химического элемента, 26 знаков химических элементов ,определение относительной атомной массы. Уметь отличать понятия «химический элемент» и «простое вещество». | 23.09.13. |
|
| 2.8 | Химические формулы, Относительная молекулярная масса. | 1 | КУ | Демонстрации: - видеофильм «Химия.8класс. ч.1 (Первоначальные химические понятия»); - компакт-диск «Химия. 8класс». |
Знать что такое химическая формула, относительная молекулярная масса. Уметь давать по плану описание вещества и выполнять расчёты по формуле. | 26.09.13. |
|
| 2.9 | Массовые доли элементов в соединениях. Решение расчетных задач.
| 1 | КУ |
| умение рассчитывать массовую долю элемента (в%) по формуле вещества. (решение обратных задач).
| 27.09.13. |
|
| 2.10 | Что показывает химический знак и химическая формула. | 1 | КУ |
| описывать качественный и количественный состав вещества по химической формуле, вычислять относительную молекулярную массу вещества, массу молекулы и массовые доли элементов по формуле вещества. вывод формул веществ по массовым долям элементов. | 30.09.13. |
|
| 2.11 | Система химических элементов Д. И. Менделеева. | 1 | КУ |
| умение давать формулировку ПЗ (1-ая формулировка), работать с ПСХЭ Д.И. Менделеева при выполнении простейших упражнений.
| 03.10.13. |
|
| 2.12 | Валентность. Составление химических формул по валентности. | 1 | КУ | Демонстрации: - видеофильм «Химия.8класс. ч.1 (Первоначальные химические понятия»);
| Знать определение понятия «валентность». Уметь определять валентность по формуле, состоящей из двух элементов, составлять формулы по валентности. | 04.10.13. |
|
| 2.13 | Определение химической формулы по валентности. | 1 | КУ |
| Знать определение понятия «валентность». Уметь составлять формулы по валентности. | 07.10.13. |
|
| 2.14 | Количество вещества. Моль – мера количества вещества. Молярная масса. | 1 | УИНЗ | Демонстрации: - некоторых веществ (металлов, неметаллов, их соединений) количеством 1 моль. | Знать определение количества вещества, моль, числа Авогадро. Уметь определять по формуле число молей по количеству структурных частиц и наоборот.
| 10.10.13. |
|
| 2.15 | Расчёты по химическим уравнениям. Решение типовых задач. | 1 | КУ | Демонстрации: - плакат «Количественные величины в химии». | Знать определение молярной массы, формулу для расчёта. Уметь вычислять массу данного вещества, если известно количество вещества, и наоборот. | 11.10.13. |
|
| 2.16 | Обобщение и систематизация знаний по теме: «Первоначальные химические понятия» | 1 | УПЗУ |
| умение быстро и четко формулировать свои мысли, применять знания в сходной ситуации.
| 14.10.13. |
|
| 2.17 | Контрольная работа №1. «Первоначальные химические понятия». | 1 | УК |
| Уметь применять знания, умения, навыки, полученные в ходе изучения данной темы, при выполнении к/р. | 17.10.13. |
|
|
| Тема 3. Химические реакции. Законы сохранения массы и энергии 8 часов |
|
|
|
|
|
|
| 3.1 | Сущность химических реакций и признаки их протекания. Тепловой эффект реакции. | 1 | УОНМ | Демонстрации: - сжигание в кислороде различных веществ Лабораторный опыт №5 Признаки протекания химических реакций. Примеры реакций протекающих с выделением газа, осадка, изменение цвета, появление запаха и т.д. | Знать понятие теплового эффекта, определение экзо- и эндотермических реакций. Уметь различать экзо- и эндотермические реакции, записывать тепловой эффект для данной реакции. | 18.10.13. |
|
| 3.2 | Расчёты по термохимическим уравнениям. | 1 | КУ | Демонстрации: плакат «Количественные величины в химии». | Уметь вычислять тепловой эффект по известной массе вещества, и наоборот. | 21.10.13. |
|
| 3.3 | Химические уравнения. Закон сохранения массы вещества. | 1 | КУ | Демонстрации: Опыт, иллюстрирующий закон сохранения массы веществ. | Знать основные положения атомно-молекулярного учения, роль М.В.Ломоносова и Д.Дальтона в создании этого учения. | 24.10.13. |
|
| 3.4 | Уравнения химических реакций. | 1 | КУ | Демонстрации: - компакт-диск «Вещества и их превращения». | Знать определение химических уравнений, значение коэффициента в химических уравнениях. Уметь составлять химические уравнения, расставлять коэффициенты.
| 25.10.13. |
|
| 3.5
| Составление уравнений химических реакций. | 1 | КУ | Демонстрации: - компакт-диск «Вещества и их превращения». | Знать определение химических уравнений, значение коэффициента в химических уравнениях. Уметь составлять химические уравнения, расставлять коэффициенты.
| 28.10.13. |
|
| 3.6 | Расчёты по химическим уравнениям. Решение типовых задач. | 1 | КУ | Демонстрации: - плакат «Количественные величины в химии». | Знать определение молярной массы, формулу для расчёта. Уметь вычислять массу данного вещества, если известно количество вещества, и наоборот. | 31.10.13. |
|
| 3.7 | Типы химических реакций. | 1 | КУ | Демонстрации: Горение серы в кислороде; Взаимодействие оксида меди(2) с серной кислотой. Лабораторный опыт №6 типы химических реакций. Реакции соединения, разложения, замещения, обмена. | Знать определение реакций разложения, соединения, замещения, обмена. Уметь определять типы химических реакций по химическим уравнениям. | 01.11.13. |
|
| 3.8 | Обобщение и систематизация знаний по теме: «Химические реакции». Самостоятельная работа. | 1 | УПЗУ |
| умение быстро и четко формулировать свои мысли, применять знания в сходной ситуации.
| 11.11.13. |
|
|
| Тема 4. Методы химии 3 часа |
|
|
|
|
|
|
| 4.1 | Методы химии: наблюдение, описание, измерение, эксперимент. Индикаторы.
| 1 | УОНМ |
| умение приводить при- меры методов, работать с учебником, по инструкции,
| 14.11.13. |
|
| 4.2 | Химический язык, его важнейшие функции в химической науке. | 1 | КУ | Лабораторный опыт №7 Изменение окраски индикаторов в разных средах. | пользоваться ПСХЭ для получения информации о химическом элементе. применять химический язык для описания уравнений химических реакций. | 15.11.13. |
|
|
| Тема 5. Вещества в окружающей нас природе и технике 9 часов |
|
|
|
|
|
|
| 5.1 | Чистые вещества и смеси. Способы разделения смесей. | 1 | КУ | Демонстрации: - однородные и неоднородные смеси; - (фильтрование, выпаривание, хромотография). Лабораторный опыт №8,9. - Приготовление смесей и разделение их. -Сравнение проб воды водопроводной и водоема.
| Знать отличие чистого вещества от смеси, способы разделения смесей, иметь представление о материалах. Уметь различать однородные и неоднородные смеси. | 18.11.13. |
|
| 5.2 | Практическая работа №2. «Очистка загрязнённой поваренной соли.» | 1 | УЗЗ | Практическая работа №2. | Знать правила обращения с лабораторным оборудованием, способы разделения однородных и неоднородных смесей. Уметь проводить разделение смесей фильтрованием и выпариванием. | 21.11.13. |
|
| 5.3 | Вода – растворитель. Растворы. Растворимость.
| 1 | КУ | Демонстрации: - очистка воды перегонкой; - разделение смесей веществ с помощью делительной воронки. | Знать способы очистки воды. Понятия «растворы», «растворитель», «дистиллированная вода», меры по охране воды от загрязнений. Уметь объяснять процесс растворения с точки зрения атомно-молекулярного учения. | 22.11.13. |
|
| 5.4 | Практическая работа № 3 «Растворимость веществ» | 1 | УЗЗ | Практическая работа №3. | Знать правила обращения с лабораторным оборудованием Уметь проводить растворимость веществ. | 25.11.13. |
|
| 5.5 | Концентрация растворов, массовая доля растворённого вещества. | 1 | УИНЗ | Демонстрации: - видеофильм «Химия. 8 класс. ч.3» (Вода, растворы, основания)
| Знать определение растворимости, массовой доли растворённого вещества. Уметь вычислять массовую долю и массу вещества в растворе. | 28.11.13. |
|
| 5.6 | Решение расчетных на нахождение массовой доли растворённого вещества. | 1 | УЗЗ |
| умение рассчитывать массовую долю р.в. и массу вещества в растворе, решать задачи по образцу.
| 29.11.13. |
|
| 5.7 | Практическая работа №4. «Приготовление раствора соли с определённой массовой долей вещества». | 1 | УЗЗ | Практическая работа | Уметь приготавливать раствор соли с определённой массовой долей растворённого вещества. Уметь решать задачи на определение массовой доли и массы растворённого вещества. | 02.12.13. |
|
| 5.8 | Химическая технология. Техносфера.
| 1 | КУ |
|
| 05.12.13. |
|
| 5.9 | Самостоятельная работа. | 1 | УЗЗ |
|
| 06.12.13. |
|
|
| Тема 6. Понятие о газах. Воздух. Кислород. Горение 9 часов |
|
|
|
|
|
|
| 6.1 | Понятие о газах. Закон Авогадро
| 1 | УИНЗ | Демонстрации: - плакат «Количественные величины в химии». | Знать определение закона Авогадро. Уметь вычислять объём газов по известной массе вещества, и наоборот. | 09.12.13. |
|
| 6.2 | Решение задач: расчеты на основании газовых законов | 1 | УПЗУ | Демонстрации: - плакат «Количественные величины в химии». | умение производить простейшие расчеты с использованием газовых законов.
| 12.12.13. |
|
| 6.3 | Воздух – смесь газов. | 1 | УОНМ | Демонстрации: - количественное определение содержания кислорода в воздухе; - опыты, выясняющие условия горения. | знание состава воздуха, постоянный и переменный состав воздуха, умение объяснять происхождение названия «инертные газы», расчиты-вать относительную плот-ность газов, | 13.12.13. |
|
| 6.4 | Расчёт относительная плотность газов | 1 | КУ | Демонстрации: - плакат «Количественные величины в химии». | Знать определение закона Авогадро. Уметь вычислять объём газов по известной массе вещества, и наоборот. | 16.12.13. |
|
| 6.5 | Кислород - химический элемент и простое вещество. Получение кислорода.
| 1 | КУ | Демонстрации: - получение кислорода из перманганата калия. | Знать способы получения кислорода в лаборатории и промышленности, понятие «катализатор», его роль, области применения.
| 19.12.13. |
|
| 6.6 – 6.7 | Получение кислорода. Решение задач по химическим уравнениям. | 2 | УЗЗ |
| Знать способы получения кислорода в лаборатории и промышленности, понятие «катализатор», его роль, области применения.
| 20.12.13. – 23.12.13. |
|
| 6.8 | Химические свойства и применение кислорода.
| 1 | КУ | ДО: сжигание серы, угля, железа в кислороде; воспламенение парафина | знание важнейших хим. cв-в О2, понятие окси-ды, применение О2. умение различать физи- ческие и химические свойства, наблюдать ДО, отмечать признаки х.р. и условия их осуществления, составлять уравнения х.р. | 26.12.13. |
|
| 6.9 | Обобщение и систематизация знаний по теме: «Воздух. Кислород. Горение.» Самостоятельная работа. | 1 | УПЗУ |
| умение быстро и четко формулировать свои мысли, применять знания в сходной ситуации.
| 27.12.13. |
|
|
| Тема 7. Основные классы неорганических соединений 16 часов |
|
|
|
|
|
|
| 7.1 | Состав и строение оксидов. Классификация. Названия.
| 1 | КУ | Демонстрации: - взаимодействие основных оксидов с кислотами; - ознакомление с образцами оксидов.
| Знать классификацию неорганических соединений, определение и классификацию оксидов, их строение, свойства. Уметь классифицировать по составу и свойствам неорганические вещества, доказывать химические свойства кислотных и основных оксидов, записывать уравнения реакций. | 30.12.13. |
|
| 7.2 | Состав и строение оснований. Классификация . Названия. | 1 | КУ | Демонстрации: - некоторых свойств оснований.
| Знать определение и классификацию оснований, физические свойства. Уметь доказывать химические свойства оснований, записывать уравнения реакций. | 13.01.14. |
|
| 7.3 | Состав и строение кислот. Классификация . Названия. | 1 | КУ | Демонстрации: - некоторых свойств кислот.
| Знать определение кислот, их классификацию, физические свойства. Уметь доказывать химические свойства кислот, записывать уравнения химических реакций. | 16.01.14. |
|
| 7.4 | Состав и строение солей. Названия. Номенклатура. | 1 | КУ | Демонстрации: - некоторых свойств солей.
| Знать определение и классификацию солей (некоторые способы получения солей). Уметь доказывать химические свойства солей, записывать уравнения реакций. | 20.01.14. |
|
| 7.5 | Химические свойства оксидов. Получение.
| 1 | УОНМ | Демонстрации: - взаимодействие основных оксидов с кислотами; - ознакомление с образцами оксидов. Лабораторный опыт№10: Рассмотрение образцов оксидов. Отношение оксидов к воде.
| знание химических свойств основных и кислотных оксидов. умение записывать уравнения реакций химических свойств оксидов записывать уравнения химических реакций по цепочкам превращений. | 23.01.14. |
|
| 7.6 | Химические свойства кислот. Получение.
| 1 | УОНМ | Демонстрации: - некоторых свойств кислот. Лабораторный опыт№11: - действие индикатора на растворы кислот; - взаимодействие кислот с металлами (железом, медью, цинком); - взаимодействие кислот с оксидами металлов. | определение понятия р. нейтрализации, ряд актив-ности Ме, химические свойства кислот. умение пользоваться рядом активности Ме при составлении уравнений реакций хим. свойств кислот, пользоваться таблицей растворимости,
| 24.01.14. |
|
| 7.7 | Химические свойства растворимых оснований. Получение.
| 1 | УОНМ | Демонстрации: - некоторых свойств оснований. Лабораторный опыт№12: - свойства растворимых и - взаимодействие щелочей с кислотами;
| определение понятий щелочи, нераствор-е основания, их химические свой-ва, способы получения щелочей при взаим-ии МеО с водой и получение нераст. оснований, р. обмена. умение записывать уравнения реакций хим. свойств щелочей и нерастворимых оснований распознавать растворы щелочей среди других, | 27.01.14. |
|
| 7.8 | Химические свойства нерастворимых оснований. Получение.
| 1 | УОНМ | Лабораторный опыт№13: - свойства нерастворимых оснований; - взаимодействие нерастворимых оснований с кислотами; - разложение гидроксида меди (II) при нагревании.
| определение понятий щелочи, нераствор-е основания, их химические свой-ва, способы получения щелочей при взаим-ии МеО с водой и получение нераст. оснований, р. обмена. умение записывать уравнения реакций хим. свойств щелочей и нерастворимых оснований распознавать растворы щелочей среди других, | 30.01.14. |
|
| 7.9 | Понятие об амфотерности | 1 | УОНМ | Лабораторный опыт№14: Амфотерность (оксид алюминия, гидроксид алюминия). | Знать определение и классификацию оснований, физические свойства. Уметь доказывать химические свойства оснований, записывать уравнения реакций. | 31.01.14. |
|
| 7.10 | Химические свойства солей. Получение.
| 1 | УОНМ | Демонстрации: - некоторых свойств солей.
| Знать определение и классификацию солей (некоторые способы получения солей). Уметь доказывать химические свойствасолей, записывать уравнения реакций. | 03.02.14. |
|
| 7.11 – 7.12 | Генетическая связь между классами неорганических веществ. | 2 | КУ | Демонстрации: - плакат «Связь между классами неорганических веществ» | Знать понятие генетической связи, уметь осуществлять превращения. Уметь применять ЗУН при выполнении тренировочных заданий и упражнений.
| 06.02.14. – 07.02.14. |
|
| 7.13 | Решение расчётных задач по химическим уравнениям. | 1 | УЗЗ | Демонстрации: - плакат «Количественные величины в химии». | умение производить расчёты по уравнениям химических реакций. | 10.02.14. |
|
| 7.14 | Практическая работа № 5. «Исследование свойств оксидов, оснований, кислот» | 1 | УЗЗ | Практическая работа | Уметь применять теоретические и практические ЗУН, полученные в ходе изучения темы 7, при выполнении практической работы. | 13.02.14. |
|
| 7.15 | Обобщение и систематизация знаний по теме 7. | 1 | УПЗУ | Демонстрации: - плакат «Связь между классами неорганических веществ» | Уметь применять ЗУН при выполнении тренировочных заданий и упражнений. Уметь составлять технологическую карту для п/р6. | 14.02.14. |
|
| 7.16 | Контрольная работа №3. по теме 7. | 1 | УК |
| Уметь применять теоретические и практические ЗУН, полученные при изучении темы , на контрольной работе. | 17.02.14. |
|
|
| Тема 8. Строение атома 4часов |
|
|
|
|
|
|
| 8.1 | Строение атома. Состав атомных ядер. | 1 | КУ | Демонстрации: - периодическая система; - транспаранты «Элементы и их свойства». | Знать строение атома, состав атомного ядра, определение изотопов, три вида излучений. Уметь описывать химический элемент с точки зрения строения атома, находить черты сходства и отличия у изотопов.
| 20.02.14. |
|
| 8.2 | Изотопы. Химические элементы.
| 1 | КУ | Демонстрации: - периодическая система; - транспаранты «Элементы и их свойства». | знание определение понятий «химический элемент» с т.з. строения атома, «изо- пы, протон, нейтрон, электрон, массовое число». умение характеризовать строение атома, приводить примеры изотопов, число протонов, нейтронов, электронов. . | 21.02.14. |
|
| 8.3 | Строение электронных оболочек атомов. | 1 | УИНЗ | Демонстрации: - периодическая система; - транспаранты «Электронные оболочки атомов»; - таблицы «Электронные оболочки атомов». | Знать расположение электронов по слоям, формы электронных орбиталей, знать о периодичеких изменениях химических свойств в зависимости от числа электронов в наружном слое. Уметь записывать строение атомов элементов первых четырёх периодов, записывать электронные формулы и электронные ячейки для атомов элементов этих периодов. | 24.02.14. |
|
| 8.4 | Состояние электронов в атомах. Периодическое изменение свойств химических элементов в периодах и в главных подгруппах. | 1 | УИНЗ | Демонстрации: - периодическая система; - транспаранты «Электронные оболочки атомов»; - таблицы «Электронные оболочки атомов». | Знать формы электронных орбиталей, знать о периодичеких изменениях химических свойств в зависимости от числа электронов в наружном слое. Уметь записывать электронные формулы и электронные ячейки для атомов элементов этих периодов. | 27.02.14. |
|
|
| Тема 9. Периодический закон и периодическая система элементов Д. И. Менделеева. 6часов |
|
|
|
|
|
|
| 9.1 | Классификация химических элементов. Строение атомов малых и больших периодов.
| 1 | УОНМ |
| умение формулировать ПЗ, делать выводы. | 28.02.14. |
|
| 9.2 | Свойства химических элементов и их периодические изменения. Периодический закон.
| 1 | УОНМ |
| умение формулировать ПЗ, делать выводы. | 03.03.14. |
|
| 9.3 | Периодический закон Д.И. Менделеева в свете теории строения атома. | 1 | УИНЗ | Демонстрации: - периодическая система; - транспаранты «Элементы и их свойства». | Знать определение периодического закона, определение периода, значение порядкового номера (физический смысл), определение периода, физический смысл номера периода, определение группы, физический смысл номера группы. Уметь объяснять изменение свойств элементов и их соединений, знать причину этого ,описывать химические элементы, исходя из положения в периоде и в группе с учётом строения атома, объяснять изменение свойств в периоде в группе (главной подгруппе).
| 06.03.14. |
|
| 9.4 | Периодическая система химических элементов в свете строения атома. | 1 | УИНЗ | Демонстрации: - периодическая система; - транспаранты «Элементы и их свойства». | Знать определение периодического закона, определение периода, значение порядкового номера (физический смысл), определение периода, физический смысл номера периода, определение группы, физический смысл номера группы. Уметь объяснять изменение свойств элементов и их соединений, знать причину этого ,описывать химические элементы, исходя из положения в периоде и в группе с учётом строения атома, объяснять изменение свойств в периоде в группе (главной подгруппе).
| 07.03.14. |
|
| 9.5 | Характеристика химических элементов главной подгруппы на основании положения в периодической системе и строения атома. | 1 | КУ | Демонстрации: - периодическая система; - план характеристики химического элемента. | Уметь давать характеристику по плану данного химического элемента главной подгруппы по его положению в периодической системе и строению атома. | 10.03.14. |
|
| 9.6 | Значение периодического закона. Жизнь и деятельность Д.И. Менделеева. | 1 | КУ | Демонстрации: - видеофильм «М.В.Ломоносов. Д.И.Менделеев». | Знать роль периодического закона для развития науки, техники, для обобщения известных фактов и открытия новых; знать основные этапы жизни и деятельности Д.И.Менделеева. Уметь доказывать основные положения диалектики на примере периодической системы и строения атома. | 13.03.14. |
|
|
| Тема 10. Строение вещества 8часов. |
|
|
|
|
|
|
| 10.1 | Валентные состояния и химические связи атомов элементов | 1 | УОНМ |
| определение понятия валентность, химическая связь. определение понятий валентные электроны. записывать электронные и эл. графические формулы атомов элементов. определять валентные возможности атомов. | 14.03.14. |
|
| 10.2- 10.3 | Химическая связь Типы химических связей: ковалентная (полярная, неполярная), механизм ее образования. | 2 | УИНЗ | Демонстрации: - таблица по типам связи. | Знать определение электроотрицательности ,определение химической связи, ковалентная полярная и неполярная связи, механизм образования связи, энергия связи. Уметь определять различные виды ковалентной связи, записывать схемы образования веществ с ковалентной полярной и неполярной связью. . | 17.03.14.- 20.03.14. |
|
| 10.4 | Ионная связь (понятие о степени окисления). | 1 | КУ | Демонстрации: - таблица по типам связи. | Знать определение ионной связи, механизм образования связи, понятие о степени окисления. Уметь определять ионную и ковалентную связи в различных веществах, записывать схемы образования веществ с ионной связью.
| 21.03.14. |
|
| 10.5 | Кристаллические решетки. | 1 | КУ | Демонстрации: - «Составление моделей веществ с различной кристаллической решеткой». | Знать определение кристаллической решётки, типы кристаллических решёток. Уметь определять типы кристаллических решёток. | 31.03.14. |
|
| 10.6 | Степень окисления. Правила определения степеней окисления элементов. | 1 | УИНЗ | Демонстрации: - таблица степени окисления. | Знать определение степени окисления. Уметь определять степень окисления элементов в различных веществах. | 03.04.14. |
|
| 10.7 | Обобщение и систематизация знаний по теме 8,9,10. | 1 | УПЗУ | Демонстрации: - видеофильм «Химия. 8 класс» | Уметь применять знания, умения, навыки, полученные при изучении темы 7, при выполнении тренировочных заданий и упражнений.
| 04.04.14. |
|
| 10.8 | Контрольная работа №4. по темам 8,9,10. | 1 | УК |
| Уметь применять теоретические и практические знания, умения, навыки, полученные при изучении тем 6,7 на контрольной работе. | 07.04.14. |
|
|
| Тема 11. Химические реакции в свете электронной теории 6 часов. |
|
|
|
|
|
|
| 11.1 – 11.2 | Степень окисления. Процессы окисления и восстановления. Окислительно-восстановительные реакции. | 2 | КУ | Демонстрации: - транспаранты «Процессы окисления-восстановления». | Знать определение окислительно-восстановительной реакции, окислителя, восстановителя. Уметь определять окислительно-восстановительные реакции, составлять схему электронного баланса, расставлять коэффициенты, используя метод электронного баланса. | 10.04.14.- 11.04.14. |
|
| 11.3- 11.4 | Составление уравнение окислительно - восстановительных реакций | 2 | КУ | Демонстрации: - транспаранты «Процессы окисления-восстановления». | Знать определение окислительно-восстановительной реакции, окислителя, восстановителя. Уметь определять окислительно-восстановительные реакции, составлять схему электронного баланса, расставлять коэффициенты, используя метод электронного баланса. | 14.04.14. – 17.04.14. |
|
| 11.5 | Сущность и классификация химических реакций в свете электронной теории. | 1 | КУ | Демонстрации: - транспаранты «Процессы окисления-восстановления». | представление о клас-сификации х.р. на уровне АМУ и электронных представлений умение применять при- обретенные знания о типах х.р., классифицировать х.р.
| 18.04.14. |
|
| 11.6 | Самостоятельная работа. | 1 | УЗЗ |
|
| 21.04.14. |
|
|
| Тема 12. Водород, рождающий воду и энергию 6часов. |
|
|
|
|
|
|
| 12.1 – 12.2 | Водород-элемент и простое вещество. Получение водорода.
| 2 | КУ | Демонстрации: - получение водорода при взаимодействии раствора кислоты с цинком. | Знать области применения водорода и способы получения его в лаборатории и в промышленности. Уметь собирать водород вытеснением воздуха, доказывать его наличие, проверять на чистоту. | 24.04.14. – 25.04.14. |
|
| 12.3 | Химические свойства водорода | 1 | КУ | Демонстрации: - ознакомление с физическими свойствами водорода; - горение водорода в кислороде; -взаимодействие водорода с оксидом меди(2). | Знать состав молекулы водорода, определение восстановителя. Уметь давать характеристику водорода как элемента и как простого вещества, описывать физические и химические свойства водорода, записывать уравнения реакций. | 28.04.14. |
|
| 12.4 | Практическая работа №6 «Получение водорода и исследование его свойств». | 1 | УЗЗ | Практическая работа |
| 02.05.14. |
|
| 12.5 | Вода-оксид водорода. Применение водорода и воды.
| 1 | КУ | Демонстрации: - синтез воды; - взаимодействие воды с металлами (натрием, кальцием); - взаимодействие воды с оксидами кальция и фосфора; - исследование полученных растворов с помощью индикаторов. | Знать количественный и качественный состав воды. Состав основания, химические и физические свойства воды, понятие об анализе и синтезе как методах определения состава веществ. Уметь составлять уравнения реакций, доказывать химические свойства воды. | 05.05.14. |
|
| 12.6 | Пероксид водорода. | 1 | КУ |
|
| 08.05.14. |
|
|
| Тема 13. Галогены - естественное семейство химических элементов 5 часов |
|
|
|
|
|
|
| 13.1 | Положение галогенов в периодической системе элементов и строение их атомов. Валентные возможности атомов. | 1 | УИНЗ | Демонстрации: - видеофильм «Химия. 8 класс»
| Знать положение галогенов в периодической системе элементов и строение их атомов. Уметь писать уравнения реакций с участием хлора. | 12.05.14. |
|
| 13.2 | Галогены -простые вещества. Физико-химические свойства галогенов. | 1 | КУ | Демонстрации: - видеофильм «Химия. 8 класс»
| Знать положение галогенов в периодической системе элементов и строение их атомов. Уметь писать уравнения реакций с участием хлора. | 15.05.14. |
|
| 13.3 | Хлороводород, получение, свойства. Соляная кислота и ее соли.
| 1 | УИНЗ | Лабораторный опыт№15: - Свойства соляной кислоты. распознавание соляной кислоты, хлоридов, бромидов, иодидов и иода. Лабораторный опыт№16: Качественные реакции на галогениды. | Знать положение галогенов в периодической системе элементов и строение их атомов. Уметь писать уравнения реакций с участием соляной кислоты. | 16.05.14. |
|
| 13.4 | Галогениды . Соли соляной кислоты. | 1 | УОНМ | Лабораторный опыт№17: -. распознавание соляной кислоты, хлоридов, бромидов, иодидов и иода.
| Знать положение галогенов в периодической системе элементов и строение их атомов. Уметь писать уравнения реакций с участием соляной кислоты. | 19.05.14. |
|
| 13.5 | Практическая работа №7. «Получение соляной кислоты и её свойства». | 1 | УЗЗ | Практическая работа | Уметь получать соляную кислоту.
| 22.05.14. |
|
|
| Тема 14. Обобщение знаний о наиболее важных характеристиках веществ и химических процессов 4часа |
|
|
|
|
|
|
| 14.1 | Характеристика атома на основе его положения в периодической системе.
|
|
|
|
| 23.05.14. |
|
| 14.2 | Свойства основных классов неорганических соединений.
|
|
|
|
| 26.05.14. |
|
| 14.3 | Типы реакций.
|
|
|
|
| 29.05.14. |
|
| 14.4 | Итоговая контрольная работа |
|
|
|
| 30.05.14. |
|

 Получите свидетельство
Получите свидетельство Вход
Вход











 Рабочая программа по химии (8 класс) (94.6 КB)
Рабочая программа по химии (8 класс) (94.6 КB)
 0
0 1112
1112 37
37 Нравится
0
Нравится
0


