Муниципальное общеобразовательное учреждение
«Средняя общеобразовательная школа №3»
г. Тырныауза
РАБОЧАЯ ПРОГРАММА
| Предмет | ХИМИЯ |
| Класс | 11 |
| Образовательная область | ЕСТЕСТВОЗНАНИЕ |
| ШМО | УЧИТЕЛЕЙ ЕСТЕСТВЕННЫХ НАУК |
| Учебный год | 2015-2016 |
| Учитель | АФАШОКОВА М.З. |
2015 г.
ПРОГРАММА КУРСА ХИМИИ
для 11 класса
общеобразовательных учреждений
ПОЯСНИТЕЛЬНАЯ ЗАПИСКА
Базовый уровень
Рабочие программы по курсу химия для 11 класса разработана на основе Федерального компонента государственного стандарта основного и среднего общего образования, утвержденного приказом Минобразования России от 5 марта 2004 г. № 1089., к настоящей программе, составленной для учащихся химии 11 класса был добавлен 1ч. для завершения предметной линии и подготовки, учащихся к сдачи ЕГЭ. Программа рассчитана на 68 ч/год (2 ч/нед.).
Данный курс учащиеся изучают после курса химии для 8-9 классов, где они познакомились с важнейшими химическими понятиями, неорганическими веществами, применяемыми в промышленности и в повседневной жизни.
Изучение химии в основной школе направлено на достижение следующих целей и задач:
на освоение знаний о химической составляющей естественно - научной картины мира, о важнейших химических понятиях, законах и теориях;
на овладение умениями применять полученные знания для объяснения разнообразных химических явлений и свойств веществ, для оценки роли химии в развитии современных технологий и получение новых материалов;
на развитие познавательных интересов и интеллектуальных способностей в процессе самостоятельного приобретения химических знаний с использованием различных источников информации, в том числе компьютерных;
на воспитание убежденности в позитивной роли химии в жизни современного общества, необходимости химически грамотного отношения к своему здоровью и окружающей среде;
на применение поученных знаний и умений для безопасного использования веществ и материалов в быту, сельском хозяйстве и на производстве, для решения практических задач в повседневной жизни, для предупреждения явлений, наносящих вред здоровью человека и окружающей среде.
Данная программа предусматривает формирование у учащихся общеучебных умений и навыков, универсальных способов деятельности и ключевых компетенций. В этом направлении приоритетами для учебного предмета “химия” в старшей школе на базовом уровне являются: умение самостоятельно и мотивированно организовывать свою познавательную деятельность (от постановки цели до получения и оценки результата); определение сущностных характеристик изучаемого объекта; умение развернуто обосновывать суждения, давать определения, приводить доказательства; оценивание и корректировка своего поведения в окружающей среде; выполнение в практической деятельности и в повседневной жизни экологических требований; использование мультимедийных ресурсов и компьютерных технологий для обработки, передачи, систематизации информации, создания баз данных, презентации результатов познавательной и практической деятельности. В данном курсе 11 класса систематизируются, обобщаются и углубляются знания о раннее изученных теориях и законах химической науки, химических процессах и производствах.
Программа предусматривает преподавание предмета по учебнику:
I. Нормативные документы, обеспечивающие реализацию программы
| № п/п | Наименование документа |
| 1. | Федеральный компонент Государственного стандарта общего образования, от 5 марта 2004г. |
| 2. | Примерные программы среднего (полного) образования по химии. |
| 3. | Авторская программа, разработанная Гара Н.Н., 2008г. |
II. Учебно–методический комплект
| № п/п | Наименование УМК |
| I. 1) | Учебник: Рудзитис Г.Е., Фельдман Ф.Г. “Химия 11 класс”, общеобразовательных учреждений. - М.: Просвещение, 2014г. |
| 2) | Методическое пособие для учителя: А.А. Каверина, Д.Ю. Добротин, А.С. Корощенко, Ю.Н. Медведев “ЕГЭ. Химия. Сборник заданий”. – М.: Просвещение, Эксмо, 2006г. А.М. Радецкий, Х.Н. Курьянова “Дидактический материал по химии 11 классы”. – М.: Просвещение, 2008г. А.С. Егоров “Химия. Пособие – репетитор”. – Ростов-на-Дону: Феникс, 2007г. А.С. Корощенко, М.г. Снастина “Самое5 полное издание типовых вариантов реальных заданий ЕГЭ 2010”. – М.: АСТ: Астрель, 2009г. В.В. Еремин, Н.Е. Кузьменко “Сборник задач и упражнений по химии: школьный курс”. – М.: ОНИКС 21 век, Мир и Образование, 2005г. В.Н. Доронькин “Универсальный задачник по химии для поступающих в ВУЗы и школьников”. – М.: Ростов-на-Дону, МарТ, 2004г. В.Н. Доронькин, А.Г. Бережная, Т.В. Сажнева, В.А. Февралева “Химия. ЕГЭ-2008. Базовый и повышенный уровень (А1-А30, В1-В10)”. Ростов-на-Дону: Легион, 2008г. Г.А. Савин “Олимпиадные задания по органической химии. 10-11 классы”. – Волгоград: Учитель, 2004г. Г.А. Савин “Олимпиадные задания по органической химии. 9-10 классы”. – Волгоград: Учитель, 2004г. Габриелян О.С., Лысова Г.Г. “Химия 11 класс”, - М.: Дрофа, 2011г. Е.Л. Касатикова “Химия в табл. и схемах”. – Санкт-Петербург, Виктория плюс, 2009г. И.Г. Хомченко “Сборник задач и упражнений по химии для поступающих в ВУЗы”. – М.: Новая Волна, 2005г. И.Г. Хомченко “Сборник задач и упражнений по химии для средней школы”. – М.: Новая Волна, 2005г. И.И. Новошинский, Н.С. Новошинская “Типы химических задач и способы их решения 8-11 классы”. - М.: ОНИКС 21 век, Мир и Образование, 2005г. Н.Е. Кузьменко, В.В. Еремин “2500 задач по химии с решениями для поступающих в ВУЗы”. - М.: ОНИКС 21 век, Мир и Образование, 2005г. Н.Е. Кузьменко, В.В. Еремин “Тесты по химии. 8-11 классы”. – М.: Экзамен, 2006г. Н.Е. Кузьменко, В.В. Еремин, В.А. Попов “Начало химии: современный курс для поступающих в ВУЗы”. – М.: I Федеративная книготорговая компания, 2002г. Н.П. Гаврусейко “Проверочные работы по органической химии 11 классы”. – М.: Просвещение, 1991г. О.С. Габриелян, Г.Г. Лысова “Химия. 11 класс. Профильный уровень”. – М.: Дрофа, 2009г. |
Место предмета в базисном учебном плане:
Для обозначения учебного предмета «Химия» на этапе основного общего образования федеральный базисный учебный план для общеобразовательных учреждений РФ отводится 138 часов: по 68 часов в 8-9 классах (2 ч/нед.).
Федеральный базисный план для общеобразовательных учреждений РФ отводится 138 часов для обязательного изучения предмета «Химия» на этапе среднего (полного) общего образования на базовом уровне: по 68 часов в 10-11 классах (2 ч/нед.).
III. Цели изучения курса
| Компетенции |
| Общеучебные | Универсальные – общеучебное умение организовать свою деятельность, определять ее цели и задачи, выбирать средства реализации цели и применять их на практике, взаимодействовать в группе в достижении общих целей, развитие универсальных умений, проводить мыслительные операции: обобщение, анализ, синтез, сравнение, доказательство, абстрагирование, конкретизация, развитие мышления самостоятельности в суждениях, навыки самостоятельной работы. |
| Коммуникативные – формирование представления об общей теории коммуникации, в том числе социальной, языковое и речевое развитие человека, использование языков и других средств коммуникаций, позволяющих закреплять, хранить и передавать информацию. |
| Информационные – умение работать с разными источниками информации: учебными текстами, справочниками, научно–популярными изданиями, ресурсами Интернет и критически их оценивать. |
| Предметно-ориентированные | В курсе 11 класса в основном закрепляются и углубляются знания по общей и неорганической химии: периодический закон и Периодическая система химических элементов Д,И. Менделеева в свете учения о строении атома, строение вещества, закономерности протекания химических реакций, основные сведения о металлах и неметаллах, строении и свойствах их соединений, экологические аспекты применения неорганических веществ. |
IV. Структура курса
| № | Модуль (глава) | Количество часов |
| 1. | Неорганическая химия. Периодический закон и периодическая система химических элементов Д.И. Менделеева. | 6ч |
| 2. | Химическая связь и строение веществ. | 6ч |
| 3. | Химические реакции. | 8ч |
| 4. | Неметаллы. | 15ч |
| 5. | Металлы. | 16ч |
| 6. | Обзорные материалы по курсу органической химии. | 17ч |
Перечень контрольно-проверочных работ.
| № | Модуль (глава) | Виды КПР | Сроки проведения |
| 1. | Химическая связь и строение веществ. | Контрол. работа |
|
| 2-3. | Химические реакции. Неметаллы. | Контрол. работа |
|
| 4. | Металлы. | Контрол. работа |
|
| 5-6. | Обзорные материалы по курсу органической химии. | Контрол. работа |
|
Перечень практических работ
Практическая работа №1 “Приготовление растворов с заданной молярной концентрацией”.
Практическая работа №2. “Влияние различных факторов на скорость химической реакции”.
Практическая работа №3 “Решение экспериментальных задач по неорганической химии”.
Практическая работа №5. “Решение практических расчетных задач”.
Практическая работа №6. “Получение, собирание и распознавание газов из курса неорганической химии”.
Практическая работа №4 “Решение экспериментальных задач по органической химии”.
Практическая работа №7. “Получение газообразных углеводородов в лабораторных условиях”.
Материально-техническое обеспечение образовательного процесса:
Печатные пособия:
Таблицы:
Периодическая система химических элементов Д.И. Менделеева.
Таблица растворимости кислот, оснований, солей в воде.
Портреты ученых.
Строение атома.
Типы химических связей.
Электрохимический ряд напряжения металлов.
ИКТ: Химия. Мультимедийное пособие нового образца. 11 класс.
Технические средства обучения:
Компьютер
Проектор
Интерактивная доска.
Учебно-практическое и учебно-лабораторное оборудование: приборы, приспособления (комплект посуды и принадлежностей для проведения практических работ); реактивы и материалы (комплект реактивов для базового уровня).
ТРЕБОВАНИЯ К УРОВНЮ ПОДГОТОВКИ ВЫПУСКНИКОВ
(11 классы)
В результате изучения химии на базовом уровне ученик должен знать / понимать:
Важнейшие химические понятия: вещество, химический элемент, атом, молекула, относительные атомная и молекулярная массы, ион, аллотропия, изотопы, химическая связь, Электроотрицательность, валентность, степень окисления, моль, молярная масса, молярный объем, вещества молекулярного и немолекулярного строения, растворы, электролит и неэлектролит, электролитическая диссоциация, окислитель и восстановитель, окисление и восстановление, тепловой эффект реакции, скорость химической реакции, катализ, химическое равновесие, углеродный скелет, функциональная группа, изомерия, гомология.
Основные законы химии: сохранения массы веществ, постоянства состава, периодический закон.
Основные теории химии: химической связи, электролитической диссоциации, строения органических соединений.
Важнейшие вещества и материалы: основные металлы и сплавы, серная, соляная, азотная и уксусная кислоты, щелочи, аммиак, минеральные удобрения, метан, этилен, ацетилен, бензол, этанол, жиры, мыла, глюкоза, сахароза, крахмал, клетчатка, белки, искусственные и синтетические волокна, каучуки, пластмассы.
Уметь:
Называть изученные вещества по тривиальной или международной номенклатуре.
Определять валентность и степень окисления химических элементов, тип химической связи в соединениях, заряд иона, харак4тер среды в водных растворах неорганических соединений, окислитель и восстановитель, принадлежность веществ к различным классам органических соединений.
Характеризовать элементы малых периодов по их положению в периодической системе Д.И. Менделеева; общие химические свойства металлов, неметаллов, основных классов неорганических и органических соединений.
Объяснять зависимость свойств веществ от их состава и строения, природу химической связи (ионной, ковалентной, металлической), зависимость скорости химической реакции и положения химического равновесия от различных факторов.
Выполнять химический эксперимент по распознаванию важнейших неорганических и органических веществ.
Проводить самостоятельный поиск химической информации с использованием различных источников (научно-популярных изданий, компьютерных баз данных, Интернет-ресурсов).
Использовать компьютерные технологии для обработки и передачи химической информации и ее представления в различных формах.
Использовать приобретенные знания и умения в практической деятельности и повседневной жизни с целью:
Объяснения химических явлений, происходящих в природе, быту и на производстве.
Определения возможности протекания химических превращений в различных условиях и оценки их последствий.
Экологически грамотного поведения в окружающей среде.
Оценки влияния химического загрязнения окружающей среды на организм человека и другие живые организмы.
Безопасного обращения с горючими и токсичными веществами, лабораторным оборудованием.
Приготовления раствора заданной концентрации в быту и на производстве.
Критической оценки достоверности химической информации.
Список литературы
Рудзитис Г.Е., Фельдман Ф.Г. “Химия 11 класс”, общеобразовательных учреждений. - М.: Просвещение, 2014г.
А.А. Каверина, Д.Ю. Добротин, А.С. Корощенко, Ю.Н. Медведев “ЕГЭ. Химия. Сборник заданий”. – М.: Просвещение, Эксмо, 2006г.
А.М. Радецкий, Х.Н. Курьянова “Дидактический материал по химии 11 классы”. – М.: Просвещение, 2008г.
А.С. Егоров “Химия. Пособие – репетитор”. – Ростов-на-Дону: Феникс, 2007г.
А.С. Корощенко, М.г. Снастина “Самое5 полное издание типовых вариантов реальных заданий ЕГЭ 2010”. – М.: АСТ: Астрель, 2009г.
В.В. Еремин, Н.Е. Кузьменко “Сборник задач и упражнений по химии: школьный курс”. – М.: ОНИКС 21 век, Мир и Образование, 2005г.
В.Н. Доронькин “Универсальный задачник по химии для поступающих в ВУЗы и школьников”. – М.: Ростов-на-Дону, МарТ, 2004г.
В.Н. Доронькин, А.Г. Бережная, Т.В. Сажнева, В.А. Февралева “Химия. ЕГЭ-2008. Базовый и повышенный уровень (А1-А30, В1-В10)”. Ростов-на-Дону: Легион, 2008г.
Г.А. Савин “Олимпиадные задания по органической химии. 10-11 классы”. – Волгоград: Учитель, 2004г.
Г.А. Савин “Олимпиадные задания по органической химии. 9-10 классы”. – Волгоград: Учитель, 2004г.
Габриелян О.С., Лысова Г.Г. “Химия 11 класс”, - М.: Дрофа, 2011г.
Е.Л. Касатикова “Химия в табл. и схемах”. – Санкт-Петербург, Виктория плюс, 2009г.
И.Г. Хомченко “Сборник задач и упражнений по химии для поступающих в ВУЗы”. – М.: Новая Волна, 2005г.
И.Г. Хомченко “Сборник задач и упражнений по химии для средней школы”. – М.: Новая Волна, 2005г.
И.И. Новошинский, Н.С. Новошинская “Типы химических задач и способы их решения 8-11 классы”. - М.: ОНИКС 21 век, Мир и Образование, 2005г.
Н.Е. Кузьменко, В.В. Еремин “2500 задач по химии с решениями для поступающих в ВУЗы”. - М.: ОНИКС 21 век, Мир и Образование, 2005г.
Н.Е. Кузьменко, В.В. Еремин “Тесты по химии. 8-11 классы”. – М.: Экзамен, 2006г.
Н.Е. Кузьменко, В.В. Еремин, В.А. Попов “Начало химии: современный курс для поступающих в ВУЗы”. – М.: I Федеративная книготорговая компания, 2002г.
Н.П. Гаврусейко “Проверочные работы по органической химии 11 классы”. – М.: Просвещение, 1991г.
О.С. Габриелян, Г.Г. Лысова “Химия. 11 класс. Профильный уровень”. – М.: Дрофа, 2009г.
ОБРАЗОВАТЕЛЬНЫЙ МИНИМУМ СОДЕРЖАНИЯ ОСНОВНОЙ ОБРАЗОВАТЕЛЬНОЙ ПРОГРАММЫ
ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ХИМИИ
Тема 1. Периодический закон и периодическая система химических элементов Д.И. Менделеева (6ч).
Атомные орбитали, s-, p-, d- и f-электроны. Особенности размещения электронов по орбиталям в атомах малых и больших периодов. Энергетические уровни, подуровни. Связь ПЗ и ПС химических элементов с теорией строения атомов. Положение в ПС химических элементов Д.И. Менделеева водорода, лантаноидов, актиноидов и искусственно полученных элементов.
Валентность и валентные возможности атомов. Периодическое изменение валентности и размеров атомов.
Расчетные задачи: Вычисления массы, объема или количеству вещества одного из вступивших в реакцию или получившихся в результате реакции.
Тема 2. Химическая связь и строение веществ (6ч).
Химическая связь. Виды и механизмы образования химической связи. Ионная связь. Катионы и анионы. Ковалентная полярная связь. ЭО. СО. Металлическая связь. Водородная связь. Пространственное строение молекул неорганических и органических веществ.
Типы кристаллических решеток и свойства веществ.
Дисперсные системы. Истинные растворы. Способы выражения концентрации растворов: массовая доля растворенного вещества, молярная концентрация. Коллоидные растворы. Золи, гели.
Демонстрации: Типы кристаллических решеток: ионные, атомные, молекулярные и металлические.
Практические занятия: Приготовление растворов с заданной молярной концентрацией.
Расчетные задачи: Вычисление массы (ν, V) продукта реакции, если для его получения дан раствор с определенной массовой долей исходного вещества.
Тема 3. Химические реакции (8ч).
Атом. Химический элемент. Изотопы. Простые и сложные вещества.
Закон сохранения массы веществ, закон сохранения и превращения энергии при химических реакциях, закон постоянства состава. Вещества молекулярного и немолекулярного строения.
Классификация химических реакций в неорганической химии.
Скорость реакции, ее зависимость от различных факторов. Закон действия масс. Энергия активации. Катализ и катализаторы. Обратимость реакций. Химическое равновесие. Смещение равновесия под действием различных факторов. Принцип Ле Шателье. Производство серной кислоты контактным способом. Электролитическая диссоциация. Сильные и слабые электролиты. Кислотно-основные взаимодействия в растворах. Среда водных растворов: кислая, щелочная и нейтральная. Электролиз.
Демонстрации: Зависимость скорости реакции от концентрации и температуры. Определение среды раствора с помощью универсального индикатора.
Лабораторные опыты: Проведение реакций ионного обмена для характеристики свойств электролитов.
Практические занятия: Влияние различных факторов на скорость химической реакции.
Расчетные задачи: Вычисление массы (ν, V) продукта реакции, если известна масса исходного вещества, содержащего определенную долю примесей.
НЕОРГАНИЧЕСКАЯ ХИМИЯ
Тема 4. Неметаллы (1503ч).
Обзор свойств неметаллов. Окислительно-восстановительн06ые свойства типичных неметаллов. Оксиды неметаллов и кислородсодержащие кислоты. Водородные со10единения неметаллов.
Демонстрации: Образцы неметаллов. Образцы оксидов нем13еталлов и кислородсодержащих кислот. Горение серы, фосфора, железа, магния в кислороде.
Лабораторные опыты: Знакомство с образцами неметаллов и их природными соединениями. Распознавание хлоридов, сульфатов, карбонатов.
Тема 5. Металлы (16ч).
Положение металлов в ПС химических элементов Д.И. Менделеева. Общие свойства металлов. Электрохимический ряд напряжения металлов. Электролиз растворов и расплавов. Понятие о коррозии металлов. Способы защиты от коррозии.
Обзор металлов главных подгрупп (А-групп) ПС химических элементов.
Обзор металлов побочных подгрупп (Б-групп) ПС химических элементов (медь, цинк, титан, хром, железо, никель, платина).
Сплавы металлов.
Оксиды и гидроксиды металлов.
Демонстрации: Ознакомление с образцами металлов и их соединений. Взаимодействие щелочных и щелочноземельных металлов с водой. Взаимодействие меди с кислородом и серой. Коррозия металлов и защита от нее.
Лабораторные опыты: Взаимодействие цинка и железа с растворами кислот и щелочей. Знакомство с образцами металлов и их рудами.
Расчетные задачи: Расчеты по химическим уравнениям, связанные с массовой долей выхода продукта реакции от теоретически возможного.
Тема 6. Обзорные материалы по курсу органической химии (17ч).
Первоначальные представления об органических веществах. Первоначальные сведения о строении органических веществ. Основные положения теории строения органических соединений А.М. Бутлерова. Изомерия. Упрощенная классификация органических соединений.
Углеводороды. Предельные углеводороды. Метан, этан. Физические и химические свойства. Применение.
Непредельные углеводороды. Этилен. Физические и химические свойства. Применение. Ацетилен. Диеновые углеводороды.
Понятие о циклических углеводородах (Циклоалканы, бензол).
Природные источники углеводородов. Нефть и природный газ, их применение. Защита атмосферного воздуха от загрязнения.
Демонстрации: Модели молекул органических соединений. Горение углеводородов и обнаружение продуктов их горения.
Лабораторные опыты: Получение гидроксида алюминия и взаимодействие гидроксидов железа (II) и железа (III) и взаимодействие их с кислотами и щелочами.
Расчетные задачи: Установление простейшей формулы вещества по массовым долям элементов.
Спирты. Одноатомные спирты. Метанол, этанол. Физические свойства. Физиологическое действие спиртов на организм. Применение.
Многоатомные спирты. Этиленгликоль. Глицерин. Применение.
Демонстрации: Количественный опыт выделения водорода из этилового спирта. Растворение этилового спирта в воде. Растворение глицерина в воде. Качественные реакции на многоатомные спирты.
Карбоновые кислоты. Жиры. Муравьиная кислота и уксусная кислоты. Физические свойства. Применение.
Высшие карбоновые кислоты. Стеариновая кислота.
Жиры – продукты и свойства взаимодействия глицерина и высших карбоновых кислот. Роль жиров в процессе обмена веществ в организме.
Демонстрации: Получение и свойства уксусной кислоты. Исследование свойств жиров.
Углеводы. Глюкоза, сахароза – важнейшие представители углеводов. Нахождение в природе. Фотосинтез. Роль глюкозы в питании и укреплении здоровья.
Крахмал и целлюлоза – природные полимеры. Нахождение в природе. Применение.
Демонстрации: Качественные реакции на глюкозу и крахмал.
Белки. Полимеры. Белки – биополимеры. Состав белков. Функции белков. Роль белков в питании. Понятие о ферментах и гормонах.
Полимеры – ВМС. Полиэтилен. Полипропилен. Поливинилхлорид. Применение полимеров.
Химия и здоровье. Лекарства.
Демонстрации: Качественные реакции на белок. Ознакомление с образцами изделий из полиэтилена, полипропилена, поливинилхлорида.
Календарное - тематическое планирование 11 класс
| № п/п | Тема урока | Тип урока | Подготовка к ЕГЭ | Измерители (вид контроля) | Д/З | Дата проведения |
| Планир. | Фактич. |
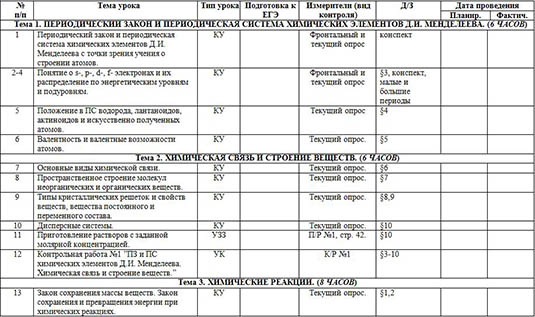
| Тема 1. ПЕРИОДИЧЕСКИЙ ЗАКОН И ПЕРИОДИЧЕСКАЯ СИСТЕМА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ Д.И. МЕНДЕЛЕЕВА. (6 ЧАСОВ) |
| 1 | Периодический закон и периодическая система химических элементов Д.И. Менделеева с точки зрения учения о строении атомов. | КУ |
| Фронтальный и текущий опрос | конспект |
|
|
| 2-4 | Понятие о s-, p-, d-, f- электронах и их распределение по энергетическим уровням и подуровням. | КУ |
| Фронтальный и текущий опрос | §3, конспект, малые и большие периоды |
|
|
| 5 | Положение в ПС водорода, лантаноидов, актиноидов и искусственно полученных атомов. | КУ |
| Текущий опрос | §4 |
|
|
| 6 | Валентность и валентные возможности атомов. | КУ |
| Текущий опрос. | §5 |
|
|
| Тема 2. ХИМИЧЕСКАЯ СВЯЗЬ И СТРОЕНИЕ ВЕЩЕСТВ. (6 ЧАСОВ) |
| 7 | Основные виды химической связи. | КУ |
| Текущий опрос. | §6 |
|
|
| 8 | Пространственное строение молекул неорганических и органических веществ. | КУ |
| Текущий опрос. | §7 |
|
|
| 9 | Типы кристаллических решеток и свойств веществ, вещества постоянного и переменного состава. | КУ |
| Текущий опрос. | §8,9 |
|
|
| 10 | Дисперсные системы. | КУ |
| Текущий опрос. | §10 |
|
|
| 11 | Приготовление растворов с заданной молярной концентрацией. | УЗЗ |
| П/Р №1, стр. 42. | §10 |
|
|
| 12 | Контрольная работа №1 ”ПЗ и ПС химических элементов Д.И. Менделеева. Химическая связь и строение веществ.” | УК |
| К/Р №1 | §3-10 |
|
|
| Тема 3. ХИМИЧЕСКИЕ РЕАКЦИИ. (8 ЧАСОВ) |
| 13 | Закон сохранения массы веществ. Закон сохранения и превращения энергии при химических реакциях. | КУ |
| Текущий опрос. | §1,2 |
|
|
| 14 | Классификация химических реакций. | КУ |
| Текущий опрос. | §11 |
|
|
| 15 | Скорость химических реакций. Зависимость скорости от различных факторов. | КУ |
| Текущий опрос. | §12 |
|
|
| 16 | Обратимые химические реакции. Принцип Ле Шателье. | КУ |
| Текущий опрос. | §13 |
|
|
| 17 | Гидролиз солей. | КУ |
| Текущий опрос. | §18 |
|
|
| 18-19 | Электролиз. | КУ |
| Текущий опрос. | записи |
|
|
| 20 | Обобщение и систематизация знаний по пройденной теме. | УОИСЗ |
| Текущий опрос. | §1-10 записи |
|
|
| Тема 4. НЕМЕТАЛЛЫ. (15 ЧАСОВ) |
| 21 | Обзор неметаллов. Решение задач на скорость химических реакций. | УИСЗ |
| Текущий опрос. | §30 |
|
|
| 22 | Водородные соединения неметаллов. | КУ |
| Текущий опрос. | §32 |
|
|
| 23 | Оксиды и кислородсодержащие кислоты. | КУ |
| Текущий опрос. | §31 |
|
|
| 24 | Контрольная работа №2 ”Химические реакции. Общий обзор неметаллов.” | УК |
| К/Р №2 | §11-13 |
|
|
| 25 | Углерод, строение атома, физические и химические свойства. | КУ |
| Текущий опрос. | записи |
|
|
| 26 | Кремний, кислоты кремния, силикаты. | КУ |
| Текущий опрос. | записи |
|
|
| 27 | Азот, аммиак, соли аммония, азотная кислота, нитраты. | КУ |
| Текущий опрос. | записи |
|
|
| 28 | Фосфор, оксиды фосфора, ортофосфорная кислота и ее соли. | КУ |
| Текущий опрос. | записи |
|
|
| 29 | Кислород, аллотропы кислорода и его важнейшие соединения. | КУ |
| Текущий опрос. | записи |
|
|
| 30 | Сера, аллотропы серы и ее важнейшие соединения. | КУ |
| Текущий опрос. | записи |
|
|
| 31 | Хлор и его важнейшие соединения. | КУ |
| Текущий опрос. | записи |
|
|
| 32 | Обобщение и систематизация знаний по пройденной теме. | УОИСЗ |
| Текущий опрос. | записи |
|
|
| 33 | Влияние различных факторов на скорость химической реакции. | УЗЗ |
| П/Р №2, стр. 76. | записи |
|
|
| 34 | Решение задач по теме не металлы, коррекция знаний. | КУ |
| Текущий опрос. | записи |
|
|
| 35 | Контрольная работа №3 ”Неметаллы”. | УК |
| К/Р №3. | записи |
|
|
| Тема 5. МЕТАЛЛЫ. (16 ЧАСОВ) |
| 36 | Общий обзор металлы. | УИСЗ |
| Текущий опрос. | §19 |
|
|
| 37 | Способы получения металлов. Сплавы металлов. | КУ |
| Текущий опрос. | §19 |
|
|
| 38 | Металлы А-группы. | КУ |
| Текущий опрос. | §21 |
|
|
| 39 | Металлы В-группы (на примере Cr). | КУ |
| Текущий опрос. | §22 |
|
|
| 40 | Оксиды и гидроксиды типичных металлов. | КУ |
| Текущий опрос. | §21 |
|
|
| 41 | Алюминий. Амфотерные оксиды и гидроксиды. | КУ |
| Текущий опрос. | §21 с.96 |
|
|
| 42 | Натрий и калий, и их важнейшие соединения. | КУ |
| Текущий опрос. | §21 с.92-93 |
|
|
| 43 | Магний и кальций. | КУ |
| Текущий опрос. | §21 с.94-95 |
|
|
| 44 | Олово и свинец. | КУ |
| Текущий опрос. | записи |
|
|
| 45 | Медь и хром. | КУ |
| Текущий опрос. | §23,26 записи |
|
|
| 46 | Марганец и железо. | КУ |
| Текущий опрос. | §27 записи |
|
|
| 47 | Генетические ряды по металлам. | КУ |
| Текущий опрос. | записи |
|
|
| 48 | Решение экспериментальных задач по неорганической химии. | УЗЗ |
| П/Р №3, стр. 144. | §21-29 записи |
|
|
| 49 | Решение практических расчетных задач. | УЗЗ |
| П/Р №5, стр. 145. | §21-29 записи |
|
|
| 50 | Получение, собирание и распознавание газов из курса неорганической химии. | УЗЗ |
| П/Р №6, стр. 145-147. | §21-29 записи |
|
|
| 51 | Контрольная работа №4 ”Металлы.” | УК |
| К/Р №4. | §21-29 записи |
|
|
| Тема 6. ОБЗОРНЫЕ МАТЕРИАЛЫ ПО КУРСУ ОРГАНИЧЕСКОЙ ХИМИИ. (17 ЧАСОВ) |
| 52 | Основные положения теории химического строения органических веществ. | КУ |
| Текущий опрос. | записи |
|
|
| 53 | Алканы. | КУ |
| Текущий опрос. | записи |
|
|
| 54 | Алкены. | КУ |
| Текущий опрос. | записи |
|
|
| 55 | Алкадиены. | КУ |
| Текущий опрос. | записи |
|
|
| 56 | Алкины. | КУ |
| Текущий опрос. | записи |
|
|
| 57 | Арены. | КУ |
| Текущий опрос. | записи |
|
|
| 58 | Контрольная работа №5 ”Углеводороды.” | УК |
| К/Р №5. | записи |
|
|
| 59 | Одноатомные предельные спирты. | КУ |
| Текущий опрос. | записи |
|
|
| 60 | Многоатомные предельные спирты. | КУ |
| Текущий опрос. | записи |
|
|
| 61 | Фенолы, альдегиды. | КУ |
| Текущий опрос. | записи |
|
|
| 62 | Одноосновные предельные карбоновые кислоты. | КУ |
| Текущий опрос. | записи |
|
|
| 63 | Сложные эфиры. | КУ |
| Текущий опрос. | записи |
|
|
| 64 | Обзор важнейших углеводов. | КУ |
| Текущий опрос. | записи |
|
|
| 65 | Амины. Аминокислоты. | КУ |
| Текущий опрос. | записи |
|
|
| 66 | Решение экспериментальных задач по органической химии. | УЗЗ |
| П/Р №4, стр. 144-145. | записи |
|
|
| 67 | Получение газообразных углеводородов в лабораторных условиях. | УЗЗ |
| П/Р №7, стр. 145-147. | записи |
|
|
| 68 | Контрольная работа №6 ”Кислородсодержащие органические соединения. Азотсодержащие органические соединения.” | УК |
| К/Р №6. | записи |
|
|
УИНЗ – урок изучения новых знаний.
УЗЗ – урок закрепления знаний.
КУ – комбинированный урок.
УОИСЗ – урок обобщения и систематизации знаний.
УК – урок контроля.
68 часов

 Получите свидетельство
Получите свидетельство Вход
Вход











 Рабочая программа по химии (11-ый класс) (49.13 КB)
Рабочая программа по химии (11-ый класс) (49.13 КB)
 0
0 775
775 41
41 Нравится
0
Нравится
0










