
Интернет – урок
(урок - лекция)
Автор учитель химии
Колесникова Г.Т.
МОУ-СОШ №21
Белгород 201 4

"ХИМИЯ РАЗУМА: МУДРОСТЬ КОНДЕНСИРУЕТ, А ГЛУПОСТЬ РАСТВОРЯЕТ"
БОЛЕСЛАВ ВОЛЬТЕР
- Дать понятие о классификации кислот, их номенклатуре
- Рассмотреть физические и химические свойства предельных одноосновных карбоновых кислот
- Отразить важнейшие способы получения
- Выявить генетическую связь

Содержание
1. Карбоновые кислоты
2. Классификация карбоновых кислот
3. Изомерия
4 . Физические и химические свойства кислот
5 . Получение
6 . Генетическая связь

Карбоновые кислоты
Карбоновыми кислотами называются органические вещества, молекулы которых содержат одну или несколько карбоксильных групп -СООН , связанных с углеводородным радикалом.
- Карбоновыми кислотами называются органические вещества, молекулы которых содержат одну или несколько карбоксильных групп -СООН , связанных с углеводородным радикалом.

Классификация карбоновых кислот
3
2
1
По числу атомов углерода
По количеству карбоксильных групп
По характеру углеродного радикала

Классификация кислот
По характеру углеродного радикала
Title
Add your text
Кислоты
CH 3 -CH 2 -C О OH
Предельные
(пропановая кислота)
C О OH
Ароматические
(бензойная кислота)
CH 2 = CH-C О OH
Непредельные
(акриловая кислота)

Классификация кислот
По числу карбоксильных групп
Title
Add your text
Кислоты
CH 3 -C О OH
Одноосновные
(уксусная кислота)
Многоосновные кислоты
НООС- CH = CH-C О OH
Двухосновные
(малеиновая кислота)

Классификация кислот
По числу атомов углерода
Title
Add your text
Кислоты
CH 3 -C О OH
Низшие
(уксусная кислота)
С 17 Н 35 C О OH
Высшие
(стеариновая кислота)

Предельные одноосновные карбоновые кислоты
Н- C ОО H – метан овая кислота
Муравьиная кислота
Уксусная кислота
C Н 3- СОО H – этан овая кислота
Пропионовая кислота
СН 3 -СН 2 -СООН - пропан овая кислота
Масляная кислота
СН 3 -СН 2 -СН 2 -СООН – б утан овая кислота
Предельные одноосновные карбоновые кислоты образуют гомологический ряд общей формулы C n H 2n+1 СОО H ( n= 1,2,3,: N) . Названия их по систематической номенклатуре строятся из названий соответствующих алканов путём добавления окончания «овая» кислота

Сделай САМ!
Масштабные и шаростержневые модели
молекул карбоновых кислот

Масляная кислота
Изомерия карбоновых кислот
СН 3 -СН 2 -СН 2 -СООН
Имеют два вида изомерии:
СН 3 -СН-СООН
I
C Н 3
1) Структурная изомерия
2) Межклассовая изомерия
(со сложными эфирами)
СН 3 -СОО-СН 2 -СН 3
http://school-collection.edu.ru/catalog/rubr/d05469af-69bd-11db-bd13-0800200c9c10/75851 /

Задание для самоконтроля!
Задание по группам:
Составьте полуструктурные формулы изомеров разных видов для валерьяновой кислоты
1 группа – структурные изомеры
2 группа – межклассовые изомеры
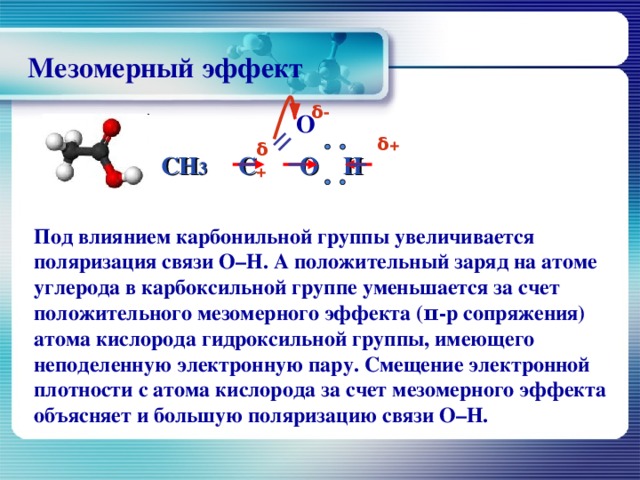
Мезомерный эффект
δ -
О
CH 3 С O H
δ +
δ +
П од влиянием карбонильной группы увеличивается поляризация связи О–Н. А положительный заряд на атоме углерода в карбоксильной группе уменьшается за счет положительного мезомерного эффекта (π-р сопряжения) атома кислорода гидроксильной группы, имеющего неподеленную электронную пару. Смещение электронной плотности с атома кислорода за счет мезомерного эффекта объясняет и большую поляризацию связи О–Н.

Физические свойства карбоновых кислот
Кислоты имеют аномально высокие температуры кипения и плавления. Это объясняется тем, что они имеют водородную связь , которая образуются за счет взаимодействия гидроксильного водорода одной молекулы и карбонильного кислорода другой. Низшие кислоты обладают острым кислым запахом, средние (С 4 -С 8 ) имеют неприятный прогорклый запах. Высшие жирные (от С 9 ) запаха не имеют. Низшие кислоты хорошо растворяются в воде. С увеличением углеводородного остатка растворимость в воде уменьшается.

Водородная связь

Химические свойства
Реакционная способность карбоновых кислот обусловлена наличием в их молекулах карбоксильной группы: СООН
Они проявляют свойства, присущие неорганическим кислотам

Типы реакций
Реакции окисления
Реакция, общие с неорганическими кислотами
Реакция этерификации
Реакции на углеводородный радикал
Для карбоновых кислот характерно 4 типа реакций

Общие свойства карбоновых кислот с неорганическими кислотами:
1. Диссоциация в водных растворах (среда кислая, индикаторы меняют окраску).
2. Карбоновые кислоты вступают в реакцию замещения с металлами, стоящими в ряду напряжений до водорода.
http://school-collection.edu.ru/catalog/rubr/d05469af-69bd-11db-bd13-0800200c9c10/75851/

Общие свойства карбоновых кислот с неорганическими кислотами:
3. Карбоновые кислоты реагируют с основными оксидами с образованием соли и воды.
4. Вступают в реакцию нейтрализации с основаниями (щелочами и нерастворимыми) и амфотерными гидроксидами.
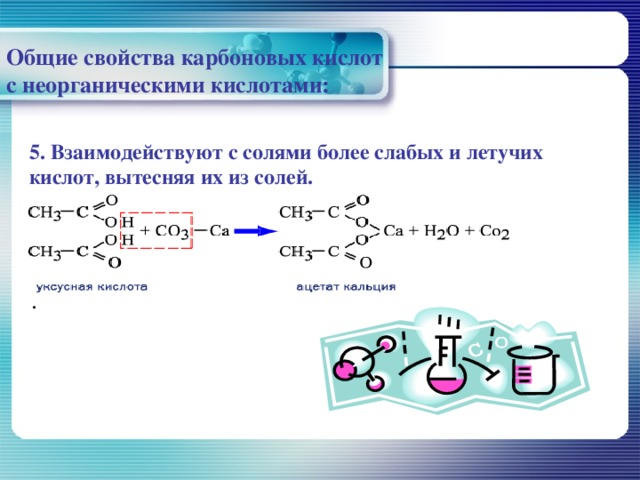
Общие свойства карбоновых кислот с неорганическими кислотами:
5. Взаимодействуют с солями более слабых и летучих кислот, вытесняя их из солей.
.

Реакция этерификации
6. Реакция этерификации – образование сложных эфиров при взаимодействии карбоновых кислот со спиртами.
7. Кислоты могут образовывать кислотные оксиды
(или ангидриды кислот).

Особые свойства
Особые свойства кислот, обусловленных наличием в их молекулах радикалов. Реакция с галогенами.
Чем более галогензамещенной будет карбоновая кислота, тем она сильнее!

Получение карбоновых кислот
1. Окислением спиртов
2. Окислением альдегидов
3. Окислением углеводородов
Существуют и другие способы получения карбоновых кислот
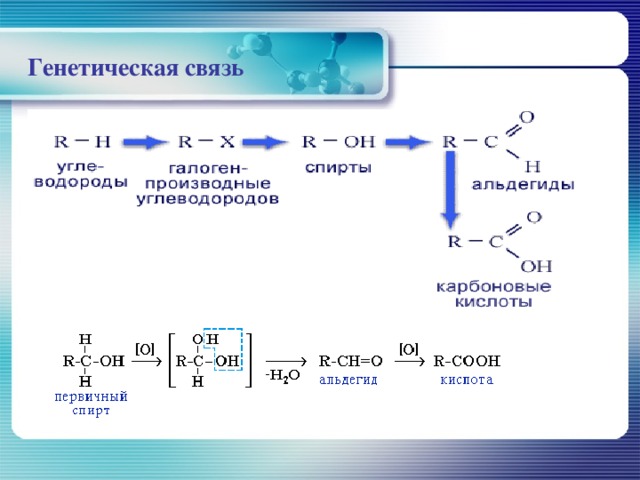
Генетическая связь

Выводы
Title
Add your text
Кислоты
3. Общие свойства карбоновых кислот, обусловлены наличием в молекулах карбоксильной группы. Для карбоновых кислот характерны свойства как общие с неорганическими кислотами, так и специфические, присущие только для органических кислот.
- Карбоновыми кислотами называются органические вещества, молекулы которых содержат одну или несколько карбоксильных групп, соединенных с углеводородным радикалом.
2. Для карбоновых кислот характерна изомерия углеродного скелета и межклассовая изомерия.

Интерактив по теме: «Карбоновые кислоты»

Рефлексия
Улыбнитесь !
«10 баллов»
Оценить по 10-бальной шкале работу на уроке с позиции:
„ Я“ 0________10
„ Мы“ 0________10
„ Дело“ 0________10
Физминутка для глаз
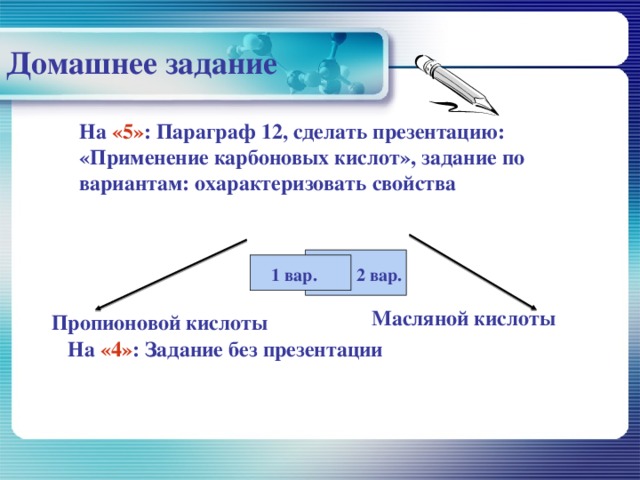
Домашнее задание
На «5» : Параграф 12, сделать презентацию: «Применение карбоновых кислот», задание по вариантам: охарактеризовать свойства
1 вар.
2 вар.
Масляной кислоты
Пропионовой кислоты
На «4» : Задание без презентации

Литература и ЦОР
1. Габриелян, О.С. Химия. 10 класс. Профильный уровень: метод. пособие. - М.: Дрофа, 2008 -191.
2. Габриелян, О.С., Остроумов И.Г. Настольная книга учителя. Химия. 10 класс. – М.: Дрофа, 2004.
3. Артеменко, А.И. Органическая химия: Номенклатура. Изомерия. Электронные эффекты. – М.: Дрофа, 2006.
- http://school-collection.edu.ru
- http://imc.rkc-74.ru
- http://chemistry-chemists.com

 COOH
COOH  RCOO- + Н+
RCOO- + Н+
 Получите свидетельство
Получите свидетельство Вход
Вход










































 Презентация по теме: "Карбоновые кислоты" (15.18 MB)
Презентация по теме: "Карбоновые кислоты" (15.18 MB)
 0
0 3942
3942 536
536 Нравится
0
Нравится
0


