
Тема
Металлы, их положение в ПСХЭ, физические и химические свойства

Тема
- Металлы, их классификация. Их положение в ПСХЭ. Физические и химические свойства металлов.


К элементам - металлам относятся:
s - элементы I и II групп, все d - и f -элементы,
а также p - элементы главных подгрупп:
III (кроме бора),
IV ( Ge , Sn , Pb ),
V ( Sb , Bi ) и VI ( Po ).
Наиболее типичные элементы – металлы расположены в начале периодов (начиная со второго).

Из положения в таблице Д.И. Менделеева
следует:
- Атомы металлов на последнем
энергетическом уровне имеют 1 – 3 ē .
Исключения:
Ge, Sn, Pb – 4ē ; Sb, Bi – 5ē ; Po – 6ē .

2. У атомов металлов большие размеры атомных радиусов. Поэтому металлы легко отдают внешние электроны.
Металлы в реакциях восстановители!

Металлическая связь – это связь в металлах и сплавах между атом-ионами металлов, расположенными в узлах кристаллической решётки, осуществляемая обобществлёнными внешними электронами.
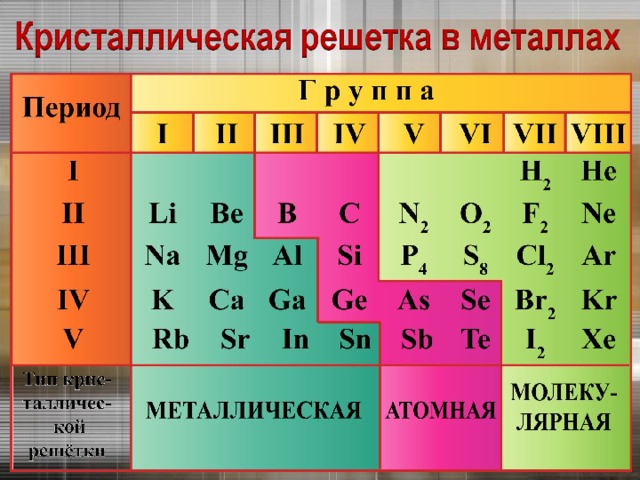
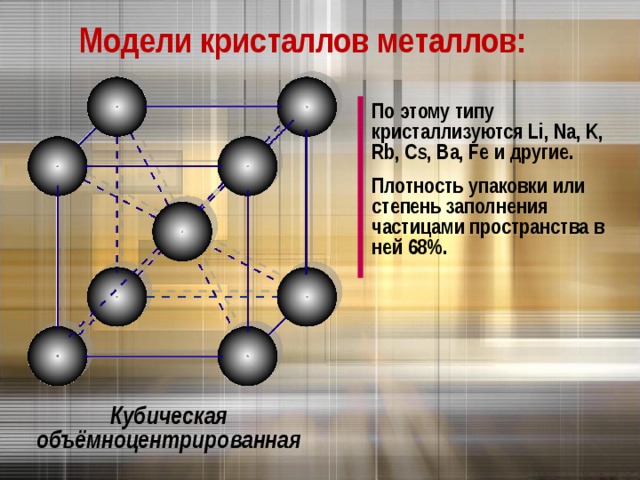
Модели кристаллов металлов:
По этому типу кристаллизуются Li, Na, K, Rb, Cs, Ba, Fe и другие.
Плотность упаковки или степень заполнения частицами пространства в ней 68%.
Кубическая объёмноцентрированная
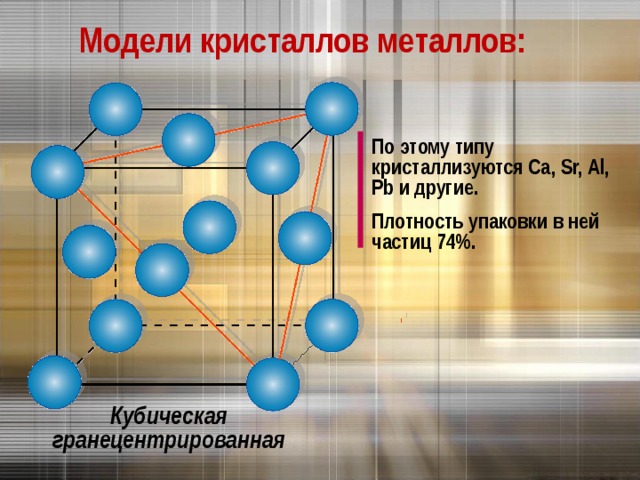
Модели кристаллов металлов:
По этому типу кристаллизуются Са , Sr, Al, Pb и другие.
Плотность упаковки в ней частиц 74%.
Кубическая гранецентрированная
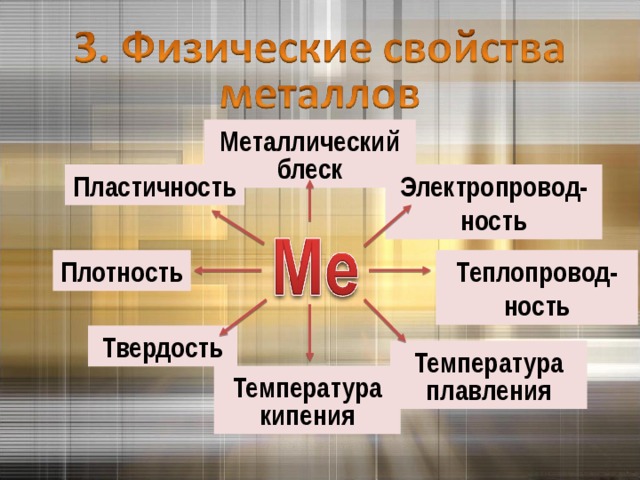
Металлический блеск
Электропровод-ность
Пластичность
Теплопровод-ность
Плотность
Твердость
Температура плавления
Температура кипения

1. Металлический блеск
Самые блестящие металлы – Hg, Ag, Pd.
В порошке все металлы, кроме Al и Mg ,
теряют блеск и имеют чёрный или
тёмно-серый цвет.

металлический блеск
- Электроны, заполняющие межатомное пространство отражают световые лучи, а не пропускают как стекло. Поэтому все металлы в кристаллическом состоянии имеют металлический блеск.
- Для большинства металлов в ровной степени рассеиваются все лучи видимой части спектра, поэтому они имеют серебристо-белый цвет .
- Только золото и медь в большой степени поглощают короткие волны и отражают длинные волны светового спектра, поэтому имеют желтый цвет.
- Самые блестящие металлы – ртуть, серебро, палладий. В порошке все металлы, кроме Al и Mg , теряют блеск и имеют черный или темно-серый цвет .

Металлический блеск
Зеркало состоит из гладкого стекла, на которое наносят очень тонкий слой металла. Часто зеркала покрывают серебром, потому что оно прекрасно отражает свет.


2. Электропроводность и теплопроводность металлов обусловлена их строением. Хаотически движущиеся электроны под действием электрического напряжения приобретают направленное движение, в результате чего возникает электрический ток.
Высокая электропроводность и теплопроводность уменьшается в ряду металлов: Аg Сu Аu Аl Мg Zn Fе РЬ Hg


2. Электропроводность и теплопроводность
При нагревании электропроводность уменьшается, т.к. с повышением температуры усиливаются колебания атомов и ионов в узлах кристаллической решетки, что затрудняет направленное движение "электронного газа".

3. Температуры плавления и кипения
Калий
Вольфрам
Ртуть
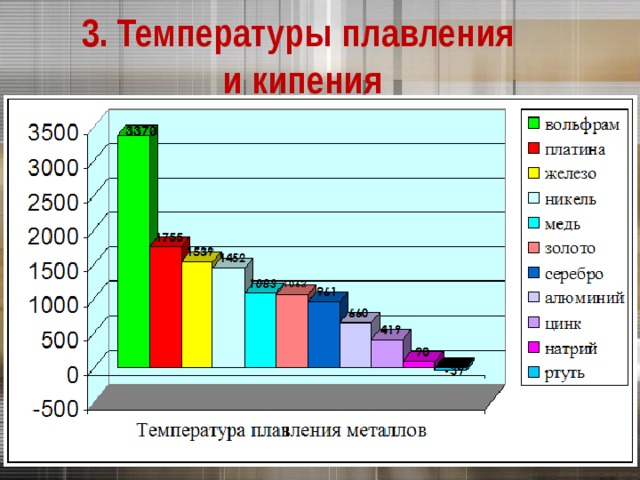
3. Температуры плавления и кипения

3. Температуры плавления и кипения
Самый легкоплавкий металл – ртуть (т.пл. = -39 °C ), самый тугоплавкий металл –
вольфрам ( t° пл. = 3370 °C ).
Металлы с t° пл. выше 1000 °C считаются тугоплавкими, ниже – низкоплавкими.

Нить накаливания

4. Твёрдость
Щелочные металлы режутся ножом
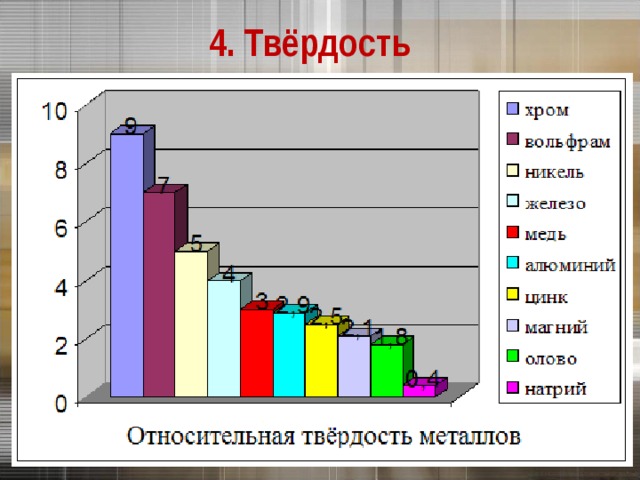
4. Твёрдость

Хром – самый твёрдый металл

4. Твёрдость
Самый твердый – хром (режет стекло).
Самые мягкие – щелочные металлы – калий, натрий, рубидий и цезий – режутся ножом.

5. Плотность
Плотность тем меньше, чем меньше атомная масса металла и чем больше радиус его атома
Платина и золото – одни из тяжёлых металлов
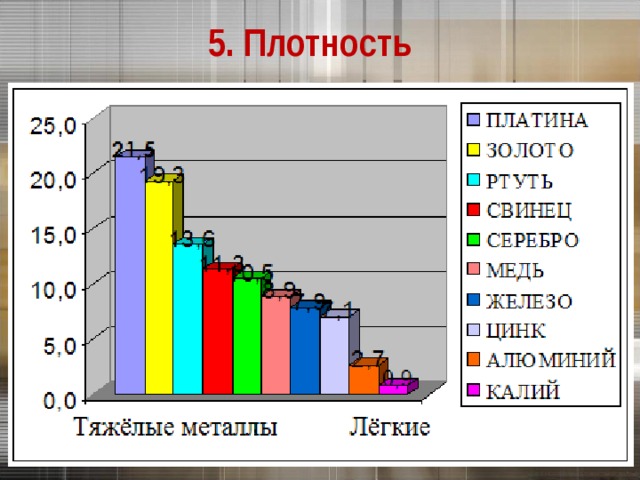
5. Плотность

5. Плотность
Самый легкий – литий ( ρ =0,53 г/см 3 ), всплывает в керосине.
Самый тяжелый – осмий ( ρ =22,6 г/см 3 ).

Литий – самый лёгкий металл

Осмий – самый дорогой металл (изотоп 187)
Осмий – самый тяжёлый металл

6. Пластичность
Способность изменять свою форму при ударе, прокатываться в тонкие листы, вытягиваться в проволоку: золото, серебро, медь, алюминий. Из 1г золота можно вытянуть проволоку длиной 2 км.
В ряду :
Au → Ag → Cu → Sn → Pb → Zn → Fe уменьшается.

Физические свойства металлов
- Пластичность. Механическое воздействие на кристалл с металлической решеткой вызывает только смещение слоев атомов и не сопровождается разрывом связи, и поэтому металл характеризуется высокой пластичностью.

6. Пластичность
Всем известна алюминиевая фольга. Алюминиевая фольга - это тонкий слой алюминия, в котором отлично сохраняются продукты питания, кофе, чай, лекарства, корма для домашних животных и многое другое.

Сусальное золото

7. Способность намагничиваться - железо, кобальт, никель. Находит применение при изготовлении магнитов.

8. Агрегатное состояние
Все металлы твердые, исключение ртуть - единственный жидкий металл.

Выводы :
- Все металлы имеют металлическую кристаллическую решетку.
- В металлах осуществляется металлическая связь.
- Основные физические свойства металлов – металлический блеск, непрозрачность, электро- и теплопроводность, пластичность обусловлены строением металлов.
- Металлы проявляют только восстановительные свойства, потому что в реакциях они всегда отдают свои электроны.
- Металлы используют в основном в виде сплавов.
- Металлы имеют важное значение в жизни человека.

Классификация металлов
- По плотности. Металлы делятся на:
- легкие - (плотность меньше 5г/см³). К ним относят литий, натрий, калий, магний, алюминий и др. Самый легкий - литий (плотность 0,53 г/см 3 )
- тяжелые - (плотность больше 5г/см³). К ним относят переходные металлы шестого периода и актиноиды. Н-р, ртуть, свинец, кадмий, цинк . Самый тяжелый - осмий (плотность 22,5 г/см 3 )

Классификация металлов
- По температуре плавления
- Легкоплавкие металлы (температура плавления меньше 1000 º С). Самый легкоплавкий из металлов – ртуть Hg (-38,89 º С). При комнатной температуре является жидкостью. В технике широко применяются легкоплавкие металлы: олово и свинец.
- Среднеплавкие металлы (температура плавления в диапазоне 1000-1500 º С). Никель, медь, золото
- Тугоплавкие - (температура плавления больше 1500 º С). Максимальную температуру плавления имеет вольфрам W (3410 º С)

Классификация металлов
- По отношению к магнитным полям:
- Ферромагнитные – способные намагничиваться при действии слабых магнитных полей (н-р, железо, кобальт, никель, гадолиний)
- Парамагнитные – проявляющие слабую способность к намагничиванию (алюминий, хром, титан и большая часть лантаноидов)
- Диамагнитные - не притягиваются к магниту и даже слегка отталкивающиеся от него (висмут, олово, медь)

Классификация металлов
- По строению внешнего валентного слоя
- S – металлы – s -элементы, кроме H и He . Имеют постоянные степени окисления, равные номеру группы. Обладают основными свойствами.
- P - металлы – Al, Ga, In, Tl, Sn, Pb, Bi . Имеют переменные степени окисления. Обладают амфотерными свойствами.
- D -металлы - d -элементы. Имеют переменные степени окисления (кроме Zn и Cd )
- F -металлы - f -элементы. Степени окисления +3 и выше.

Классификация металлов
- В технике металлы принято делить на:
- Черные металлы : Имеют темно-серый цвет, большую плотность, высокую температуру плавления и относительно высокую твердость. Типичным представителем черных металлов является железо.
- Также относят Mn, Cr

- Все остальные металлы объединены в группу цветных.
- Они имеют характерную окраску: красную, желтую, белую; обладают большой пластичностью, малой твердостью, относительно низкой температурой плавления. Типичным представителем цветных металлов является медь.

- Au, Ag, Pt, Pd, Rh, Ir, Os, Ru относят к драгоценным металлам

Химические свойства металлов.
- 1. Металлы – восстановители.
- 2 Mg 0 + O 2 0 =2 Mg +2 O -2
восст-ль ок-ль

Химические свойства металлов.
- 2. Металлы и неметаллы
- 2 Al 0 + 3 Br 2 0 = 2 Al +3 Br - 3 бромид алюминия
восст-ль ок-ль

Химические свойства металлов
- 3. Металлы и вода.
- 2 Na +2 H 2 O =2 NaOH +Н2↑
- Закончите уравнения химических реакций:
- Li + H 2 O → … + …
- К+ H 2 O → … + …


- 4. Металлы и кислоты .
- Zn + HCl →…+…

- 5. Взаимодействие металлов с солями
- CuSO 4 + Zn = Zn SO 4 + Cu CuSO 4 + Fe = … + …

Способы получения металлов
- а) Пирометаллургия – это получение металлов из их соединений при высоких температурах с помощью различных восстановителей (C, CO, H 2 , Al, Mg и др.).
- — из их оксидов углем или оксидом углерода (II) ZnО + С = Zn + СО Fе 2 О 3 + ЗСО = 2Fе + ЗСО 2
- — водородом WO 3 + 3H 2 =W + 3H 2 O СоО + Н 2 = Со + Н 2 О
- — алюминотермия 4Аl + ЗМnО 2 = 2А l 2 О 3 + ЗМn

- б) Гидрометаллургия – это получение металлов, которое состоит из двух процессов: сначала природное соединение металла (оксид) растворяют в кислоте, в результате чего получают соль металла. Затем из полученного раствора необходимый металл вытесняют более активным металлом.
- Например:
- CuO + H 2 SO 4 = CuSO 4 + H 2 O,
- CuSO 4 + Zn = ZnSO 4 + Cu.

- в) Электрометаллургия – это получение металлов при электролизе растворов или расплавов их соединений. Роль восстановителя при этом играет электрический ток.
- СuСl2 → Сu2+ 2Сl-
- Катод (восстановление): Сu 2+ - 2е = Сu 0
- Анод (окисление): 2Cl - - 2е = Сl° 2

Применение металлов
- Конструкционные материалы.
- Металлы и их сплавы - один их главных конструкционных материалов современной цивилизации. Это определяется прежде всего их высокой прочностью, однородностью и непроницаемостью для жидкостей и газов. Кроме того, меняя рецептуру сплавов, можно менять их свойства в очень широких пределах.

Применение металлов
- Электротехнические материалы.
- Металлы используются как в качестве хороших проводников электричества (медь, алюминий), так и в качестве материалов с повышенным сопротивлением для резисторов и электронагревательных элементов (нихром и т. п.).

Применение металлов
- Инструментальные материалы.
- Металлы и их сплавы широко применяются для изготовления инструментов (их рабочей части). В основном это инструментальные стали и твердые сплавы. В качестве инструментальных материалов применяются также алмаз, нитрид бора, керамика.

Контрольные вопросы
- 1. Где расположены металлы в периодической системе химических элементов Д.И.Менделеева?
- 2. Каковы особенности строения атомов металлов? 3. В чём различие в строении внешнего энергетического уровня у металлов и неметаллов? 4. Сколько наружных электронов имеют атомы металлов главных и побочных подгрупп? 5. В каких формах могут находиться металлы в природе? 6. Как устроена кристаллическая решетка металлов? 7. Каковы физические свойства металлов?
- 8. Как можно получить металлы из их соединений? 9. Как ведут себя атомы металлов в химических реакциях и почему? 10. Какие свойства – окислителей или восстановителей – проявляют металлы в химических реакциях? 11. Расскажите об электрохимическом ряде напряжений металлов. 12. Перечислите реакции, в которые могут вступать металлы. 13. Каково значение металлов в жизни человека?

 Получите свидетельство
Получите свидетельство Вход
Вход












 Презентация по химии по теме: "Металлы" (7.21 MB)
Презентация по химии по теме: "Металлы" (7.21 MB)
 0
0 2823
2823 472
472 Нравится
0
Нравится
0


