
Алкены

Содержание
- Строение алкенов
- Изомерия и номенклатура алкенов
- Физические свойства
- Получение
- Химические свойства
- Применение алкенов
- Контрольные вопросы
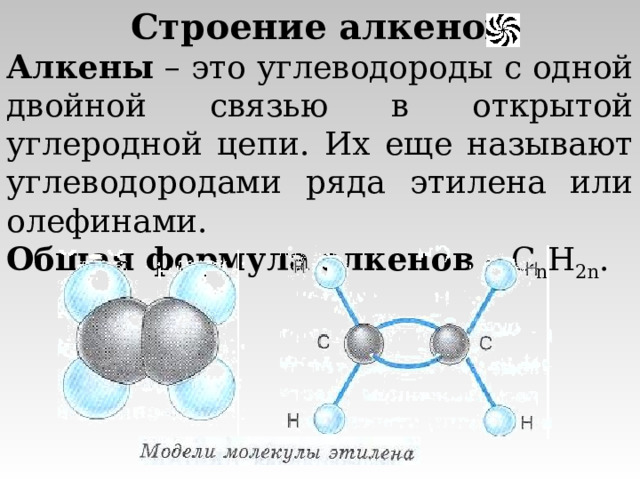
Строение алкенов
Алкены – это углеводороды с одной двойной связью в открытой углеродной цепи. Их еще называют углеводородами ряда этилена или олефинами.
Общая формула алкенов – C n H 2n .
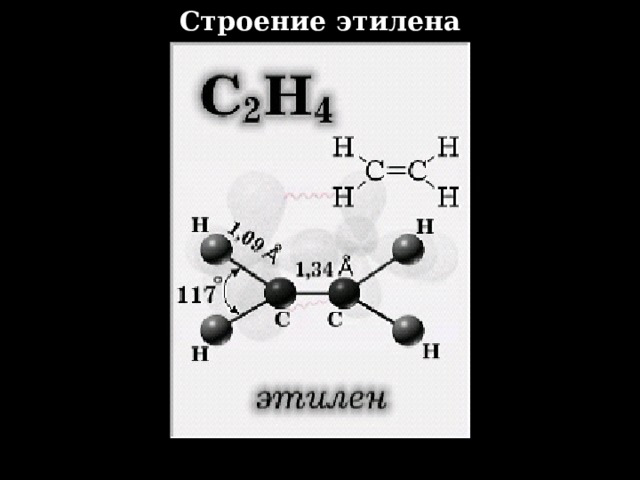
Строение этилена
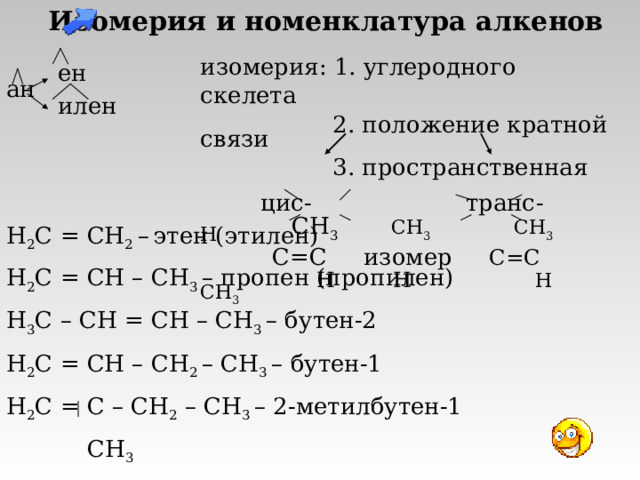
Изомерия и номенклатура алкенов
ен
ан
илен
изомерия: 1. углеродного скелета
2. положение кратной связи
3. пространственная
цис - транс -
СН 3 СН 3 СН 3 Н
С=С изомер С=С
Н Н Н СН 3
H 2 C = CH 2 – этен (этилен)
H 2 C = CH – CH 3 – пропен (пропилен)
H 3 C – CH = CH – CH 3 – бутен-2
H 2 C = CH – CH 2 – CH 3 – бутен-1
H 2 C = C – CH 2 – CH 3 – 2-метилбутен-1
CH 3
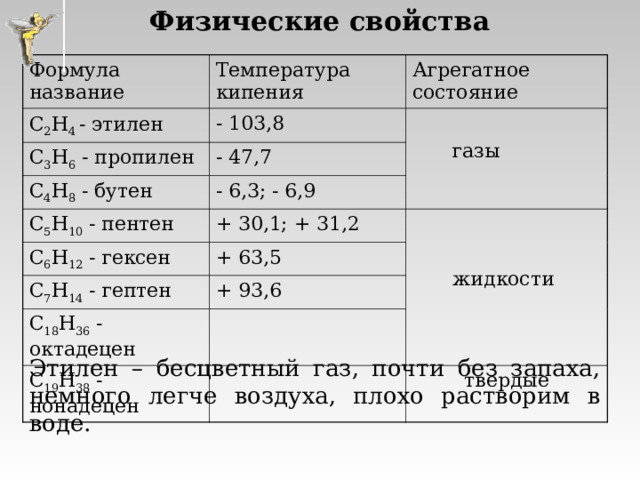
Физические свойства
Формула название
Температура кипения
C 2 H 4 - этилен
- 103,8
C 3 H 6 - пропилен
Агрегатное состояние
газы
- 47,7
C 4 H 8 - бутен
C 5 H 10 - пентен
- 6,3; - 6,9
C 6 H 12 - гексен
+ 30,1; + 31,2
жидкости
+ 63,5
C 7 H 14 - гептен
+ 93,6
C 18 H 36 - октадецен
C 19 H 38 - нонадецен
твердые
Этилен – бесцветный газ, почти без запаха, немного легче воздуха, плохо растворим в воде.
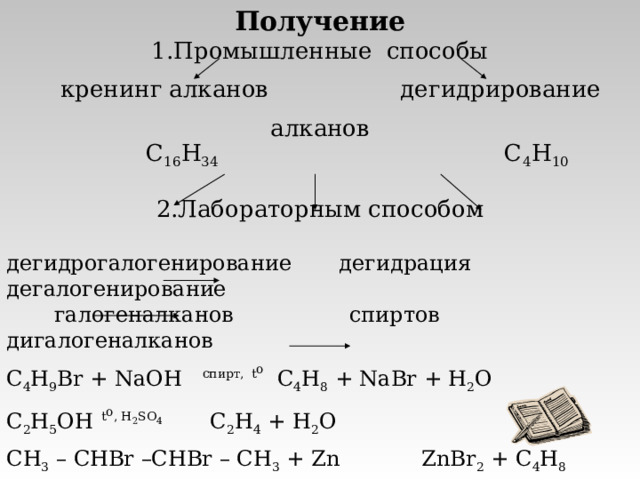
Получение
- Промышленные способы
кренинг алканов дегидрирование алканов
C 16 H 34 C 4 H 10
- Лабораторным способом
дегидрогалогенирование дегидрация дегалогенирование
галогеналканов спиртов дигалогеналканов
C 4 H 9 Br + NaOH спирт, t o C 4 H 8 + NaBr + H 2 O
C 2 H 5 OH t o , H 2 SO 4 C 2 H 4 + H 2 O
С H 3 – CHBr –CHBr – CH 3 + Zn ZnBr 2 + C 4 H 8

ЛАБОРАТОРНЫЙ СПОСОБ ПОЛУЧЕНИЯ
ДЕ ГИДРАТАЦИЯ СПИРТОВ
СПИРТ → АЛК ЕН + ВОДА
ПРИМЕР: t≥ 14 0C ,
Н Н Н 2 SO 4 (конц.)
Н-С – С-Н → Н 2 С = СН 2 + Н 2 О
Н ОН эт ен
(эт илен )

Получение алкенов
КРЕКИНГ АЛКАНОВ
АЛК АН → АЛК АН + АЛК ЕН
С БОЛЕЕ ДЛИННОЙ С МЕНЕЕ ДЛИННОЙ
УГЛЕРОДНОЙ УГЛЕРОДНОЙ
ЦЕПЬЮ ЦЕПЬЮ
ПРИМЕР:
t=400-700C
С 10 Н 22 → С 5 Н 12 + С 5 Н 10
дек ан пент ан пент ен

ПРОМЫШЛЕННЫЙ СПОСОБ ПОЛУЧЕНИЯ
ДЕ ГИДРИРОВАНИЕ АЛКАНОВ
АЛК АН → АЛК ЕН + ВОДОРОД
ПРИМЕР:
Ni, t= 5 00C
Н 3 С - СН 3 → Н 2 С = СН 2 + Н 2
эт ан эт ен
(эт илен )

ЛАБОРАТОРНЫЙ СПОСОБ ПОЛУЧЕНИЯ
ДЕ ГИДРО ГАЛОГЕН ИРОВАНИЕ
УДАЛИТЬ ВОДОРОД ГАЛОГЕН ДЕЙСТВИЕ
ПРИМЕР:
спиртовой
H H раствор
Н-С–С-Н +KOH →Н 2 С = СН 2 +K Cl + H 2 O
Н Cl эт ен
хлорэт ан (эт илен )
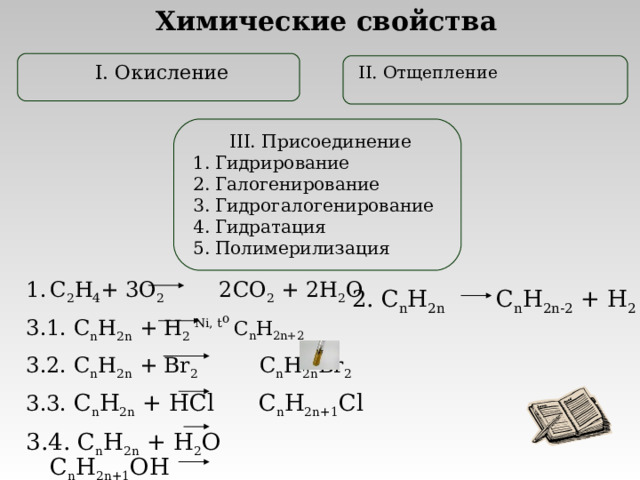
Химические свойства
I. Окисление
II. Отщепление
III. Присоединение
- Гидрирование
- Галогенирование
- Гидрогалогенирование
- Гидратация
- Полимерилизация
- C 2 H 4 + 3 O 2 2 CO 2 + 2 H 2 O
3.1. C n H 2n + H 2 Ni, t o C n H 2n + 2
3.2. C n H 2n + Br 2 C n H 2n Br 2
3.3. C n H 2n + HCl C n H 2n+1 Cl
3.4. C n H 2n + H 2 O C n H 2n+1 OH
3.5. nC n H 2n + … полимер
2. C n H 2n C n H 2n-2 + H 2
![РЕАКЦИИ ОКИСЛЕНИЯ МЯГКОЕ ОКИСЛЕНИЕ – ВЗАИМОДЕЙСТВИЕ С РАСТВОРОМ ПЕРМАНГАНАТА КАЛИЯ (реакция Е.Е.Вагнера) Н 2 С=СН 2 + [O] + H 2 O H 2 C - CH 2 OH OH этиленгликоль (этандиол-1,2) ! Качественная реакция на непредельность углеводорода – на кратную связь](https://fsd.videouroki.net/html/2024/01/27/v_65b48e43ac2a0/img12.jpg)
РЕАКЦИИ ОКИСЛЕНИЯ
МЯГКОЕ ОКИСЛЕНИЕ – ВЗАИМОДЕЙСТВИЕ С РАСТВОРОМ ПЕРМАНГАНАТА КАЛИЯ
(реакция Е.Е.Вагнера)
Н 2 С=СН 2 + [O] + H 2 O H 2 C - CH 2
OH OH
этиленгликоль
(этандиол-1,2)
! Качественная реакция на непредельность углеводорода – на кратную связь

РЕАКЦИЯ ПОЛИМЕРИЗАЦИИ
Это процесс соединения одинаковых молекул в более крупные.
ПРИМЕР: n CH 2 =CH 2 (-CH 2 -CH 2 -)n
этилен поли этилен
(мономер) (полимер)
n – степень полимеризации, показывает число молекул, вступивших в реакцию
-CH 2 -CH 2 - структурное звено
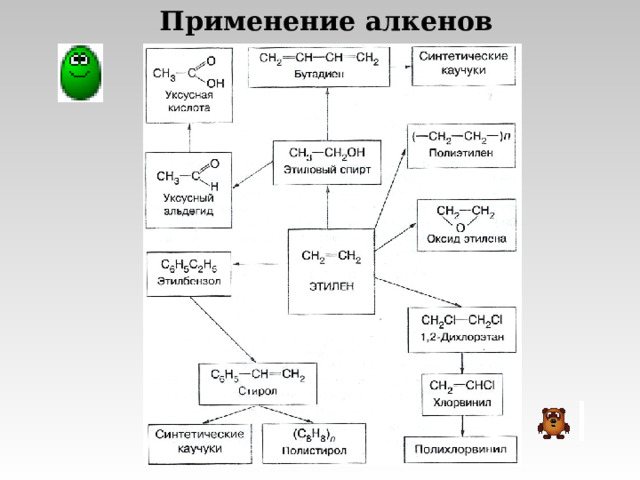
Применение алкенов

 Получите свидетельство
Получите свидетельство Вход
Вход











 Презентация алкены 2 (1.08 MB)
Презентация алкены 2 (1.08 MB)
 0
0 741
741 23
23 Нравится
0
Нравится
0



