«Строение и свойства алканов»
Урок химии в 10 классе
Учитель химии и биологии
В. П. Артеменко
МБОУ СОШ №28 г. Белгорода

Творческие группы
Математики
и физики
Химики
Геологи
Экологи и
технологи

Проблемные вопросы совместного проекта
- Где геологу найти алканы?
- Что общего между молекулой метана и пакетом молока найдет математик и физик?
- Что делать химику с инертными алканами?
- Экологи и технологи спорят: алканы - зло или благо?


Группа «Геологи»
НАХОЖДЕНИЕ АЛКАНОВ В ПРИРОДЕ.
МЕТАН образуется в природе в результате разложения без доступа воздуха остатков растительных и животных организмов. Поэтому может быть обнаружен в заболоченных водоемах, где появляется в виде пузырьков газа, или накапливается в каменноугольных шахтах, куда выделяется из угольных пластов. В значительном количестве (80-97%) метан содержится в природном газе и в попутных нефтяных газах. В космосе метан является основной частью атмосфер многих планет, например Сатурна.

ЭТАН, ПРОПАН И БУТАН входят в состав природного и попутного нефтяного газов.
АЛКАНЫ содержатся в нефти.
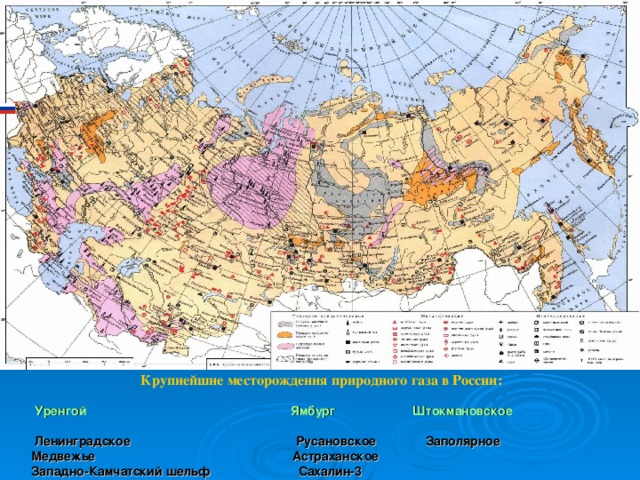
Крупнейшие месторождения природного газа в России:
Уренгой Ямбург Штокмановское
Ленинградское Русановское Заполярное
Медвежье Астраханское
Западно-Камчатский шельф Сахалин-3
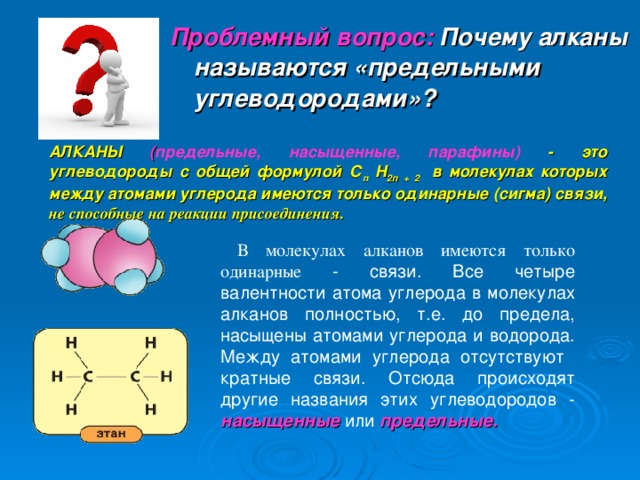
Проблемный вопрос: Почему алканы называются «предельными углеводородами»?
АЛКАНЫ ( предельные, насыщенные, парафины) - это углеводороды с общей формулой С п Н 2п + 2 в молекулах которых между атомами углерода имеются только одинарные (сигма) связи , не способные на реакции присоединения.
В молекулах алканов имеются только одинарные - связи. Все четыре валентности атома углерода в молекулах алканов полностью, т.е. до предела, насыщены атомами углерода и водорода. Между атомами углерода отсутствуют кратные связи. Отсюда происходят другие названия этих углеводородов - насыщенные или предельные.

ГОМОЛОГИЧЕСКИЙ РЯД АЛКАНОВ
Вспомните, какие вещества мы называем гомологами?
ГОМОЛОГИ – это вещества со схожими строением и свойствами, но различающиеся по составу на одну или несколько групп CH 2 ( гомологическая разность).
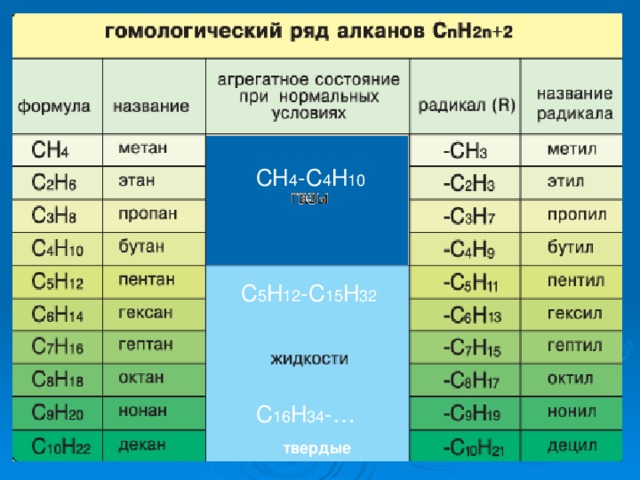
СН -С Н
С Н -С Н
С Н -…
твердые

Группа «Математики и физики». Проблема исследования:
Выяснить, что общего между молекулой метана и пакетом молока?
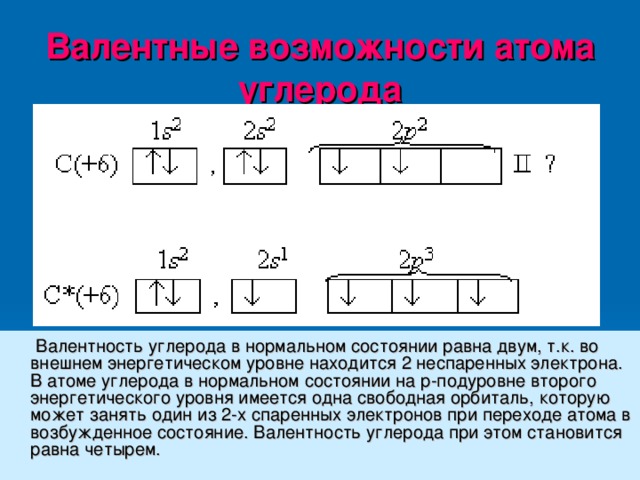
Валентные возможности атома углерода
Валентность углерода в нормальном состоянии равна двум, т.к. во внешнем энергетическом уровне находится 2 неспаренных электрона. В атоме углерода в нормальном состоянии на р-подуровне второго энергетического уровня имеется одна свободная орбиталь, которую может занять один из 2-х спаренных электронов при переходе атома в возбужденное состояние. Валентность углерода при этом становится равна четырем.

Гибридизация электронных орбиталей в атоме углерода
Гибридизация – это взаимное выравнивание s и р-электронных орбиталей в атоме углерода. Для атома характерна
SP 3 –гибридизация.
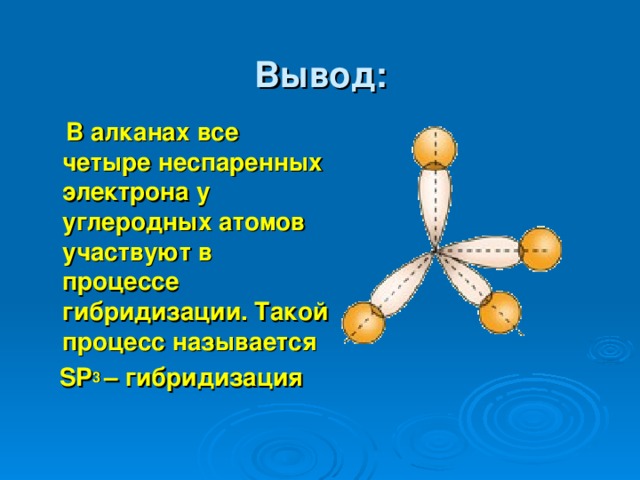
Вывод:
В алканах все четыре неспаренных электрона у углеродных атомов участвуют в процессе гибридизации. Такой процесс называется
SP 3 – гибридизация
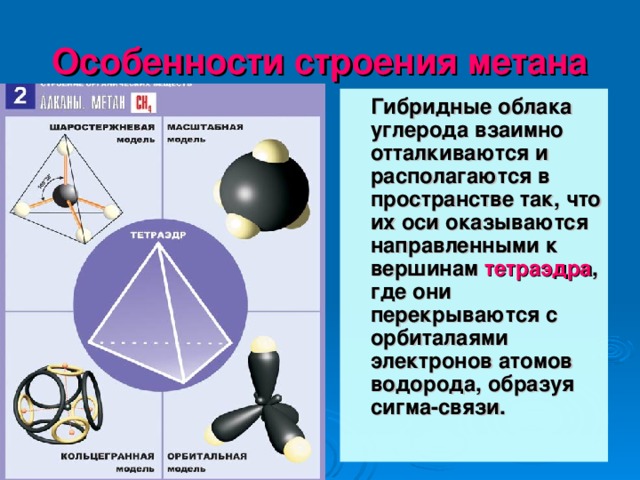
Особенности строения метана
Гибридные облака углерода взаимно отталкиваются и располагаются в пространстве так, что их оси оказываются направленными к вершинам тетраэдра , где они перекрываются с орбиталаями электронов атомов водорода, образуя сигма-связи.
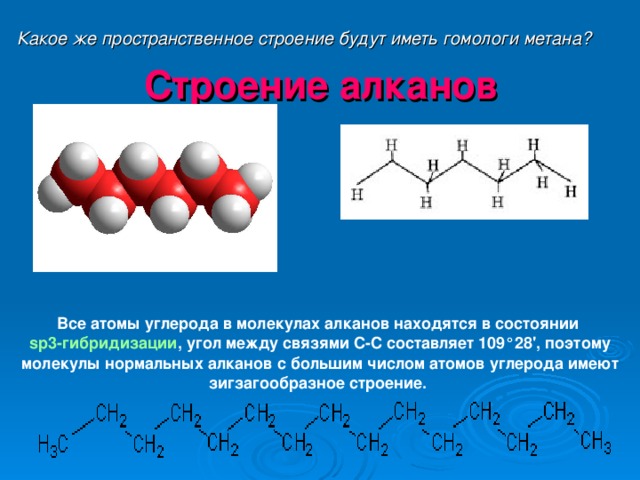
Какое же пространственное строение будут иметь гомологи метана?
Строение алканов
Все атомы углерода в молекулах алканов находятся в состоянии sр3-гибридизации , угол между связями С-C составляет 109°28', поэтому молекулы нормальных алканов с большим числом атомов углерода имеют зигзагообразное строение.
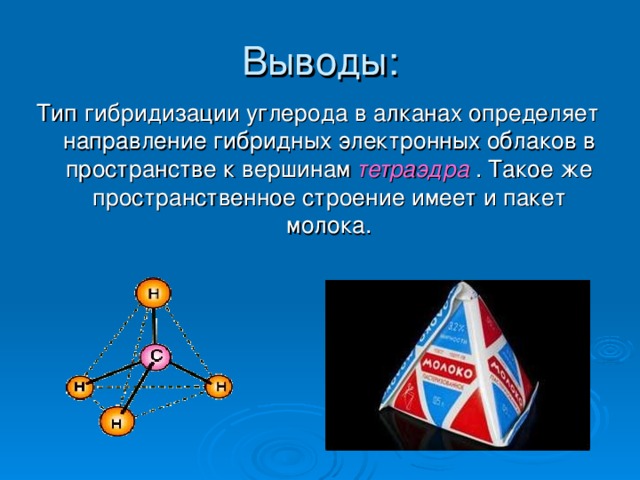
Тип гибридизации углерода в алканах определяет направление гибридных электронных облаков в пространстве к вершинам тетраэдра . Такое же пространственное строение имеет и пакет молока.

Задание для учащихся:
Пользуясь набором шаростержневых моделей составьте несколько молекул конформеров алканов.
Обсудите результаты работы с соседями по парте.
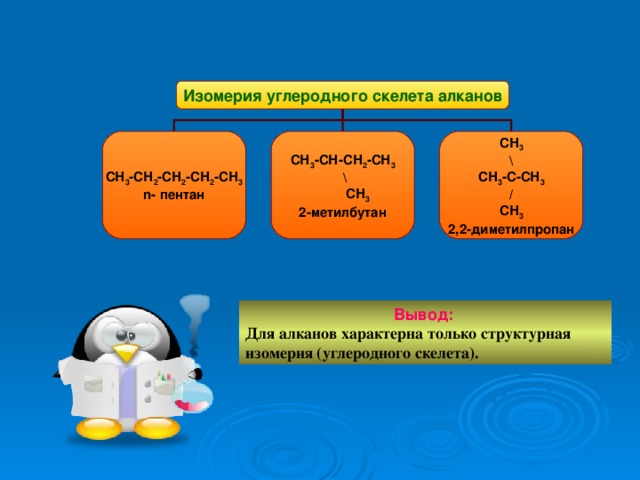
Изомерия углеродного скелета алканов
СН 3 -СН 2 -СН 2 -СН 2 -СН 3
n- пентан
СН 3 -СН-СН 2 -СН 3
\
СН 3
2-метилбутан
СН 3
\
СН 3 -С-СН 3
/
СН 3
2,2-диметилпропан
Вывод:
Для алканов характерна только структурная изомерия (углеродного скелета).
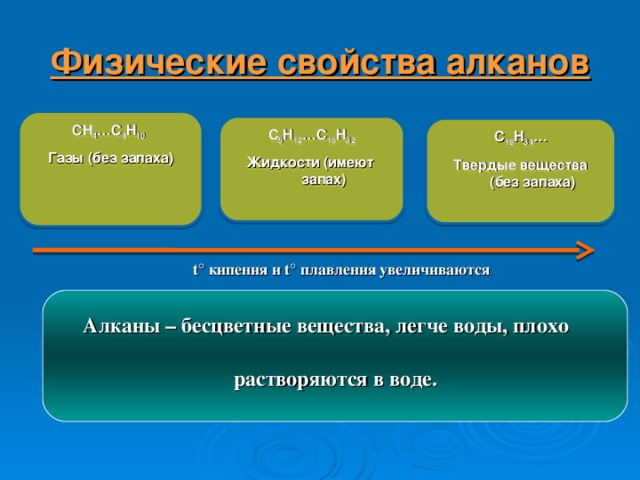
Физические свойства алканов
CH 4 …C 4 H 10
Газы (без запаха)
C 5 H 12 …C 15 H 32
Жидкости (имеют запах)
C 16 H 3 4 …
Твердые вещества (без запаха)
t ° кипения и t ° плавления увеличиваются
Алканы – бесцветные вещества, легче воды, плохо растворяются в воде.

Номенклатура алканов
Алгоритм составления названий органических соединений
(3) (4) (5) (6) (7)
СН 3 – СН – СН 2 – СН 2 – СН 2 – СН – СН 2 – СН 3
! !
(2) СН 2 СН 2 – СН 2 – СН 3
! ( 8) (9) (10 )
(1) СН 3
Данное вещество называется: 3-метил, 7-этил дек ан
- Данное вещество называется: 3-метил, 7-этил дек ан
1. Выбирают наиболее длинную (главную) цепь и нумеруют ее ближе к тому концу, к которому стоит радикал ( заместитель, обозначен желтым цветом).
2. Название строится в следующей последовательности:
А) ПРЕФИКС: состоит из цифры, указывающей на номер углеродного атома, возле которого стоит радикал. Например: 3- и пишется название самого радикала. Например: 3-метил,7-этил……. Если молекула содержит несколько одинаковых радикалов, то после перечисления всех цифр, указывающих их местоположение, к радикалу добавляют числовую приставку ( ди –два, три – три, тетра – четыре). Например: 2,3 – диметил………….., или 3,4,5 – триэтил…….
Б) КОРЕНЬ: ставится в соответствии с гомологическим рядом алканов ( смотрите по количеству атомов углерода в главной цепи)
В) СУФФИКС : у алканов суффикс «АН».

Группа «Химики» Химические свойства алканов
Проблемный вопрос: Почему алканы считают химически инертными веществами?

Реакции замещения у алканов.
СН 3 - СН 3 + С l 2 CH 2 Cl - CH 3 + HCl
ЗАПОМНИ:
NO 2
CH 3 CH CH 3 + HNO 3 CH 3 C CH 3 + H 2 O
CH 3 CH 3
ЗАПОМНИ: Реакция нитрования происходит при нагревании и приводит
к образованию нитросоединений
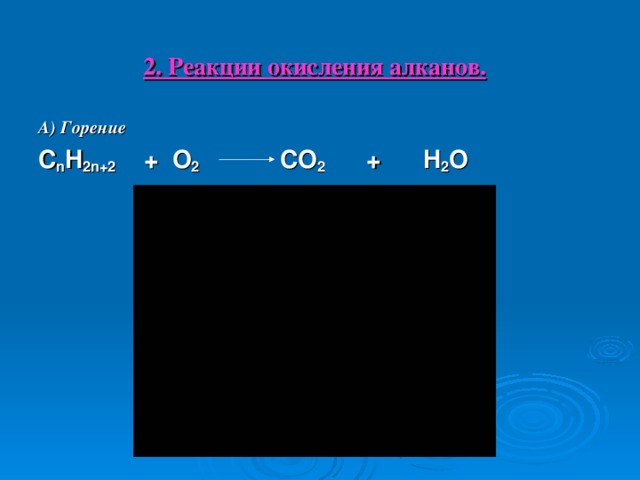
2. Реакции окисления алканов.
А) Горение
C n H 2 n +2 + O 2 CO 2 + H 2 O

Б) Каталитическое окисление алканов.
В промышленности широко применяется каталитическое окисление алканов, в результате которого получаются разнообразные кислородосодержащие соединения: спирты, карбоновые кислоты, альдегиды, кетоны и т. п. Данный процесс можно изобразить следующей схемой: Алкан Гидропероксид Спирт Альдегид

3. Реакции разложения алканов
1. Пиролиз
При сильном нагревании без доступа воздуха происходит полное разложение алканов на простые вещества.
CH 4 C + 2 H 2
t°C
t°C
C 16 H 34
+
C 8 H 18
C 8 H 16
гексадекан
октан
октен

4. Отношение алканов к растворам перманганата калия и бромной воды. Чтобы отличить предельные углеводороды от непредельных используют растворы перманганата калия и брома.

Вывод: Предельные углеводороды не вступают в реакции присоединения. Для них характерны реакции замещения , окисления и разложения. Алканы не обесцвечивают раствор перманганата калия и бромную воду.
Запомни!

Получение метана
а) из природного газа;
б) синтез из оксида углерода ( II ) и водорода (из синтез-газа):
а) гидролиз карбида алюминия:
б) сплавление солей уксусной кислоты (ацетатов) со щелочами:
Ni, 300°C
H 2 O
+
CH 4 ↑
3
H 2
CO
+
+
Al 4 C 3
H 2 O
+
CH 4 ↑
3
12
Al(OH) 3
4
t°
Na 2 CO 3
+
CH 4 ↑
NaOH
+
CH 3 COONa
(твердый)
ацетат натрия
(твердый)
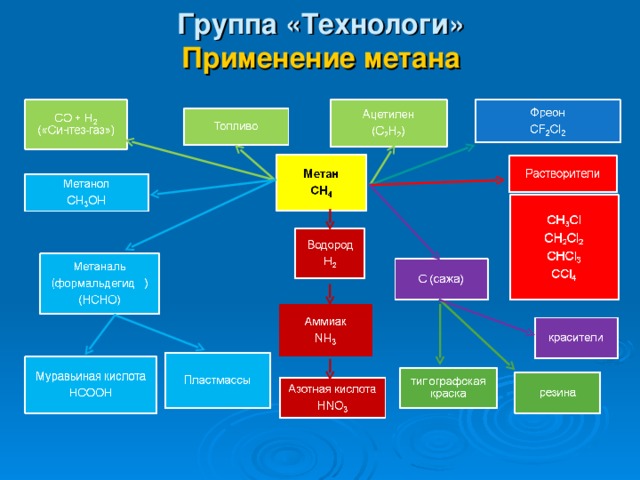
Группа «Технологи» Применение метана
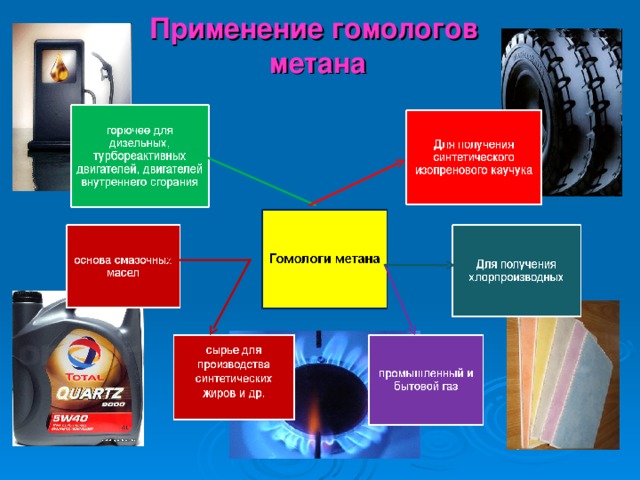
Применение гомологов метана

Группа «Экологи». О вреде алканов и их производных.
Соединения углеводородов, выброшенных с выхлопными газами и представляющие собой смесь нескольких сотен химических соединений, являются причиной многих хронических заболеваний.
Утечка нефти приводит
к экологическим катастрофам.
Углеводороды
при определенных метеорологических условиях активно способствуют образованию смога.

Как алканы
влияют на климат?
Выделяемый из болот метан считается одним из основных парниковых газов и остается предметом активных обсуждений и исследований в связи с проблемами глобального изменения климата.
Какие птицы помогали шахтёрам? Канарейки очень чувствительны к содержанию в воздухе метана. Эту особенность использовали в своё время шахтёры, которые, спускаясь под землю, брали с собой клетку с канарейкой. Если пения давно не было слышно, значит следовало подниматься наверх как можно быстрее.
6. Радикал – это
а) группа атомов с неспаренными электронами
б) группа атомов, отличающаяся от метана на СН 2 -
в) группа атомов, имеющая положительный заряд
г) функциональная группа атомов,
7. Установите порядок для определения названия УВ
а) Определяют местонахождение радикалов
б) Выбирают самую длинную цепь и нумеруют атомы углерода в ней
в) Определяют корень названия по числу атомов углерода в длинной цепи
г) Составляют приставку в виде цифр и греческих числительных
8. Установите соответствие:
1. Пропан а) СН 3 -СН 2 -СН 2 -СН 2 -СН 2 -СН 2 -СН 2 - СН 3
2. Пентан б) СН 3 -СН 2 -СН 3
3. Бутан в) СН 3 -СН 2 -СН 2 -СН 3
4. Октан г) СН 3 -СН 2- СН 2 -СН 2 -СН 3
9. Среди данных формул найдите 2 изомера:
а) СН 3 -СН 2 -СН 2 -СН 2- СН 3
б) СН 3 -СН 2 -СН 2 -СН 3
в) СН 3 -СН-СН 2 -СН 3
\
СН 3
10. Формулы только алканов записаны в ряду:
а) С 3 Н 6 , С 2 Н 4 , С 6 Н 14
б) С 4 Н 10 , С 2 Н 6 , С 3 Н 8
в) С 2 Н 2 , С 3 Н 8 , С 6 Н 6
г) С 6 Н 6 , С 4 Н 8 , С 2 Н 6
Готовимся к ЕГЭ!
1.Гомологический ряд алканов
описывается общей формулой
а) С nH 2 n -2
б) CnH 2 n
в) С nH 2 n +2
г) CnH 2 n +1
2. В пропане связи углерод-углерод:
а) одинарные
б) двойные
в) полуторные
г) Пи-связи
3. Молекула метана имеет форму
а) пирамиды
б) параллепипеда
в) тетраэдра
г) конуса
4. Для алканов характерна гибридизация:
а) SP
б) SP 2
в) SP 4
г) SP 3
5. Угол между атомами углерода в алканах
составляет:
а) 120 градусов
б) 90 градусов
в) 109 градусов
г) 110 градусов

Взаимопроверка. Правильные ответы:
1
2
в
а
3
4
в
г
5
6
в
а
7
Б,а,г,в
8
1-б, 2-а,
3-г
4-в
9
10
А,в
б

2. Закончить уравнения, назвать получившиеся вещества, указать области их применения.
а. C 4 H 10 + O 2 =
б. этан + Cl 2 =
в. C 5 H 12 →
t°C

4. Решите задачу:
В состав органического вещества входит углерод, массовая доля которого – 92,23% и водород массовая доля которого 7,77%. Относительная плотность паров этого вещества по водороду равна 13. Определите молекулярную формулу вещества.
Рефлексия
Прием «Гора успеха!» Произведи самооценку и определи свое положение на «Горе успеха»

ДОМАШНЕЕ ЗАДАНИЕ:
§ 7-8 , упр. 13-17 (с. 28), задачи 1-2, ЕГЭ: 1.4.3. 1.4.4.

Используемая литература
- «Репетитор по химии (издание 15-ое)», под редакцией Егорова А. С., Феникс – Ростов-на-Дону, 2006
- Габриелян О. С., Маскаев Ф. Н., Пономарев С. Ю., Теренин В. И. « Химия 10 класс: профильный уровень». (Учебник для общеобразовательных учреждений), Дрофа – Москва, 2005
- Рудзитис Г. Е., Фельдман Ф. Г. «Химия 10: органическая химия (Учебник для 10 класса средней школы)», Просвещение – Москва, 1991
- Перекалин В. В., Зонис С. А. «Органическая химия (учебное пособие для студентов педагогических институтов по химическим и биологическим специальностям)», Просвещение – Москва, 1982
- «Органическая химия. Том1 (Основной курс)» под редакцией Н. А. Тюкавкиной (учебник для студентов вузов по специальности «Фармация»), Дрофа – Москва, 2004

1. http://us.fotolia.com/id/1005661
2. http :// aerphis.wordpress.com /
3. http://www.himlib.ru/index.
- 3. http://www.himlib.ru/index.
4. http://festival.1september.ru/articles
- 4. http://festival.1september.ru/articles
- 4. http://festival.1september.ru/articles
5. http://student.km.ru/ref_show_frame .
- 5. http://student.km.ru/ref_show_frame .
- 5. http://student.km.ru/ref_show_frame .
- 5. http://student.km.ru/ref_show_frame .
6. http :// ido.tsu.ru / schools / chem / data / res / org / uchpos / text /Untitled2.html
- 6. http :// ido.tsu.ru / schools / chem / data / res / org / uchpos / text /Untitled2.html
- 6. http :// ido.tsu.ru / schools / chem / data / res / org / uchpos / text /Untitled2.html
- 6. http :// ido.tsu.ru / schools / chem / data / res / org / uchpos / text /Untitled2.html
- 6. http :// ido.tsu.ru / schools / chem / data / res / org / uchpos / text /Untitled2.html


 Получите свидетельство
Получите свидетельство Вход
Вход



















































 Презентация "Строение и свойства алканов" (10.63 MB)
Презентация "Строение и свойства алканов" (10.63 MB)
 0
0 1799
1799 82
82 Нравится
0
Нравится
0


