
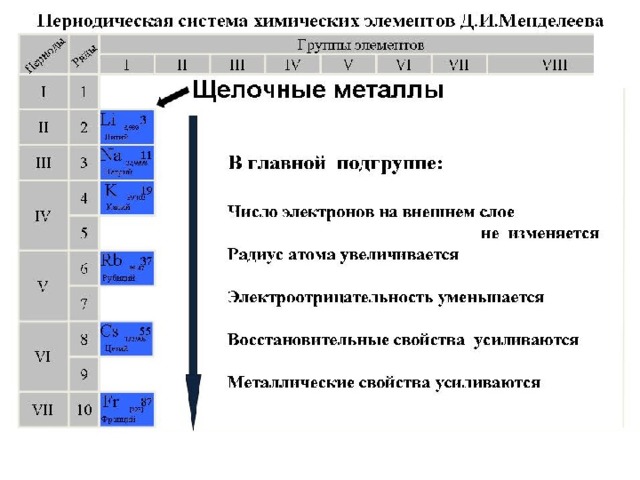
ЩЕЛОЧНЫЕ МЕТАЛЛЫ

Щелочные металлы — это элементы I-й группы периодической таблицы химических элементов):
- литий Li,
- натрий Na,
- калий K,
- рубидий Rb,
- цезий Cs,
- франций Fr
При растворении щелочных металлов в воде образуются растворимые гидроксиды, называемые щёлочами.

ИСТОРИЯ ОТКРЫТИЯ ШЕЛОЧНЫХ МЕТАЛЛОВ
- В 1807 г. в Англии Г. Деви открыл натрий и калий.
«Натрун» - сода, «алкали» - щелочь.
- В 1817г. в Швеции А. Арфедсоном был открыт литий.
«Литос» - камень.
- В 1860 – 1861г.г. в Германии Р.Бунзен и Г.Кирхгоф открыли рубидий «темно-красный» и цезий «небесно-голубой».
- В 1939г. во Франции М. Пере открыл радиоактивный элемент франций, который назвал в честь своей страны – Франции.

Нахождение в природе
Li
Li2O • Al2O3 • 4SiO2 – сподумен
Na
NaCl – каменная соль
Na2SO4 • 10H2O – глауберова соль (мирабилит)
NaNO3 – чилийская селитра
K
KCl • NaCl – сильвинит
KCl • MgCl2 • 6H2O – карналлит
K2O • Al2O3 • 6SiO2 – полевой шпат (ортоклаз)


Плотность металлов
Li- 0,534 г/см 3
Na- 0,971 г/см 3
K - 0,863 г/см 3
Rb – 1,532 г/см 3
Cs - 2,44 г/см 3
Температура плавления
Li - 180 о С
Na - 98 о С
K - 64 о С
Rb - 39 о С
Cs - 27 о С

Металлический литий
Аналогично натрию и калию, металлический литий хранят в плотно закрытых
банках под слоем сухого минерального масла или керосина.

Все щелочные металлы - очень сильные восстановители, в соединениях проявляют единственную степень окисления +1. Восстановительная способность увеличивается в ряду
– Li–Na–K–Rb–Cs

Физические свойства лития

Физические свойства натрия

МЕТАЛЛИЧЕСКИЙ НАТРИЙ

Реакция большого количества натрия с водой.
Большие куски натрия взаимодействуют с водой со взрывом. Во все стороны летят
частички натрия, образуется облако аэрозоля щелочи.
В эксперименте использован кусок натрия массой примерно 100 г.

Применение щелочных металлов и их соединений
- Алюминий-литиевые сплавы нашли применение в авиационной и космической технике.
- Литий используется при производстве литиевых аккумуляторов, такие аккумуляторы применяются в кардиостимуляторах.
- Расплавы натрия и калия используются в качестве теплоносителей в атомных реакторах и в авиационных двигателях.
- Пары натрия используются в люминесцентных светильниках, при производстве калия, титана, циркония и тантала, а также тетраэтилсвинца – добавки, улучшающей детонационные свойства бензина, натрий служит катализатором в производстве каучука.

Цезий нашел применение в фотоэлементах .
Перекись натрия в больших количествах используется при производстве моющих средств. В лаборатории ее применяют как энергичный окислитель в водном растворе и в расплаве. Гидроксиды калия и натрия в технике и в лаборатории часто применяют в качестве сильных оснований.


 Получите свидетельство
Получите свидетельство Вход
Вход


























 Презентация по химии "Щелочные металлы" (2.87 MB)
Презентация по химии "Щелочные металлы" (2.87 MB)
 0
0 898
898 42
42 Нравится
0
Нравится
0






