
ДОМОЙ
Кислород
Оксиды
Горение

Общая характеристика
- Химический знак - O
- A r -16
- Химическая формула - О 2
- М r (О 2 )=32
- М (О 2 )= 32г/моль
- Валентность – II
- Самый распространённый элемент на Земле

Нахождение в природе
- Кислород - самый распространенный в земной коре химический элемент (49,4%) . Он присутствует в воздухе (20 , 9% О 2 ) , входит в состав воды , различных минералов – оксидов, силикатов, карбонатов и др.
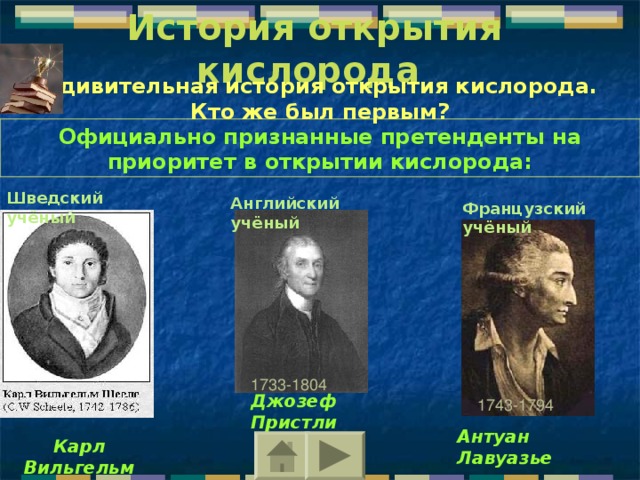
История открытия кислорода
Удивительная история открытия кислорода. Кто же был первым?
Официально признанные претенденты на приоритет в открытии кислорода:
Шведский учёный
Английский учёный
Французский учёный
1733-1804
Джозеф Пристли
1743-1794
Антуан Лавуазье
Карл Вильгельм Шееле

Шееле действительно был первым исследователем, получившим относительно чистую пробу кислорода (1772). Однако он опубликовал свои результаты в 1777 г., позже, чем это сделал Джозеф Пристли (1733-1804), поэтому формально он не может считаться первооткрывателем кислорода. Но во многих академических изданиях и справочниках по химии приоритет отдаётся именно Карлу Вильгельму Шееле. Кроме того, ему принадлежит неоспоримый приоритет открытия химических элементов хлора Cl, фтора F, бария Ba, молибдена Mo, вольфрама W... Несмотря на то, что Шееле не имел высшего образования и был рядовым аптекарем, в возрасте 32 лет он был избран членом Стокгольмской академии наук. Ему предлагали кафедру в Упсальском университете, работу в центре шведской горнометаллургической промышленности, кафедру в Берлинском университете, однако ученый отклонял все предложения, предпочитая заниматься своими опытами.

Годы упорного самоотверженного труда, к сожалению, подорвали здоровье этого поразительно целеустремленного человека, и он прожил всего до 44 лет. В истории химии с открытием Шееле цианистого водорода связан ещё один миф: якобы его первооткрыватель погиб в момент открытия. Это, так сказать, полуправда. На самом деле Шееле впервые получил синильную кислоту из желтой кровяной соли в 1782 г., а умер в 1786 г., в возрасте 44 лет. Однако не подлежит сомнению, что Шееле погубили органолептические методы исследования. В XVIII веке было принято пробовать на вкус продукты реакции, а Шееле, помимо цианидов, работал с соединениями ртути и мышьяка... Умер К.В.Шееле в Чёпинге 21 мая 1786 г.

Вторым официально признанным претендентом на лавры первооткрывателя кислорода является английский священник и химик Джозеф Пристли .
1 августа 1774 г. Д. Пристли наблюдал выделение «нового воздуха» при нагревании с помощью двояковыпуклой линзы без доступа воздуха ртутной окалины, находящейся под стеклянным колпаком. На современном химическом языке это вещество называется оксидом ртути. Получаемый при нагревании оксида ртути неизвестный ему газ он выводил через трубку в сосуд, заполненный не водой, а ртутью, так как Пристли уже ранее убедился в том, что вода слишком хорошо растворяет газы. В собранный газ Пристли из любопытства внёс тлеющую свечу, и она вспыхнула необыкновенно ярко. Вы можете теперь представить, как трудно было изучать химию во времена, когда химические формулы ещё не были изобретены.

То, что мы можем записали коротким химическим уравнением, Пристли описал в 1774 г. следующим образом: «Я поместил под перевернутой банкой, погруженной в ртуть, немного порошка «меркуриус кальцинатус пер се». Затем я взял небольшое зажигательное стекло и направил лучи Солнца прямо внутрь банки на порошок. Из порошка стал выделяться воздух, который вытеснил ртуть из банки. Я принялся изучать этот воздух. И меня удивило, даже взволновало до глубины моей души, что в этом воздухе свеча горит лучше и светлее, чем в обычной атмосфере». Разумеется, такое описание реакции выглядит весьма поэтично по сравнению с обычным химическим уравнением, но, к сожалению, суть произошедшей химической реакции не отражает.

Третий официальный претендент в первооткрывании кислорода, французский химик Антуан Лавуазье (Lavoisier, Antoine Laurent, 1743-1794), начал свою работу, которая привела его к открытию, после эксперимента Джозефа Пристли в 1774 г., и, возможно, благодаря намеку со стороны Пристли. Из своих собственных опытов и предшествовавших опытов Пристли и Шееле Лавуазье уже знал, что с горючими веществами связывается лишь одна пятая часть воздуха, но природа этой части была ему неясна. Когда же Пристли сообщил ему в 1774 г. об обнаружении «дефлогистированного воздуха», он сразу понял, что это и есть та самая часть воздуха, которая при горении соединяется с горючими веществами. Повторив опыты Пристли, Лавуазье заключил, что атмосферный воздух состоит из смеси «жизненного» (кислород) и «удушливого» (азот) воздуха и объяснил процесс горения соединением веществ с кислородом.

В начале 1775 г. Лавуазье сообщил, что газ, получаемый после нагревания красной окиси ртути, представляет собой «воздух как таковой без изменений (за исключением того, что)... он оказывается более чистым, более пригодным для дыхания». К 1777 г., вероятно, не без второго намека Пристли, Лавуазье пришел к выводу, что это был газ особой разновидности, один из основных компонентов, составляющих атмосферу. Правда, сам Пристли как сторонник теории флогистона с таким выводом никогда не смог бы согласиться. Таким образом, более главной фигурой в истории открытия кислорода является Лавуазье, а не Шееле и Пристли. Они просто выделили новый газ - и только.
.

Получение кислорода
1. Лабораторные способы (разложение кислородсодержащих веществ)
- 2HgO 2Hg + O 2 ↑
- 2KMnO 4 → K 2 MnO 4 + MnO 2 + O 2 ↑
- KClO 3 → 2KCl + 3O 2 ↑
(в присутствии катализатора MnO 2 )
- 2H 2 O 2 → 2H 2 O + O 2 ↑
(в присутствии катализатора MnO 2 )
2. Промышленный способ (перегонка сжиженного воздуха)

Промышленное получение кислорода.
Проще всего получить кислород из воздуха, поскольку воздух - не соединение, и разделить воздух не так уж трудно. Температуры кипения азота и кислорода отличаются (при атмосферном давлении) на 12,8° С. Следовательно, жидкий воздух можно разделить на компоненты в ректификационных колоннах так же, как делят, например, нефть. Но чтобы превратить воздух в жидкость, его нужно охладить до -196° С. Можно сказать, что проблема получения кислорода - это проблема получения холода. Чтобы получать холод с помощью обыкновенного воздуха, последний нужно сжать, а затем дать ему расшириться и при этом заставить его производить механическую работу. Тогда в соответствии с законами физики воздух будет охлаждаться. Машины, в которых это происходит, называют детандерами. Чтобы получить жидкий воздух с помощью поршневых детандеров, необходимо давления порядка 200 атмосфер. Но тогда КПД у такой установки будет немногим выше, чем у паровой машины. И сама установка получается сложной, громоздкой, и дорогой.

В конце тридцатых годов советский физик, академик П.Л. Капица предложил использовать в качестве детандера турбину. Главная особенность турбодетандера Капицы заключается в том, что воздух в ней расширяется не только в сопловом аппарате, но и на лопатках рабочего колеса. При этом газ движется от периферии колеса к центру, работая против центробежных сил. Турбодетандер «делает» холод с помощью воздуха, сжатого всего лишь до нескольких атмосфер. Энергия, которую отдает расширяющийся воздух, не пропадает напрасно, она используется для вращения ротора генератора электрического тока. Если газ был сжат очень сильно, то его расширение может привести к такому сильному охлаждению, что часть воздуха сжижается. Жидкий воздух собирают в специальные сосуды, называемые сосудами Дьюара. Из пространства между внутренней и внешней стенками сосуда откачан воздух. Вакуум практически не проводит тепло, поэтому жидкий газ, даже имея очень низкую температуру, может сохраняться в таком сосуде длительное время.

Жидкий кислород кипит при более «высокой» температуре (-183 о С), чем жидкий азот (-196 о С). Поэтому при «нагревании» жидкого воздуха, когда температура этой очень холодной жидкости медленно повышается от -200 о С до -180 о С, прежде всего при -196 о С перегоняется азот (который опять сжижают) и только следом перегоняется кислород. Если такую перегонку жидких азота и кислорода произвести неоднократно, то можно получить весьма чистый кислород. Обычно его хранят в сжатом виде в стальных баллонах, окрашенных в голубой цвет. Характерная голубая окраска баллонов нужна для того, чтобы нельзя было спутать кислород с каким-нибудь другим сжатым газом. Аппаратура для промышленного получения кислорода, как мы видим, очень сложна и энергоемка. Современные установки для разделения воздуха, в которых холод получают с помощью турбодетандеров, дают промышленности, прежде всего металлургии и химии, сотни тысяч кубометров газообразного кислорода.

Физические свойства
- Кислород O 2 - г аз без цвета, вкуса и запаха , умеренно растворим в воде
- Температура кипения – 183 ° С
- Температура плавления – 219 °C
- Относительная плотность по воздуху 1,1
- При Р=760мм.рт.ст. и t= –183 С кислород сжижается

Способы собирания кислорода
Вытеснением в оздуха
Вытеснением воды

Химические свойства
Кислород при нагревании энергично реагирует со многими веществами , при этом выделяются теплота и свет. Такие реакции называют
реакциями горения .
- S + O 2 → SO 2
- 3Fe + 2O 2 → Fe 3 O 4

Применение кислорода
В настоящее время кислород очень широко используется во многих областях человеческой деятельности. Его применяют для интенсификации химических процессов во многих производствах (например, в производстве серной и азотной кислот, в доменном процессе). Кислородом пользуются для получения высоких температур, для чего различные горючие газы (водород, ацетилен) сжигают в специальных горелках.
Смеси жидкого кислорода с угольным порошком, древесной мукой или другими горючими веществами, называемые оксиликвитами , обладают очень сильными взрывчатыми свойствами и применяются при подрывных работах. Кислород давно и широко используют в медицине, и он стал привычным атрибутом медицины критических состояний.

- Оксиды – это бинарные соединения элементов с кислородом (кроме соединений фтора).
- Один из способов получения оксидов – реакция окисления (в частности, горения)
Действие углекислотного огнетушителя

Вода, оксид водорода, H 2 0
простейшее устойчивое в обычных условиях химическое соединение водорода с кислородом (11,19% водорода и 88,81% кислорода по массе), молекулярная масса 18,0160; бесцветная жидкость без запаха и вкуса (в толстых слоях имеет голубоватый цвет), В. принадлежит важнейшая роль в геологической истории Земли и возникновении жизни, в формировании физической
и химической среды, климата и погоды на нашей планете. Без В. невозможно существование живых организмов. В. - обязательный компонент практически всех технологических процессов - как сельскохозяйственного, так и промышленного производства

Газ, необходимый растениям для фотосинтеза
Содержание углекислого газа в атмосфере относительно не велико , всего 0,04—0,03%.
В воздухе, выдыхаемом человеком, углекислого газа 4%.
Растения благодаря фотосинтезу усваивают углекислый газ из атмосферы, превращая минеральные вещества в органические — глюкозу, крахмал.
- Содержание углекислого газа в атмосфере относительно не велико , всего 0,04—0,03%. В воздухе, выдыхаемом человеком, углекислого газа 4%. Растения благодаря фотосинтезу усваивают углекислый газ из атмосферы, превращая минеральные вещества в органические — глюкозу, крахмал.

В природе
C ухой лед – тоже CO 2
Один из распространенных оксидов–диоксид углерода CO 2 – с одержится в составе вулканических газов.
- Главное применение сухого льда — хранение и перевозка продуктов: рыбы, мяса, мороженого.
- Ценность сухого льда заключается не только в его охлаждающем действии но и в том, что проду к ты в углекислом газе не плесневеют, не гниют. .
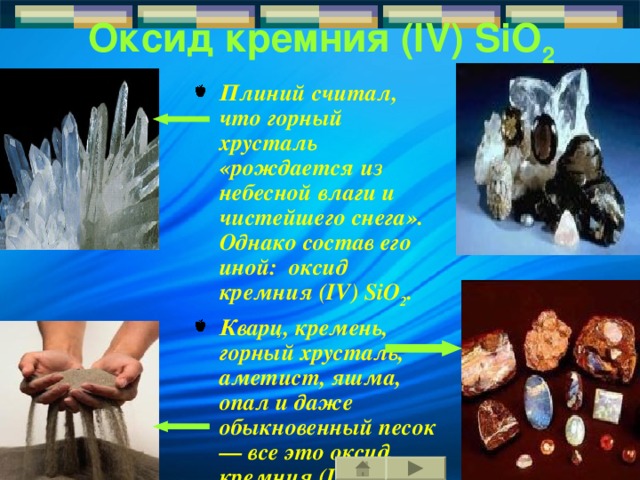
Оксид кремния ( IV ) SiO 2
- Плиний считал, что горный хрусталь «рождается из н ебесной влаги и чистейшего снега ». Однако состав его иной: оксид кремния ( IV ) SiO 2 .
- Кварц, кремень, горный хрусталь, аметист, яшма, опал и даже обыкновенный песок— вс е это оксид кремния ( IV ).

ОКСИД ХРОМА Cr 2 O 3
- Оксид хрома(III) – Cr 2 O 3 –кристаллы зеленого цвета, нерастворимые в воде.
- Cr 2 O 3 используют как пигмент при изготовлении декоративного зеленого стекла и керамики.
- П аста ГОИ (“Государственный оптический институт”) на основе Cr 2 O 3 применяется для шлифовки и полировки опти ч еских изделий, в ювелирном деле.

Оксид магния MgO
- Оксид магния – основный оксид.
- Магниевая лента, вступив в реакцию с кислородом воздуха, горит ярким белым пламенем.

Оксид цинка ZnO
вещество белого цвета, используется для приготовления белой масляной краски (цинковые белила).
- цинковыми белилами можно красить любые поверхности, в том числе и те, которые подвергаются воздействию атмосферных осадков.
- фармацевты делают из оксида цинка вяжущий и подсушивающий порошок для наружного применения.
- такими же ценными свойствами обладает оксид титана (IV) – TiO 2 . Он тоже имеет красивый белый цвет и применяется для изготовления титановых белил. .…
БЕЛИЛА
Горение, сложное, быстро протекающее химическое превращение, сопровождающееся выделением значительного количества тепла и обычно ярким свечением (пламенем).

Лики огня
Огонь – это
- горящие светящиеся газы высокой температуры, пламя;
- боевая стрельба;
- свет от осветительных приборов;
- внутреннее горение, страсть.
(С. И. Ожегов, Н. Ю. Шведова. Толковый словарь русского языка. – М., 1997.)

Он всегда бывает разный,
Удивительный огонь.
То буяном безобразным,
То тихоней из тихонь.
То он змейкой торопливой
По сухой скользит коре,
То косматой рыжей гривой
Полыхает на заре…
Да, огонь бывает разный –
Бледно-желтый, ярко-красный,
Синий или золотой,
Очень добрый, очень злой.

Олимпийский огонь
Раз в два года в мире происходит событие, по форме напоминающее перенос «живого огня». Это бывает в годы Олимпийских игр. Каждая олимпиада открывается торжественным зажиганием олимпийского огня. В знак уважения к основателям олимпиад огонь доставляется из Греции. Тысячи зрителей рукоплещут огню состязаний сильных и смелых, огню дружбы посланцев всех народов планеты Земля.

Огонь на войне
В 673 г. защитники Константинополя, осажденного арабами, уничтожили вражеские корабли, пустив в ход грозное и неизвестное дотоле оружие – «греческий огонь». «Он летел по небу, будто крылатый дракон величиной с бочку, гремя как гром, с быстротою молнии рассеивая ночную тьму своим страшным сверканием».

Вечный огонь
Огонь, пламя, как одно из проявлений реакций горения, имеют свое монументальное отражение. Вечный огонь горит у памятников славным сынам нашей Родины, павшим в борьбе за свободу своего народа, за его счастье и будущее…
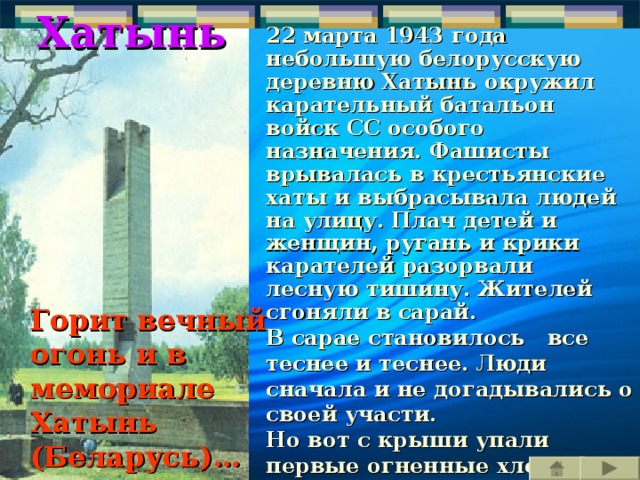
Хатынь
22 марта 1943 года небольшую белорусскую деревню Хатынь окружил карательный батальон войск СС особого назначения. Фашисты врывалась в крестьянские хаты и выбрасывала людей на улицу. Плач детей и женщин, ругань и крики карателей разорвали лесную тишину. Жителей сгоняли в сарай.
В сарае становилось все теснее и теснее. Люди сначала и не догадывались о своей участи.
Но вот с крыши упали первые огненные хлопья. Страшная догадка обожгла их сознание. Их сжигают живыми! Пламя разгоралось все ярче… 149 жителей Хатыни, из них 75 детей, приняли мученическую смерть в огне.
Горит вечный огонь и в мемориале Хатынь (Беларусь)…
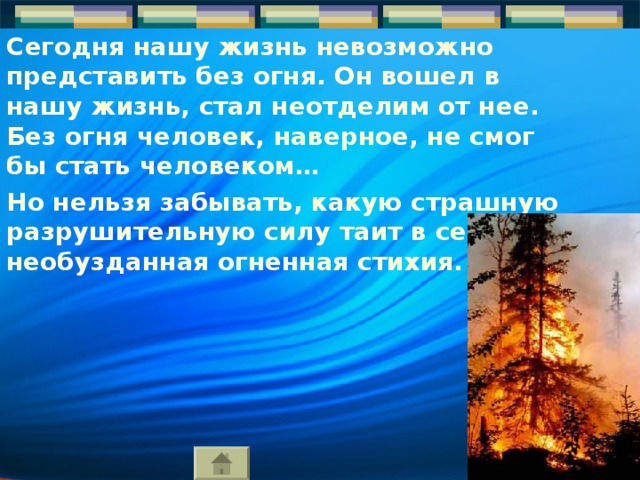
Сегодня нашу жизнь невозможно представить без огня. Он вошел в нашу жизнь, стал неотделим от нее. Без огня человек, наверное, не смог бы стать человеком…
Но нельзя забывать, какую страшную разрушительную силу таит в себе необузданная огненная стихия.
Химический знак - O
Ar-16
Химическая формула - О2
М (О2)= 32г/моль
Валентность – II
Самый распространённый элемент на Земле.

 Получите свидетельство
Получите свидетельство Вход
Вход













































 Презентация по химии на тему "Кислород" (1.23 MB)
Презентация по химии на тему "Кислород" (1.23 MB)
 0
0 1419
1419 139
139 Нравится
0
Нравится
0



