1. Классы неорганических соединений
Все неорганические вещества по составу делятся на простые и сложные.
Простые вещества по свойствам делятся на металлы и неметаллы. Металлы образованы элементами металлами (Cu, Al, Fe, Zn, K и др.), неметаллы образованы элементами неметаллами (H2, O2, O3, Cl2, N2, S, P и др.). Сложные вещества по составу и свойствам делятся на четыре основных класса: оксиды, гидрооксиды, кислоты, соли.
Названия, свойства, получение основных классов сложных неорганических соединений.

Оксиды. Молекулы состоят из двух элементов, один из которых кислород.
Название: к слову «оксид» прибавляют название элемента в родительном падеже и указывают валентность, если она у элемента переменная. MgO – оксид магния, SO2 – оксид серы (IV), SO3 – оксид серы (VI).
По химическим свойствам оксиды делятся на солеобразующие (в химических реакциях образуют соли) и несолеобразующие (NO, N2O, SiO). Солеобразующие оксиды делят на основные, кислотные, амфотерные.
Основные оксиды. Им соответствуют основания, образуют основные оксиды только металлы Na2ONaOH, CaOCa(OH)2
Химические свойства. Основные оксиды взаимодействуют:
а) с водой (оксиды щелочных и щелочноземельных металлов), при этом образуется щелочь Na2O+H2O=2NaOH;
б) с кислотами, при этом образуются соль и вода. BaO+2HNO3=Ba(NO3)2+H2O
в) с кислотными оксидами, при этом образуется соль. MgO+SO2=MgSO3
Кислотные оксиды. Им соответствуют кислоты; образуют кислотные оксиды неметаллы, а также металлы в высших степенях окисления.
+6 +7
CO2H2CO3, SO3H2SO4, CrO3H2CrO4, Mn2O7HMnO4
(Cr, Mn – металлы).
Химические свойства. Кислотные оксиды взаимодействуют:
а) с водой, при этом образуется кислота SO2+H2O=H2SO3. Некоторые оксиды, например SiO2, не взаимодействуют с водой;
б) с основаниями, при этом образуется соль
SO2+2NaOH=Na2SO3+H2O
в) с основными оксидами, при этом образуется соль
SO2+Na2O=Na2SO3
Амфотерные оксиды. Это оксиды некоторых металлов, которые проявляют свойства как основных, так и кислотных оксидов.
К ним относятся оксиды: Al2O3, ZnO, MnO2, Cr2O3 и др.
Химические свойства. Амфотерные оксиды, в отличие от основных и кислотных, взаимодействуют как с кислотами, так и с щелочами. ZnO+2HCl=ZnCl2+H2O. Здесь ZnO проявляет характер основного оксида.
ZnO+2NaOH=Na2ZnO2+H2O. Здесь ZnO проявляет характер кислотного оксида.
Получение оксидов.
1. При взаимодействии простых веществ с кислородом:
4Al+3O2=2Al2O3, 4P+5O2=2P2O5
2. При взаимодействии сложных веществ с кислородом: CH4+2O2=CO2+2H2O, 2H2S+3O2=2H2O+2SO2
3. При разложении сложных веществ (оснований, кислот, солей): Ca(OH)2=CaO+H2O,
2H3PO4=3H2O+P2O5,
CaCO3=CaO+CO2

Гидрооксиды (основания). Молекулы состоят из одного атома металла и гидроксогрупп (OH-).
Название: к слову «гидрооксид» прибавляем название металла и валентность, если она у металла переменная. KOH – гидрооксид калия, Fe(OH)2 –гидрооксид железа (II).
Кислотность основания определяется числом гидрооксогрупп в молекуле.
Остаток от основания – это положительный по заряду ион, который остается после отрыва от молекулы одной или нескольких гидроксогрупп. Например, Ca(OH)2 остатки от основания: (CaOH)1+ и Ca2+. Величина положительного заряда остатка от основания определяется числом оторвавшихся гидроксогрупп.
Щелочами называют хорошо растворимые в воде основания, это основания щелочных и щелочноземельных металлов (KOH, NaOH, Ca(OH)2, Ba(OH)2 и др.). Гидрооксиды всех других металлов нерастворимы в воде.
Химические свойства.
Основания взаимодействуют с кислотами (реакция нейтрализации).
2NaOH+H2SO4=Na2SO4+2H2O
Щелочи взаимодействуют с кислотными оксидами.
Ca(OH)2+CO2=CaCO3+H2O
Щелочи взаимодействуют с солями
2NaOH+ CuCl2=Cu(OH)2+2NaCl
При нагревании основания (кроме NaOH и KOH) разлагаются на оксид металла и воду
Ca(OH)2=CaO+H2O
Амфотерные основания взаимодействуют как с кислотами, так и с щелочами. Например, Al(OH)3, Zn(OH)2, Mn(OH)4, Cr(OH)3 и др.
Zn(OH)2+2HCl=ZnCl2+2H2O
Zn(OH)2+2NaOH=Na2ZnO2+2H2O
Получение оснований.
Щелочи получают при взаимодействии металла или оксида с водой:
2Na+H2O=2NaOH+H2
Na2O+H2O=2NaOH
Нерастворимые в воде основания получают при взаимодействии водного раствора соли со щелочью:
BiCl3+3NaOH=Bi(OH)3+3NaCl

Кислоты. Молекулы состоят из атомов водорода и кислотного остатка.
Формулы, названия кислот и кислотных остатков необходимо знать наизусть (таблица).
Различают кислоты бескислородные (HCl, H2S, HBr, HJ и др.) и кислородные (H2SO4, H2CO3, HNO3 и др.).
Таблица Название кислот и кислотных остатков.
| Название кислоты | Формула | Кислотный остаток | Название кислотного остатка |
| Хлороводородная (соляная) | HCl | Cl | Хлорид |
| Бромоводородная | HBr | Br | Бромид |
| Фтороводородная (плавиковая) | HF | F | Фторид |
| Иодоводородная | HJ | J | Иодид |
| Азотная | HNO3 | NO3 | Нитрат |
| Азотистая | HNO2 | NO2 | Нитрит |
| Серная | H2SO4 | SO42 | Сульфат |
|
|
| HSO4 | Гидросульфат |
| Сернистая | H2SO3 | SO32 | Сульфит |
|
|
| HSO3 | Гидросульфит |
| Сероводородная | H2S | S 2 | Сульфид |
|
|
| HS | Гидросульфид |
| Угольная | H2CO3 | CO32 | Карбонат |
|
|
| HCO3 | Гидрокарбонат |
| Кремниевая | H2SiO3 | SiO32 | Силикат |
| Фосфорная | H3PO4 | PO43 | Фосфат |
|
|
| HPO42 | Гидрофосфат |
|
|
| H2PO4 | Дигидрофосфат |
| Марганцовая | HMnO4 | MnO4 | Перманганат |
| Хромовая | H2CrO4 | CrO42 | Хроматы |
| Дихромовая | H2Cr2O7 | Cr2O72 | Дихроматы |
Основность кислоты определяется числом атомов водорода, способных замещаться на металл. Одноосновные – HCl, HNO3, HJ, двухосновные – H2S, H2CO3, H2SO4, трехосновные – H3PO4, H3AsO4.
Кислотный остаток – это отрицательно заряженный ион, который остается после отрыва от молекулы кислоты одного или нескольких катионов водорода. Например, H2SO4, кислотные остатки (HSO4) 1, (SO4)2.
Величина отрицательного заряда остатки определяется числом оторвавшихся катионов водорода.
Химические свойства кислоты. Кислоты взаимодействуют с :
Основаниями (реакция нейтрализации), образуются соль и вода.
H3PO4+3NaOH=Na3PO4+3H2O
Основными оксидами, образуется соль и вода.
2HNO3+CaO=Ca(NO3)2+H2O
Солями, образуется кислота, средняя или кислая соль, или только кислая соль.
BaCl2+H2SO4=BaSO4+2HCl
(средняя соль)
NaCl+H2SO4=NaHSO4+HCl
(кислая соль)
CaCO3+H2CO3=Ca(HCO3)2
(кислая соль)
Металлами. В зависимости от природы кислоты, ее концентрации, активности металла (см. ряд напряжений металлов) образуются разные продукты реакции.
В ряду напряжений металлы располагаются в порядке возрастания величины их стандартных потенциалов. Чем меньше величина потенциала, тем выше восстановительная способность этого металла, и тем ниже окислительная способность его ионов.
Li K Ca Na Mg Al Mn Zn Cr Fe Ni Sn Pb H2 Cu Hg Ag Pt Au

Усиление восстановительных свойств.
Соляная HCl и серная разбавленная H2SO4 взаимодействуют с металлами, расположенными в ряду напряжений до водорода, при этом образуется соль и выделяется H2
2HCl+Zn=ZnCl2+H2
H2SO4 разб+Zn=ZnSO4+H2
Концентрированная H2SO4 (при нагревании) взаимодействует практически со всеми металлами (кроме Pt и Au). При этом образуется соль, вода и оксид серы (IV)
Cu+2H2SO4=CuSO4+SO2+H2O
При взаимодействии азотной кислоты с металлами водород не выделяется. В зависимости от концентрации кислоты и активности металла, азотная кислота (N+5) может восстанавливаться до соединений:
+4 +3 +2 +1 0 -3 -3
NO2, HNO2, NO, N2O, N2, NH3(NH4 NO3)
Схема взаимодействия HNO3 с металлами и продукты ее восстановления: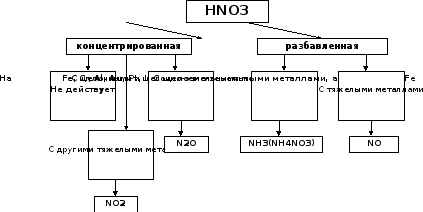
Например:
Zn+4HNO3 конц.=Zn(NO3)2+2NO2+2H2O
4Zn+10HNO3 разб.=4Zn(NO3)2+NH4NO3+3H2O
Получение кислот.
При взаимодействии кислотного оксида с водой:
P2O5+3H2O=2H3PO4
Бескислородные кислоты – при растворении в воде продуктов соединения неметаллов с водородом:
H2+Cl2=2HCl, раствор хлороводорода в воде – хлороводородная кислота
H2+S=H2S, раствор в воде – сероводородная кислота.
При действии на соли других кислот (более сильных или менее летучих, чем кислоты, образующие соли):
2CH3COONa+H2SO4=2CH3COOH+Na2SO4
FeS+2HCl=FeCl2+H2S
NaCl+H2SO4=NaHSO4+HCl

Соли. Молекулы состоят из остатка от основания и кислотного остатка. Например:





 Na 2 SO 4 , Ca HPO4 , Ca OH Cl
Na 2 SO 4 , Ca HPO4 , Ca OH Cl
От кислоты
От кислоты
Остаток от основ-ания
Остаток от основ-ания
Остаток от основ-ания
От кислоты
Названия солей: к названию кислотного остатка добавляем название остатка от основания в родительном падеже и валентность металла, если она переменная.
Al2(CO3)3 – карбонат алюминия
Fe(H2PO4)3 – дигидрофосфат железа (III)
[Al(OH)2]2SO4 – сульфат дигидроксоалюминия
«ди» - два, «гидро» - водород, «гидроксо» - гидроксильная группа.
Соли подразделяют на средние, кислые, основные, двойные, комплексные.
Средние соли. Продукт полного замещения атомов водорода в кислоте на атомы металла.
H3PO4+3NaOH=Na3PO4+3H2O (фосфат Na – средняя соль)
Кислые соли. Продукт неполного замещения атомов водорода в кислоте на атомы металла. Кислые соли образуют только многоосновные кислоты.
H3PO4+Na OH=NaH2PO+H2O (дигидрофосфат натрия – кислая соль)
H3PO4+2NaOH=Na2HPO4+2H2O (гидрофосфат натрия – кислая соль)
Основные соли. Продукт неполного замещения гидроксогрупп в основании на кислотный остаток. Основные соли образуют только многокислотные основания.
Cu(OH)2+HCl=CuOHCl+H2O (хлорид гидроксомеди – основная соль)
Двойные соли. Атомы водорода в кислоте замещаются атомами разных металлов или гидроксогруппы в основании замещаются различными кислотными остатками. Например: KAl(SO4)2, Ca(OCl)Cl
Комплексные соли. В состав которых входит комплексный ион. Например, K4[Fe(CN)6] , где [Fe(CN)6]-4 – комплексный ион.
Химические свойства солей. Соли взаимодействуют:
Со щелочами MgCl2+2NaOH=Mg(OH)2+NaCl
С кислотами Ba(NO3)2+H2SO4=BaSO4+2HNО3
Между собой (соль с солью) CaCl2+Na2CO3=CaCO3+2NaCl
С металлами (более активный металл вытесняет менее активный из соли) CuSO4+Fe=FeSO4+Cu
Некоторые соли разлагаются при нагревании CaCO3=CaO+CO2
Получение.
Металл + неметалл Fe+S=FeS
Металл + кислота Zn+2HCl=ZnCl2+H2
Металл + соль Cu+Hg(NO3)2=Cu(NO3)2+Hg
Металл + основание Zn+2NaOH=Na2ZnO2+H2
Основной оксид + кислота CaO+2HCl=CaCL2+H2O
Основной оксид + кислотный оксид MgO+SiO2=MgSiO3
Основание + кислота 2 KOH+H2SO4=K2SO4+2H2O
Основание + кислотный оксид 2NaOH+CO2=Na2CO3+H2O
Соль + основание CuCL2+2NaOH=Cu(OH)+2NaCl
Соль + кислота BaCL2+H2SO4=BaSO4+2HCl
Соль + кислотный оксид CaCO3+CO2+H2O=Ca(HCO3)2
Соль + соль Ba(NO3)2+Na2SO4=BaSO4+2NaNO3
Соль + неметалл 2KJ+Cl2=2KCl+J2
Генетическая связь между классами
неорганических соединений


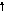
Металл Основной оксид Основание


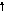
Соль

 Неметалл Кислотный оксид Кислота
Неметалл Кислотный оксид Кислота
2. Тривиальные названия некоторых веществ
| Бертолетова соль | KClO3 |
| Гашеная известь | Ca(OH)2 |
| Гипосульфит | Na2S2O35H2O |
| Глауберова соль | Na2SO410H2O |
| Гипс | CaSO42H2O |
| Глинозем | Al2O3 |
| Едкий натр, каустическая сода | NaOH |
| Едкое кали | KOH |
| Железный купорос | FeSO47H2O |
| Известняк, мел, мрамор | CaCO3 |
| Кальцинированная сода | Na2CO3 |
| Марганцовка | KMnO4 |
| Медный купорос | CuSO45H2O |
| Нашатырный спирт | NH4OH |
| Негашеная известь | CaO |
| Пергидроль (30% р-р) | H2O2 |
| Питьевая сода | NaHCO3 |
| Поваренная соль | NaCl |
| Сулема | НgCl2 |
| Сухой лед | CO2(тверд) |
| Углекислый газ | CO2 |
| Угарный газ | CO |
| Хлорная известь | CaOCl2 |
3. Составление молекулярных формул сложных
неорганических соединений.
При составлении формул сложных соединений необходимо в формуле выделить ионы (реальные или условные):
В оксидах – катион элемента, образующего оксид, и анион кислорода (условные ионы);
В основаниях – катион металла и анион гидроксогруппы (реальные ионы);
В солях - катион остатка от основания (в средних и кислых солях катион металла) и анион кислотного остатка (реальные ионы)
Формулы и названия кислот необходимо знать наизусть.
Молекула любого вещества электронейтральна (суммарный заряд=0).
Запомнить!!!
Основной принцип составления формулы – подбор таких соотношений катиона и аниона, чтобы обеспечить электронейтральность молекулы.
Таблица
Последовательность составления формул сложных соединений.
| Последовательность действий | Например, составить формулы |
| Оксид фосфора (V) | Гидрооксид железа (III) | Сульфат аллюминия |
| 1. По названию соединений записать ионы: катион и анион (изучите классы неорганических соединений) | PxOy | Fe(OH)x | Alx(SO4)y |
| 2. Определить заряды катиона и аниона (изучите правила определения заряда ионов) | Px 5+ Oy2- | Fe3+ (OH)x 1- | Alx 3+ (SO4)y 2- |
| 3. Если заряды численно неравны, то с помощью числовых индексов изменяем число катионов и анионов, чтобы абсолютная величина произведения заряда катиона на число катионов была равна абсолютной величине произведения заряда аниона на число анионов в молекуле. | P2 5+ O52- Проверка: Катион: 2(+5)=+10 Анион 5(-2)=-10
+10-10=0 | Fe3+ (OH)3 1- Проверка: Катион: 1(+3)=+3 Анион 3(-1)=-3
+3-3=0 | Al2 3+ (SO4)3 2- Проверка: Катион: 2(+3)=+6 Анион 3(-2)=-6
+6-6=0 |
| Условие электронейтральности при составлении формулы выполнено | P2O5 | Fe(OH)3 | Al2(SO4)3 |
Примечание: Иногда допускают ошибки в составлении формул, т.к. не понимают, какой числовой индекс указывает на число атомов элемента в сложном ионе, а какой на количество сложного иона в молекуле.

 Например: Al2(CO3)3 число кислотных остатков в молекуле
Например: Al2(CO3)3 число кислотных остатков в молекуле
Число атомов кислорода в одном кислотном остатке.
Запомнить!!!
При определении зарядов катионов и анионов можно пользоваться периодической системой Д.И. Менделеева и таблицей растворимости. Следует помнить, что заряд кислотного остатка равен основности данной кислоты, т.е. числу атомов водорода в ней.
Классы неорганических соединений, их классификация, строение, свойства, получение.
Оксиды: классификация, строение, свойства, получение. Основания: классификация, строение, свойства, получение. Кислоты: классификация, строение, свойства, получение. Соли: классификация, строение, свойства, получение. Тривиальные названия некоторых веществ. Составление молекулярных формул сложных неорганических соединений.


 Получите свидетельство
Получите свидетельство Вход
Вход









 Na 2 SO 4 , Ca HPO4 , Ca OH Cl
Na 2 SO 4 , Ca HPO4 , Ca OH Cl

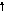



 Неметалл Кислотный оксид Кислота
Неметалл Кислотный оксид Кислота Например: Al2(CO3)3 число кислотных остатков в молекуле
Например: Al2(CO3)3 число кислотных остатков в молекуле








 Материал по химии "Классы неорганических соединений" (42.08 КB)
Материал по химии "Классы неорганических соединений" (42.08 КB)
 0
0 405
405 19
19 Нравится
0
Нравится
0


