
Химические реакции. Типы химических реакций.

- Химические реакции (химические превращения; химические явления) –
это процессы, в результате которых из одних веществ образуются другие, отличающиеся от них по составу и строению.

Закон сохранения массы веществ.
- Масса веществ, вступивших в химическую реакцию, равна массе образовавшихся веществ.
М В Ломоносов.
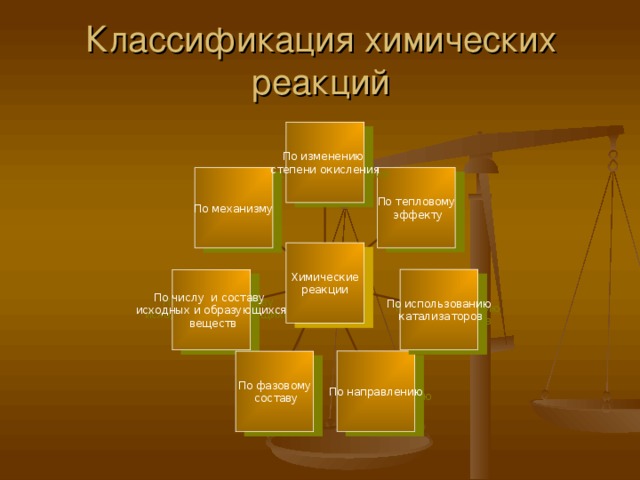
Классификация химических реакций
По изменению
степени окисления
По тепловому
эффекту
По механизму
Химические
реакции
По использованию
катализаторов
По числу и составу
исходных и образующихся
веществ
По направлению
По фазовому
составу

По числу и составу исходных и образующихся веществ
- Разложения
- Соединения
- Обмена
- Замещения
задание : выписать из учебника примеры реакций
стр. 118-120.

По изменению степени окисления
- Al + S Al 2 S 3
- HCl + NaOH NaCl + H 2 O
- Zn + O 2 ZnO
- CuSO 4 + NaOH Cu(OH) 2 + Na 2 SO 4
задание: определите степень окисления.

По тепловому эффекту
вещества реакции -
( разрыв хим. ( образование
связи) хим. Связи)
* H 2 + Cl 2 2 HCl + 184,6 кДж (экзотермическая)
* N 2 + O 2 2 NO - 90,4 кДж
( эндотермическая)

По направлению
- Хим. Реакции.
- Необратимые Обратимые
протекают в одном протекают одновременно
направлении ( до конца) в двух противоположных
направлениях
KClO 3 KCl + O 2 N 2 + 3 H 2 2NH 3 + Q
AlCl 3 + AgNO 3 AgCl + Al(NO) 3

Закрепление
- Задание: К какому типу реакций относится данные процессы? Уравнять реакции.
- Fe + O 2 Fe 3 O 4 + 1116 кДж
- HBr H 2 + Br 2 - Q
- HNO 3 + KOH KNO 3 + H 2 O + Q
- Al 2 O 3 + Fe Fe 2 O 3 + Al

Творческое задание Охарактеризуйте химическую реакцию
- 1. разложение перманганата
- 2. магний взаимодействует с уксусной кислотой
- 3. гидролиз этилформиата
- 4. синтез аммиака
- 5. фенол взаимодействует с гидроксидом натрия
- 6. спиртовое брожение глюкозы
- 7. обугливание крахмала
- 8. гидратация этилена
- 9. оксид азота(2) взаимодействует с кислородом
- 10. гидроксид кальция взаимодействует с ортофосфорной кислотой
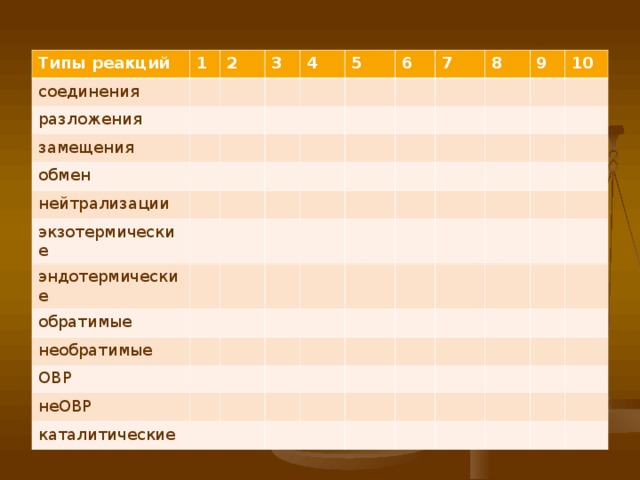
Типы реакций
соединения
1
2
разложения
замещения
3
4
обмен
нейтрализации
5
6
экзотермические
7
эндотермические
8
обратимые
9
необратимые
10
ОВР
неОВР
каталитические

Кинетика – наука о скорости химических реакций.
- Реакции
- Гомогенные Гетерогенные
H 2( г ) + O 2( г ) H 2 O ( г ) Ca ( т ) + O 2( г ) CaO ( т )
U гомог = n / t V U гетер = n / t S
U- скорость реакции
n - количество вещества
t - интервал времени
V - объем
S - площадь соприкосновения
n / V = c c – концентрация молярная
U гомог = c / t

Факторы влияющие на скорость химических реакций.
- Природа реагирующих веществ.
- Температура.
- Концентрации реагирующих веществ.
- Площадь соприкосновения реагирующих веществ.
- Действие катализаторов.

Температура
- Повышение температуры на каждые 10 градусов скорость реакции возрастает в 2-4 раза (температурный коэффициент). Вант-Гофф.
U 2 = U 1 k t/10
Задание: во сколько раз увеличится скорость химической реакции при t от 50 до 100 градусов, если k = 2 ?

Природа реагирующих веществ
- Zn + CH 3 COOH Ca + H 2 O
- Zn + HCl Na + H 2 O
U 1 2
![Концентрация реагирующих веществ Скорость химической реакции прямо пропорционально произведению концентрации реагирующих веществ (закон действующих масс). nA + mB pC U = k [A] n [B] m Задание: Как изменится скорость реакции, если концентрацию каждого из исходных веществ увеличить в 2 раза? 2H 2( г ) + O 2( г ) 2H 2 O ( г )](https://fsd.videouroki.net/html/2013/11/10/98668189/img15.jpg)
Концентрация реагирующих веществ
- Скорость химической реакции прямо пропорционально произведению концентрации реагирующих веществ
(закон действующих масс).
- nA + mB pC
- U = k [A] n [B] m
- Задание: Как изменится скорость реакции, если концентрацию каждого из исходных веществ увеличить в 2 раза? 2H 2( г ) + O 2( г ) 2H 2 O ( г )

Катализ
- Определение
- Виды катализа
- Ингибиторы

Химическое равновесие
- Прямая и обратная реакции
- 2SO 2 + O 2 2SO 3
- U ( прям ) = U ( обрат )
- Принцип Ле - Шателье: внешнее воздействие сместит равновесие в ту сторону, где оно ослабевает.

Влияние на химическое равновесие
- Температура
- Повышение t хим. равн. смещается - Q (эндо)
- Понижение t хим. равн. смещается + Q (экзо)
- Задание: В какую сторону сместится равновесие при повышение температуры в химических процессах
N 2 + O 2 2NO – Q
H 2 + O 2 2H 2 O +Q
![Концентрация повышение [ исход. вещ-в ] хим. равн. смещ продуктам реакции понижение [ исход. вещ-в ] хим. равн. смещ исходным веществам Задание: В какую сторону сместится равновесие при повышение концентрации исходных веществ, в химических процессах 2HgO 2Hg + O 2 N 2 + 3H 2 2NH 3](https://fsd.videouroki.net/html/2013/11/10/98668189/img19.jpg)
повышение [ исход. вещ-в ] хим. равн. смещ продуктам реакции
понижение [ исход. вещ-в ] хим. равн. смещ исходным веществам
Задание: В какую сторону сместится равновесие при повышение концентрации исходных веществ, в химических процессах
2HgO 2Hg + O 2
N 2 + 3H 2 2NH 3

- Давление
- Повышение P хим. равн. смещ уменьшению объёму
- Понижение P хим. равн. смещ увеличению объёму
Задание: В какую сторону сместится равновесие при повышение давления в химических процессах
2HgO 2Hg + O 2
2H 2 + O 2 2H 2 O



 Получите свидетельство
Получите свидетельство Вход
Вход


















![Концентрация реагирующих веществ Скорость химической реакции прямо пропорционально произведению концентрации реагирующих веществ (закон действующих масс). nA + mB pC U = k [A] n [B] m Задание: Как изменится скорость реакции, если концентрацию каждого из исходных веществ увеличить в 2 раза? 2H 2( г ) + O 2( г ) 2H 2 O ( г )](https://fsd.videouroki.net/html/2013/11/10/98668189/img15.jpg)



![Концентрация повышение [ исход. вещ-в ] хим. равн. смещ продуктам реакции понижение [ исход. вещ-в ] хим. равн. смещ исходным веществам Задание: В какую сторону сместится равновесие при повышение концентрации исходных веществ, в химических процессах 2HgO 2Hg + O 2 N 2 + 3H 2 2NH 3](https://fsd.videouroki.net/html/2013/11/10/98668189/img19.jpg)











 Химические реакции. Типы химических реакций (0.72 MB)
Химические реакции. Типы химических реакций (0.72 MB)
 1
1 1505
1505 88
88 Нравится
0
Нравится
0



