
Карбоновые кислоты в природе. Химические свойства, применение

Содержание урока
- Определение кислот
- Классификация
- Номенклатура
- Изомерия
- Физические свойства
- Химические свойства
Выводы

- Какую кислоту используют для консервирования и маринования?
Уксусную кислоту
2. Какую кислоту используют для приготовления компотов и напитков?
Яблочную кислоту
3. Какую кислоту содержат молочно-кислые продукты?
Молочную кислоту

5. Какая кислота необходима для повышения набухаемости белков при приготовлении слоёного теста?
Лимонная кислота
6. Почему болят мышцы ног после продолжительного бега?
В мышцах образуется молочная кислота

7. Что за кислота ежедневно образуется в организме человека в количестве 400 г? Она может содержаться в моче, поте, крови.
Уксусная кислота
8. Какая кислота содержится в янтаре?
Янтарная кислота
9. Какие кислоты содержатся в табачном дыме?
Муравьиная и уксусная кислоты
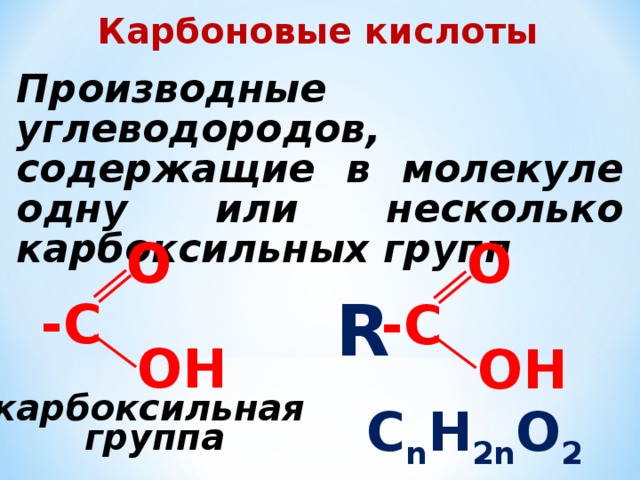
Карбоновые кислоты
Производные углеводородов, содержащие в молекуле одну или несколько карбоксильных групп
О
О
О
R
-С
-С
ОН
ОН
C n H 2n O 2
карбоксильная
группа
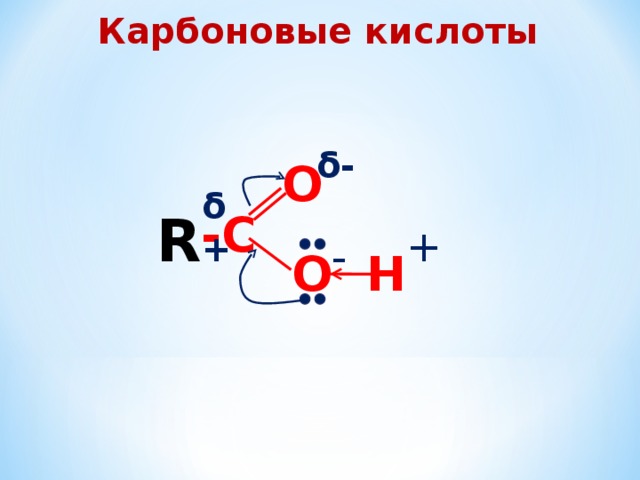
Карбоновые кислоты
δ-
О
δ+
R
-С
+
-
Н
О

Классификация карбоновых кислот
по числу карбоксильных групп
СООН
СН 3
одноосновная,
уксусная
СООН
двухосновная,
щавелевая
СООН
НООС
СООН
СН 2
СООН
СН
многоосновная,
лимонная
СООН
СН 2
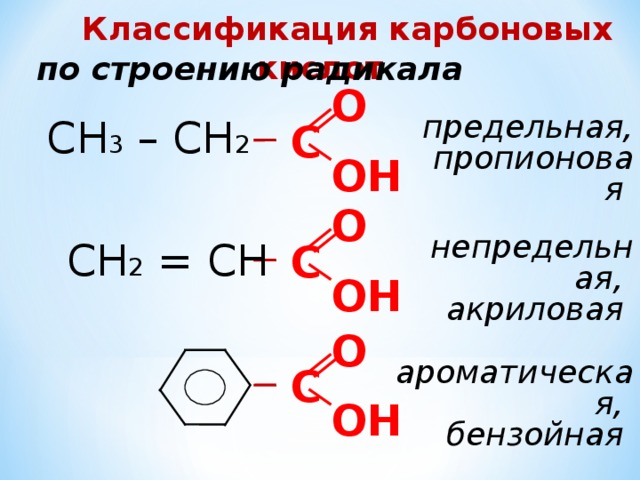
Классификация карбоновых кислот
по строению радикала
О
СН 3 – СН 2
предельная,
пропионовая
С
ОН
О
СН 2 = СН
непредельная,
акриловая
С
ОН
О
ароматическая,
бензойная
С
ОН
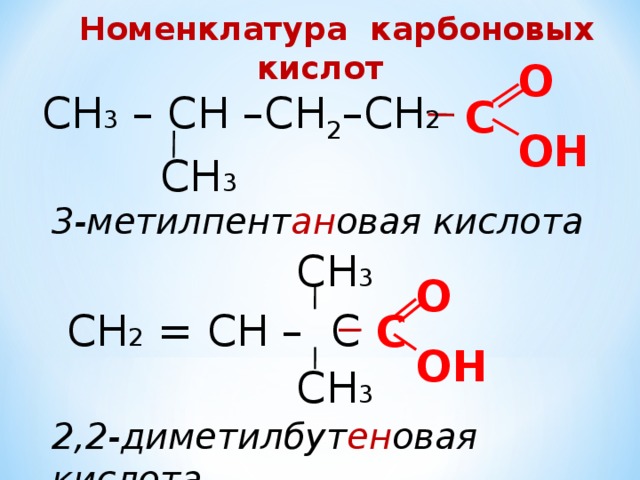
Номенклатура карбоновых кислот
О
СН 3 – СН –СН 2 –СН 2
С
ОН
СН 3
3-метилпент ан овая кислота
СН 3
О
СН 2 = СН – С
С
ОН
СН 3
2,2-диметилбут ен овая кислота

Номенклатура карбоновых кислот
НСООН
Метановая
СН 3 СООН
Муравьиная
Этановая
СН 3 СН 2 СООН
СН 3 СН 2 СН 2 СООН
Пропановая
Уксусная
Пропионовая
Бутановая
СН 3 (СН 2 ) 3 СООН
Масляная
Пентановая
СН 3 (СН 2 ) 4 СООН
СН 3 (СН 2 ) 5 СООН
Валериановая
Гексановая
Капроновая
Гептановая
СН 3 (СН 2 ) 6 СООН
Энантовая
Октановая
СН 3 (СН 2 ) 7 СООН
Каприловая
Нонановая
СН 3 (СН 2 ) 8 СООН
Пеларгоновая
Декановая
Каприновая
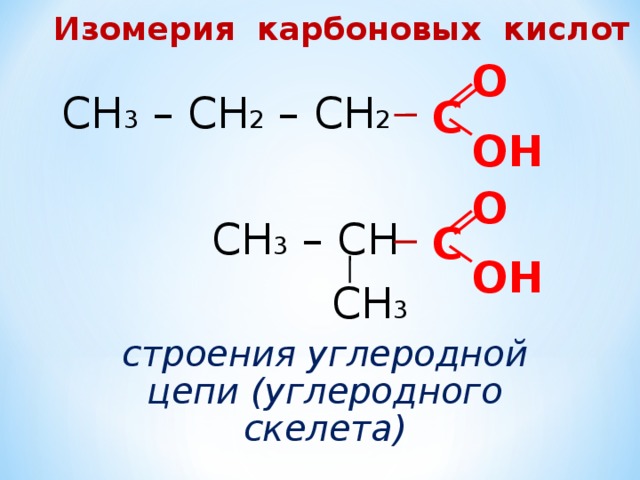
Изомерия карбоновых кислот
О
СН 3 – СН 2 – СН 2
С
ОН
О
СН 3 – СН
С
ОН
СН 3
строения углеродной цепи (углеродного скелета)
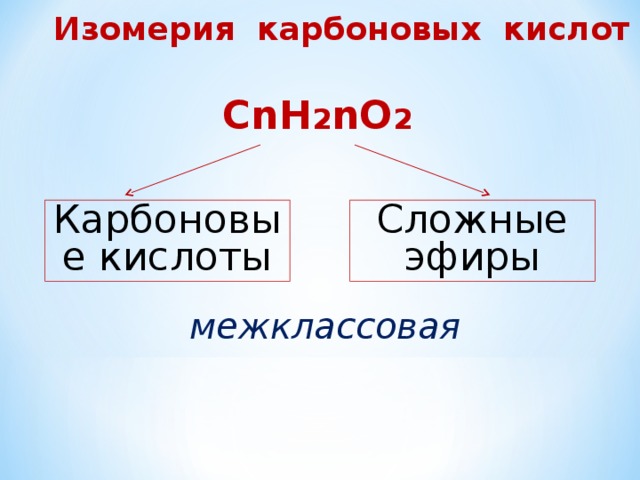
Изомерия карбоновых кислот
СnH 2 nO 2
Карбоновые кислоты
Сложные эфиры
межклассовая

Физические свойства
???
Среди кислот отсутствуют газо-образные вещества. Почему?
О
НО
R
R
С
С
ОН
О
димеры
Образованием водородных связей можно объяснить и растворимость карбоновых кислот в воде.

Химические свойства кислот
???
- Диссоциация в водных растворах (среда кислая, индикаторы меняют окраску)
- Взаимодействие с металлами, сто-ящими в ряду напряжений до Н
- Реагируют с основными и амфотер-ными оксидами с образованием соли и воды
- Вступают в реакцию нейтрализации с основаниями (щелочами и нерастворимыми) и амфотерными гидроксидами
- Взаимодействуют с солями более слабых и летучих кислот
Вспомните химические свойства неорганических кислот.

Химические свойства кислот
1. Диссоциация в водных растворах
СН 3 -СООН СН 3 СОО - +
Н +
ацетат анион
Среда кислая.
Универсальный индикатор розовый.

Химические свойства кислот
2. Реакция замещения с металлами, стоящими в ряду напряжения до Н
О
О
CH 3
CH 3
С
С
О
ОН
+ Mg
+ Н 2
Mg
О
ОН
CH 3
CH 3
С
С
О
О
ацетат магния
Выделяется газ водород.

Химические свойства кислот
3. Взаимодействиевие с основными и амфотерными оксидами с образованием соли и воды
H
CH 3 COO
CH 3 COO
+ O-Cu
Cu
+ Н 2 О
CH 3 COO
CH 3 COO
H
Ацетат меди(II)

Химические свойства кислот
4. Реакция нейтрализации с основа-ниями и амфотерными гидроксидами с образованием соли и воды
+ HO-Na
CH 3 COO
H
CH 3 COO
Na
+ Н 2 О
ацетат натрия
!
Реакцию нейтрализации со щелочами проводят на фоне индикатора (фенолфталеина)

Химические свойства кислот
5. Взаимодействие с солями более слабых или летучих кислот
О
О
CH 3
С
С
CH 3
ОН
О
Ca +
+ CO 3 -Ca
О
ОН
С
CH 3
CH 3
С
О
О
+ Н 2 О + СО 2
+ Н 2 СО 3

Химические свойства кислот
- Реакция этерификации – образование сложных эфиров при взаимодействии карбоновых кислот со спиртами
H 2 SO 4 , t ˚
О
О
С
R 1
С
R 1
+ H O-R 2
+ Н 2 О
О R 2
ОН
кислота
спирт
сложный эфир
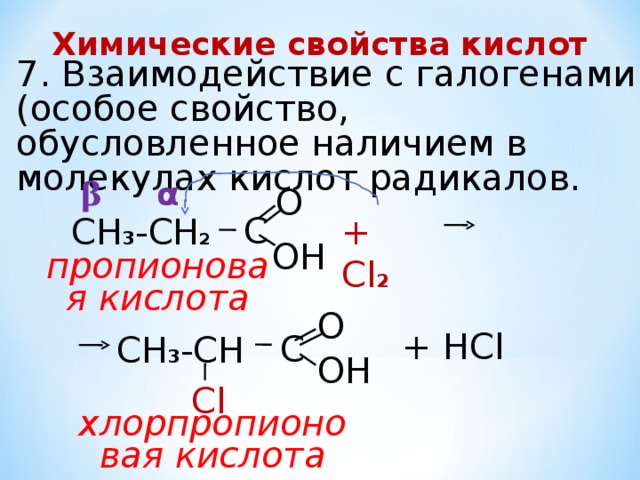
Химические свойства кислот
7. Взаимодействие с галогенами (особое свойство, обусловленное наличием в молекулах кислот радикалов.
α
β
О
С
CH 3 -CH 2
+ Cl 2
ОН
пропионовая кислота
О
+ НСl
С
CH 3 -CH
ОН
Сl
хлорпропионовая кислота

О
Уксусная кислота
СН 3
С
- Впервые получили при скисании вина
ОН
- Безводная уксусная кислота называется ледяной, т.к. при температуре ниже 16,8 ˚ твердеет и становится похожей на лёд
- Это первая кислота, полученная
и использованная человеком
- Латинское название – Acetum acidum, отсюданазвание солей - ацетаты
- «Родилась» более 4 тыс. лет назад в Древнем Египте
- Название «уксусная кислота» – тривиальное, исторически сложившееся; по современной номенклатуре – этановая кислота
- Уксусная эссенция – 70%-ный раствор кислоты; столовый уксус – 6% или 9%-ный раствор кислоты
- В 17 – 18 веках в России её называли «кислая влажность»

Выводы:
1. Карбоновыми кислотами называются органические вещества, молекулы которых содержат одну или несколько карбоксильных групп, соединённых с углеводородным радикалом.
2. Для карбоновых кислот характерна изомерия углеродного скелета и межклассовая.
3. Молекулы карбоновых кислот образуют димеры.

Выводы:
- Общие свойства, характерные для карбоновых кислот, обусловлены наличием в молекуле гидроксильной группы, которая содержит резко полярную связь между атомами водорода и кислорода. Для карбоновых кислот характерны свойства как общие с неорганическими кислотами, так и специфические, присущие только органическим кислотам .

Тестирование
- Какие из названных кислот являются органическими :
- муравьиная
- серная
- лимонная
- азотная

Тестирование
- Почему болезненны укусы муравьёв?
- обжигают муравьиной кислотой
- выделяют яд
- разъедают муравьиной щёлочью
- вонзают острые зубчики

Тестирование
- Как называют соли уксусной кислоты?
- ацетаты
- бустилаты
- пропилаты
- постулаты

Тестирование
- Какого названия кислоты НЕ существует?
- лимонная
- щавелевая
- винная
- виноградная

Тестирование
- Какие кислоты являются витаминами?
- никотиновая
- аскорбиновая
- ацетилсалициловая
- янтарная

Д.З.
Материалы лекции;
§12 Упр.1,3,5,6


 Получите свидетельство
Получите свидетельство Вход
Вход










































 Карбоновые кислоты (6.32 MB)
Карбоновые кислоты (6.32 MB)
 0
0 1531
1531 35
35 Нравится
0
Нравится
0





