Цели.
Изучить строение атома кальция, его физические, химические свойства, получение и применение.
Задачи.
Образовательная:
на основании положения в периодической системе химических элементов рассмотреть строение атома кальция. Изучить его нахождение в природе, физические и химические свойства, получение и применение.
Развивающая:
развивать практические умения выполнять лабораторные опыты и составлять уравнения химических реакций, а также умения формулировать выводы на основе лабораторных опытов.
Воспитательная:
воспитывать интерес к познанию нового, к изучению богатств родного государства, а также воспитывать культуру общения учащихся в группах.
Тип урока: урок изучения нового материала.
Вид урока:
урок – мозговая атака.
Оборудование:
металлический кальций, вода, фенолфталеин, химический стакан, воронка, мел, мрамор, известняк, ракушечник, жемчуг, гипс, фосфориты, апатиты, коллекция «Минералы и горные породы», компьютер, интерактивная доска.
Ход урока
Оргмомент. Целевая установка.
На основании положения в периодической системе химических элементов рассмотреть строение атома кальция. Изучить его нахождение в природе, физические и химические свойства, получение и применение.
Этап побуждения.
На интерактивной доске демонстрируется «Периодическая система химических элементов Д.И. Менделеева. В качестве химической разминки учащимся предлагаются вопросы.
1. Где в периодической системе химических элементов находится кальций?
2. К семейству каких элементов относится кальций?
3. Что можно сказать о его химической активности и его нахождении в природе?
Учащиеся работают по карточке, предложенной на интерактивной доске.
Этап реализации.
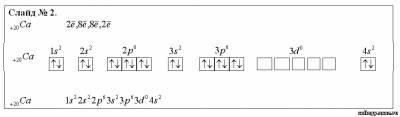
Строение атома кальция
Схема строения атома кальция, его электронная и графическая формулы демонстрируются на интерактивной доске.
Нахождение кальция в природе
Кальций занимает 5 место по содержанию в земной коре. Соединения кальция можно встретить в природе повсеместно. Одно из самых распространенных соединений – карбонат кальция - образует разные минералы: мел, мрамор, известняк, ракушечник, кальцит, жемчуг, кораллы, перламутр и другие минералы.
Демонстрируется коллекция «Минералы и горные породы».
С древних времен эти минералы использовались человеком для создания произведений искусства.
На интерактивной доске демонстрируется рисунок с изображением древнегреческой мраморной скульптуры (Слайд 3).
В природе также встречаются и другие соединения кальция: гипс; фосфориты и апатиты; флюрит.
В организме человека содержится до 1 кг кальция – в костях, зубной эмали, крови.
Распространение соединений кальция на территории Казахстана.
Самостоятельная работа учащихся с учебником. Письменное задание.
Крупнейшее местонахождение фосфоритов находятся в горах Карату и в Актюбинской области (Шилисай), ценный розовый ракушечник добывают на Мангышлаке, гипс добывают в Жамбылской области, цементные глины добывают около Шымкента и Семея, значительные залежи известняка, огнеупорных глин имеются в различных областях страны.
Физические свойства кальция
Самостоятельная работа учащихся с учебником. Устное задание.
Кальций – серебристо-белый легкий металл. Его плотность равна 1,54 г/см3. На воздухе кальций быстро покрывается слоем оксида и других соединений, поэтому его, как и щелочные металлы, хранят под слоем керосина. Кальций – довольно твердый металл; его температура плавления равна 8510С.
Химические свойства кальция
Учащимся предлагается спрогнозировать химические свойства кальция на основании его положения в периодической системе химических элементов.
Как представитель щелочноземельных металлов кальций проявляет высокую химическую активность. По химической активности он немного уступает щелочным металлам. Кальций – активный восстановитель, легко отдает свои валентные электроны, превращаясь при этом в положительный ион.
Степень окисления кальция в соединениях всегда постоянная и равна +2. Он Образует соединения основного характера. Кальций взаимодействует с простыми веществами – с различными неметаллами.
Демонстрация слайда на интерактивной доске.
Как активный металл кальций может реагировать со сложными веществами. Он бурно реагирует с водой, вытесняя из неё водород. При этом образуется мутный раствор гидроксида кальция, который распознается по малиновой окраске фенолфталеина.
Демонстрация лабораторного опыта взаимодействия кальция с водой.
Демонстрация слайда на интерактивной доске.
Кальций и его соединения окрашивают пламя в кирпично-красный цвет.
Получение кальция
Кальций получают в промышленности электролизом расплава его солей, например, электролизом расплава хлорида кальция.
Демонстрация слайда на интерактивной доске с уравнением реакции электролиза расплава хлорида кальция (Слайд 6).
Применение кальция
Самостоятельная работа учащихся с учебником. Письменное задание.
Как восстановитель кальций используется в промышленности для получения некоторых ценных и редких металлов (титан, ванадий, бериллий, урон и другие).
Этап рефлексии
Для закрепления нового материла учащимся предлагается выполнить упражнение по трем уровням сложности. Упражнение выполняется каждым учеником индивидуального.
Разноуровневые задания демонстрируются на интерактивной доске.
Подведение итогов урока. Выставление оценок.
Домашнее задание. § 35. Упражнение № 6 на странице 115.
Найти дополнительный материал и составить в тетради конспект по следующим вопросам:
1. Биологическая роль кальция.
2. Потребность человека в кальции.
3. Источники поступления кальция в организм человека.

 Получите свидетельство
Получите свидетельство Вход
Вход
















 Кальций. Положение в периодической системе. Строение атома. Физические и химические свойства кальция (54.77 КB)
Кальций. Положение в периодической системе. Строение атома. Физические и химические свойства кальция (54.77 КB)
 0
0 2489
2489 188
188 Нравится
0
Нравится
0


