Электролиз в растворах
| Баженов Георгий - обучающийся 9 «А» класса Руководитель: Екимова Л.П. - учитель химии, биологии Сурьянинова Т.В.- учитель физики МБОУ «Гимназия № 8» ЭМР |
Электролиз расплавов и растворов электролитов имеет очень широкое применение на практике. Почти в каждом заводе есть гальванический цех. В нашей жизни мы каждый день сталкиваемся с изделиями, полученными на основе этого процесса.
Кроме этого, недавно, на уроках химии мы изучали процесс получения металлов, в котором, конечно же, не обошлось без электролиза. К сожалению, этот момент был изучен недостаточно подробно, а нас он очень заинтересовал, в связи с этим подробно ознакомились с теоретической частью данного процесса, а также раскрыли его на практике.
В нем представлено несколько опытов по изучению этих свойств. Эта тема на данный момент очень актуальна, т.к. электролиз имеет широкое распространение в технике, с помощью него получают чистые металлы, изготавливают множество медикаментов, также электролиз используется для создания клише для печатных денежных знаков. В этой работе я рассмотрел поведение электрического тока в различных условиях.
Таким образом, тема очень актуальна в наше время, дает возможность её глубокого раскрытия, а также дальнейшего изучения и разработки.
Цель исследования
выяснение природы электрического тока в жидких проводниках и рассмотрение его применения на практике.
Поставленная цель потребовала решения ряда взаимосвязанных задач:
изучение механизма электрического тока в жидких проводниках;
рассмотрение открытия явления электролиза;
ознакомление с краткими биографиями ученых, участвующих в исследовании этого процесса;
изучение применения электролиза (тяжёлая вода, получение металлов, гальваническое производство);
проведение экспериментов с использованием процесса электролиза.
Правила работы с электрическим током.
В лаборатории необходимо соблюдать тишину и порядок, бережно обращаться с электрооборудованием, соблюдать чистоту на рабочем месте, соблюдать правила техники безопасности.
Включить электроустановку после сборки и проверки ее схемы допускается только в присутствии преподавателя или лаборанта. Если по условиям работы требуется изменить схему соединений, то это нужно сделать при снятом напряжении ( после отключения ); перед включением электроустановки вновь предъявить ее для проверки преподавателю или лаборанту.
Одежда учащихся при выполнении работ, связанных с использованием электрических машин, должна быть прилегающей во избежании захвата ее вращающимися частями, должен быть надет головной убор.
Во время работы электроустановки или в то время, когда она находится под напряжением, запрещается касаться токоведущих и вращающихся частей во избежание электрической или механической травмы.
При использовании переносных контрольно- измерительных приборов необходимо следить за исправным состоянием изоляции их проводов и наконенчников.
В случае поражения человека электрическим током немедленно отключить электроустановку, вызвать преподавателя или лаборанта, а при необходимости врача. До прибытия врача немедленно оказать пострадавшему медицинскую помощь согласно инструкции (искусственное дыхание, непрямой массаж сердца и др.).
Электролиз раствора сульфата меди.
Оборудование:U-образная трубка с графитовыми электродами, 10 % -раствор хлорида меди.
Налить в U-образную трубку раствор хлорида меди так, чтобы концы электродов были погружены в раствор на 4-5 см. Электроды прибора включаются в цепь постоянного тока (от выпрямителя).

| Катод (-) | Анод (+) |
| Cu2++2e→Cu0 | 4OH--4e→2H2O+O2↑ |
| H+ | SO42- |
Полное уравнение : Cu SO4+ Н2О= Cu0 + O2↑+ H2
Электролиз раствора FeSO4 с активным железным анодом.
Fe – активный анод, в качестве электролита – водный раствор FeSO4
FeSO4= Fe2++ SO4 2-
При электролизе раствора FeSO4 с цинковыми электродами концентрация FeSO4 в растворе остается постоянной, процесс сводится к переносу материала анода на катод (процесс электрохимического рафинирования):
на катоде: Fe2+ +2ē → Fe
на аноде: Fe − 2ē → Fe2+
| Напряжение, В | Время, сек | Сила Тока, А | m1,г (катод) | m2, г (анод) | d1, см | d2, см |
| 2 | 600 | 0.3 | 4,1 | 4,05 | 0,3 | 0,3 |
| 4 | 600 | 0,5 | 4,18 | 3,95 | 0,35 | 0,25 |
| 6 | 600 | 0,8 | 4,30 | 3,90 | 0,35 | 0,25 |
| 8 | 600 | 1,0 | 4,45 | 3,80 | 0,4 | 0,2 |
| 10 | 600 | 1,2 | 4,61 | 3,75 | 0,4 | 0,2 |
Раствор сульфата железа с массовой долей– 10 %.
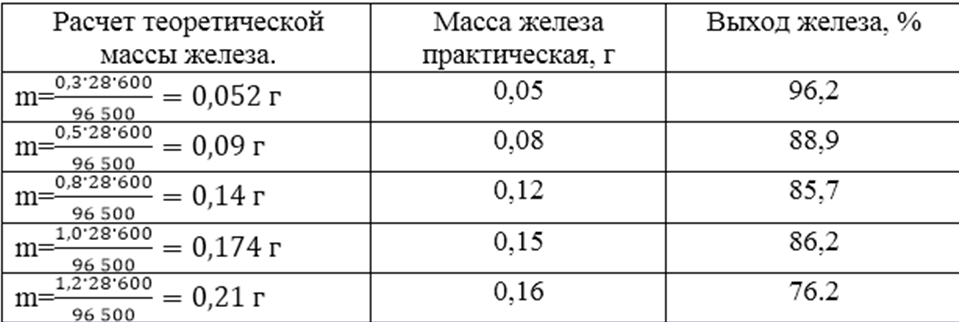
Определим выход электролиза. Рассчитываем массу железа, выделившегося на катоде по уравнению М. Фарадея.
mв=(Э*I*t)/96 500
Гальваностегия(от греч. покрывать) – это электроосаждение на поверхность металла другого металла, который прочно связывается с покрываемым металлом (или специально обработанным неметаллическим предметом), служащим катодом электролизера. Покрытие изделий цинком, кадмием, никелем, хромом, золотом и другими металлами придает изделиям не только красивый внешний вид, но и предохраняет металл от коррозионного разрушения.
Гальванопластика – получение путем электролиза точных, легко отделяемых металлических копий (матриц) с различных как неметаллических, так и металлических рельефных предметов. С помощью гальванопластики изготовляют бюсты, статуи и т. д.
Гальванотехника – область прикладной электрохимии, занимающаяся процессами нанесения металлических покрытий на поверхность как металлических, так и неметаллических изделий при прохождении постоянного электрического тока через растворы их солей. Особо необходимо отметить значение гальванических покрытий в высоких технологиях (HiTec) таких, как микроструктурная техника, электроника и другие. Гальванотехника подразделяется на гальваностегию и гальванопластику.
ЗАКЛЮЧЕНИЕ
Электролиз - основной метод промышленного производства алюминия, хлора и едкого натра, важнейший способ получения фтора, щелочных и щелочноземельных металлов, эффективный метод рафинирования металлов.
Преимущества электролиза перед химическим методами получения целевых продуктов заключаются в возможности сравнительно просто управлять скоростью и селективной направленностью реакций. Условия электролиза легко контролировать, благодаря чему можно осуществлять процессы как в самых "мягких", так и в наиболее "жёстких" условиях окисления или восстановления, получать сильнейшие окислители и восстановители, используемые в науке и технике.
Исследование процессов электролиза не потеряло своей актуальности и в настоящее время, т.к. не только обогащает теоретические положения об этом достаточно сложно физико-химическом явлении, но и позволяет определить перспективные направления практического использования этого процесса с целью получения целевых продуктов с заданными свойствами и качествами.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
Браун Т., .Лемей Г.Ю. Химия в центре наук -2, - Мир Москва.1997 г
Волович П.М., Бровко М.И. Готовимся к экзамену по химии - Айрис-пресс; 2006 г
Егоров А.С. Репетитор по химии - Издательство: Феникс 2002 г.
Третьяков К.А. Методические указания к лабораторным работам по химии - Свердл. инж.-пед.ин-т. Екатеринбург, 1995 г
Мухленов И.П., Авербух А.Я. и др. Важнейшие химические производства - «Высшая школа», г. Москва. 1990 г
4

 Получите свидетельство
Получите свидетельство Вход
Вход











 Электролиз в растворах (477.34 KB)
Электролиз в растворах (477.34 KB)
 0
0 559
559 5
5 Нравится
0
Нравится
0




