электролитическая диссоциация
Элементы содержания: электролитическая диссоциация кислот, щелочей и солей в водных растворах; ионы, анионы и катионы.
Требования: знать понятия «электролитическая диссоциация», «ион»; уметь составлять уравнения электролитической диссоциации кислот, щелочей, солей.
Оборудование: таблица по теме: «Теория электролитической диссоциации», динамические магнитные модели «Диссоциация NaCl», растворы уксусной и соляной кислоты.
Ход урока
I. Фронтальный опрос.
– Что такое растворение; раствор?
– От чего зависит растворимость?
– Как доказать, что растворение – физико-химический процесс?
– Какие растворы называют насыщенными, ненасыщенными и пересыщенными?
– Какие вещества называют хорошо растворимыми, малорастворимыми, практически нерастворимыми? По таблице растворимости приведите примеры таких веществ.
– Что такое электролиты?
– Какие классы веществ к ним относятся?
– Что такое неэлектролиты? Приведите примеры неэлектролитов.
II. Объяснение нового материала.
– Рассмотрим, как в растворах электролитов появляются ионы.
Например, возьмем NaCl. (Учитель показывает плакат или динамичную модель, в учебнике с. 195, рис. 127).
Полярные молекулы воды – диполи, своими отрицательными полюсами притягиваются к положительным ионам кристаллической решетки NaCl – катионам, а положительными – к анионам. Окруженные диполями воды ионы под действием теплового движения отрываются от кристалла и переходят в раствор.
Процесс распада кристалла электролита на ионы называется электролитической диссоциацией.
Этот процесс в 1887 г. открыл известный ученый Сванте Арретиус.
Вещества ионного строения (соли, щелочи) диссоциируют на ионы в одну стадию. Это записывают с помощью уравнений (используем таблицу растворимости).
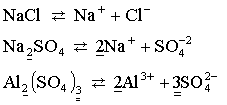
Вещества с ковалентной полярной связью (кислоты) под действием диполей воды ионизируются.
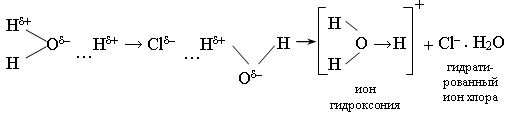
Вещества с ковалентной связью диссоциируют ступенчато:

Диссоциация – обратимый процесс.
Сравним электропроводность раствора соляной и уксусной кислот. Соляная кислота лучше проводит ток. Почему? Она в большей степени распадается на ионы. Степень распада на ионы – степень диссоциации определяет силу электролита.
Сильные электролиты диссоциируют почти полностью (к ним относятся щелочи, растворимые соли, кислоты: HCl, HBr, HI, HNO3, H2SO4).
Слабые электролиты диссоциируют менее чем на 10 %, к ним относится аммиак (NH4OH), слабые кислоты: H2CO3, H2S, HNO2.
Степень диссоциации (α) – это отношение числа продиссоциировавших частиц (nд) к общему числу растворенных частиц (np).
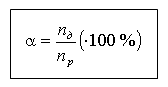
Положения
теории электролитической диссоциации
1. При растворении в воде электролиты диссоциируют на положительные ионы (катионы) и отрицательные ионы (анионы).
2. Под действием электрического тока катионы движутся к катоду (отрицательному полюсу), анионы – к аноду (положительному полюсу).
3. Диссоциация – обратимый процесс.
4. Не все электролиты диссоциируют в равной мере.
5. Химические свойства электролитов определяются свойствами тех ионов, которые они образуют при диссоциации.
Домашнее задание: § 35, 36 (до с. 201), упр. 4, 5.

 Получите свидетельство
Получите свидетельство Вход
Вход











 Электролитическая диссоциация (40.62 KB)
Электролитическая диссоциация (40.62 KB)
 0
0 369
369 3
3 Нравится
0
Нравится
0




