Алкены – это углеводороды, которые содержат в составе молекул одну двойную С = С-связь. Алкены называют непредельными или ненасыщенными углеводородами. Состав этих углеводородов выражается общей формулой CnH2n. Если подставить в формулу сооьветствующие значения относительных атомных масс, то относительная молекулярная масса будет 14n.
Установлено, что молекула этилена имеет плоскостное строение, валентные углы связей равны 120 °. Длина С = С-связи равна 0,134 нм. Такое плоскостное строение двойной связи характерно и для других алкенов.
Название алкенов определяет главная цепь, которая обязательно содержит двойную связь. При этом она может быть и не самой длинной. Нумерацию атомов в главной цепи проводят так, чтобы номер атома С, образующего двойную связь, был наименьшим. Название алканов с выбранной главной цепью суффикс –ан заменяют на –ен. Заместители перечисляются в алфавитном порядке. В конце названия указывается наименьший атом углерода, образовавшего кратную связь.
Назовём следующий алкен.
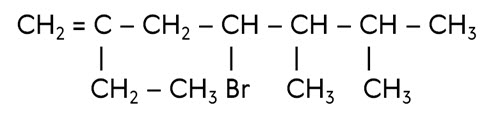
Нумерацию начинаем слева, так как двойная связь ближе к этому краю. В состав молекулы входят заместители: бром, 2 метила и этил. Их необходимо перечислить в алфавитном порядке с указанием атома углерода, от которого они отходят и в конце указать положение двойной связи. Получается название: 4-бром-5,6-диметил-2-этилгептен-1.
Для алкенов характерно несколько видов структурной изомерии: изомерия углеродного скелета и изомерия положения двойной связи. Изомерия положения двойной связи начинается с бутена. Так, для бутена характерна изомерия углеродного скелета. Его изомером в данном случае будет 2-метилпропен. Если рассмотреть изомерию положения двойной связи, то для бутена будет характерно два изомера: бутен-1 и бутен-2.
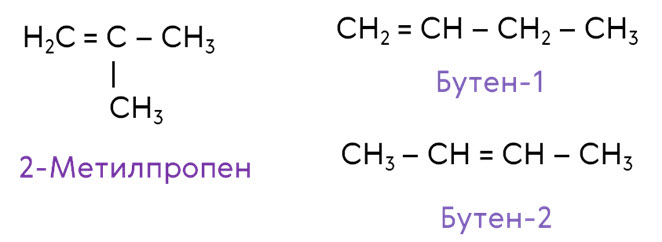
Кроме того, для алкенов характерна ещё и межклассовая изомерия с циклоалканами. Так, межклассовым изомером пропена будет циклопропан, который имеет такую же молекулярную формулу С3Н6.
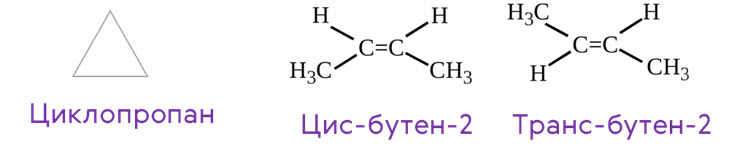 Для
алкенов характерна ещё и пространственная изомерия – стереоизомерия.
Пространственные изомеры имеют только те алкены, которые содержат разные атомы
или группы атомов у каждого атома углерода при двойной связи. Например, бутен-2
имеет пространственные изомеры. Этими пространственными изомерами будут
цис-бутен-2 и транс-бутен-2. В цис-изомере одинаковые заместители находятся по
одну сторону плоскости двойной связи, а в транс-изомере – по разные стороны.
Для
алкенов характерна ещё и пространственная изомерия – стереоизомерия.
Пространственные изомеры имеют только те алкены, которые содержат разные атомы
или группы атомов у каждого атома углерода при двойной связи. Например, бутен-2
имеет пространственные изомеры. Этими пространственными изомерами будут
цис-бутен-2 и транс-бутен-2. В цис-изомере одинаковые заместители находятся по
одну сторону плоскости двойной связи, а в транс-изомере – по разные стороны.
Стереоизомерия невозможна, если хотя бы при одном атоме углерода, образовавшем кратную связь, находится два одинаковых заместителя.
Сравним два алкена. У первого алкена у одного атома углерода при двойной связи разные атомы: Н и Cl, у второго атома углерода тоже разные. У второго же алкена при двойной связи у первого атома углерода два одинаковых атома, у второго – два разных. Потому первый алкен имеет пространственные изомеры, а второй – нет:
HCCl = CHCl
HCH = CH – CH3.
Первые четыре члена гомологического ряда алкенов являются газами. Алкены, содержащие от С5 – С17 – жидкости, алкены, содержащие 18 и более атомов углерода – твёрдые вещества. Температура кипения и плавления алкенов увеличивается с увеличением относительной молекулярной массы. Алкены не растворяются в воде, но растворимы в органических растворителях.
По своим свойствам алкены значительно отличаются от алканов. Например, для них характерны реакции присоединения и окисления. Все реакции присоединения происходят за счёт разрыва π-связи, большинство реакций окисления идут по этому же механизму.
Так, алкены присоединяют при комнатной температуре галогены: хлор, бром, менее эффективно – йод. Так, в реакции этилена с бромной водой образуется 1,2-дибромэтан, при этом этилен обесцвечивает раствор брома в воде. Поэтому данная реакция является качественной на присутствие двойных связей:
H2C = CH2 + Br2 → BrCH2 – CH2Br
1, 2-дибромэтан (растворитель).
Алкены вступают в реакции гидрирования – присоединения водорода. Данные реакции идут при обычной или повышенной температуре под действием катализаторов: платины, палладия, никеля и других. Например, в реакции пропена с водородом образуется пропан:
H2C = CH – CH3 + H2 → H3C – CH2 – CH3.
Алкены вступают в реакции присоединения воды – гидратации. Присоединение воды к алкенам идёт по правилу Марковникова, согласно которому атом водорода при присоединении воды или галогеноводородов присоединяется к наиболее гидрогенизированному атому углерода. Так, в реакции пропена с водой образуется пропанол-2.
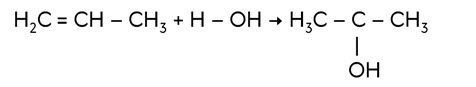
По такому же принципу идёт присоединение и галогеноводородов. Так, в реакции этена с бромоводородом образуется бромэтан.
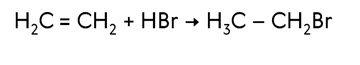
В реакциях окисления разрывается π-связь или С = С -связи. Алкены легко реагируют с окислителя. Если пропустить этилен через разбавленный раствор перманганата калия при низкой температуре, то фиолетовая окраска раствора исчезает. При окислении этилена перманганатом калия образуется этиленгликоль, эта реакция служит качественной реакцией на алкены. Эта реакция называется реакцией Вагнера.
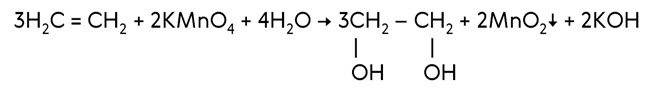
В присутствии солей палладия и меди этилен окисляется до этаналя.
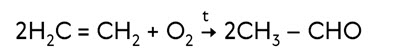
При окислении надкислотами (реакция Прилежаева) этилен образуект эпоксид этилена.
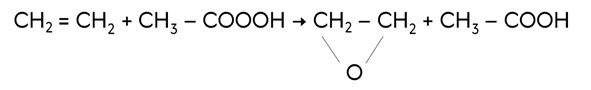
Особым случаем реакции присоединения является реакция полимеризации.
Реакции полимеризации протекают при повышенной температуре, давлении, в присутствии катализаторов.
Например, при полимеризации этилена образуется полиэтилен, при полимеризации винилхлорида – поливинилхлорид, при полимеризации тетрафторэтилена – тефлон, при полимеризации пропена – полипропилен.
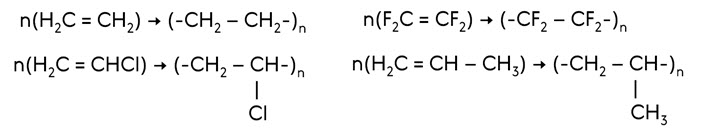
При полном окислении алкенов – горении в избытке кислорода образуется углекислый газ и вода. Этилен, например, горит светящимся жёлтым пламенем:
2CH3 – CH = CH2 + 9O2 → 6CO2↑ + 6H2O.
Из алкенов самым распространённым продуктом, который получают, является этилен. В промышленных масштабах его получают высокотемпературным разложением углеводородов нефти.
Наибольший выход получается при пиролизе этана:
CH3 – CH3 → CH2 = CH2 + H2↑.
В лаборатории алкены можно получить отщеплением галогеноводорода от галогеналканов. В зависимости от структуры исходного галогеналкана получается смесь алкенов. Так, при действии на 2-хлорбутан спиртовым раствором щёлочи при нагревании получается бутен-1 и в качестве основного продута бутен-2:
CH3 – CHCl – CH2 – CH3 + KOH → CH2 = CH – CH2 – CH3 + CH3 – CH = CH – CH3 + KCl + H2O.
Алкены можно получить и при дегидратации спиртов – отщеплении воды при нагревании с концентрированными растворами минеральных кислот. Отщепление воды и галогеналканов идёт по правилу Зайцева: при отщеплении галогеноводородов или воды от галогеналканов или спиртов атом водорода отщепляется от наименее гидрогенизированного атома углерода. Так, при отщеплении воды от бутанола-2 образуются преимущенно бутен-2 и бутен-1.
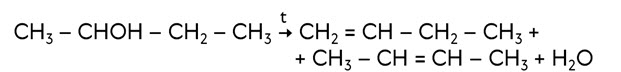
Алкены можно получить и при гидрировании алкинов. Так, при присоединении водорода к пропину образуется прпопен:
CH ≡ C – CH3 + H2 → CH2 = CH – CH3.
Осуществим следующее превращение. Из пропана следует получить пропен, из пропена – 2-бромпропан, из 2-бромпропана получить опять пропен, а из пропена – пропнанол-2. Чтобы из пропана получить пропен следует провести реакцию дегидрирования, для получения 2-бромпропана надо к пропену добавить бромоводород. Чтобы из 2-бромпропана получить пропен следует добавить спиртовой раствор щёлочи. Затем к пропену необходимо добавть воду для получения пропанола-2:
CH3 – CH2 – CH3 → CH2 = CH – CH3 → CH3 – CHBr – CH3 → CH2 = CH – CH3 →
→ CH3 – CHOH – CH3
1) CH3 – CH2 – CH3 → CH2 = CH – CH3 + H2↑
2) CH2 = CH – CH3 + HBr → CH3 – CHBr – CH3
3) CH2 = CH – CH3 + H2O → CH3 – CHOH – CH3
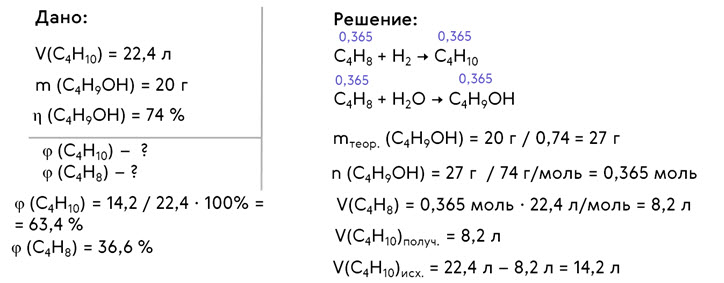
Решим задачу. При полном гидрировании смеси, состоящей из бутана и одного из изомерных бутенов, получено 22,4 л (н. у.) бутана. При гидрировании исходного алкена с выходом 74 % получен бутанол-2 массой 20 г. Установите объёмные доли газов в исходной смеси.

 Получите свидетельство
Получите свидетельство Вход
Вход




 896
896

