
Железо.
Строение. Свойства. Соединения железа

Характеристика элемента
4-период, 4ряд, 8-группа, побочная подгруппа, порядковый номер 26
26 электронов, 26 протонов, относительная атомная масса 56, 30 нейтронов.
4 электронных слоя, 2)8)14)2), электронная конфигурация 1 s2 2s2 2 p6 3s2 3 p6 3 d6 4s2
Степень окисления 0,+2, +3 ,+4 и иногда + 6; является восстановителем

Физические свойства
Железо - сравнительно мягкий ковкий серебристо-серый металл.
Температура плавления – 1535 0С
Температура кипения около 2800 0С
При температуре ниже 770 0С железо обладает ферромагнитными свойствами
(оно легко намагничивается, и из него можно изготовить магнит).
Выше этой температуры ферромагнитные свойства железа исчезают, железо «размагничивается».

Природные соединения железа
FeS
Пирит
FeCO3
Сидерит
Fe
(железный или серный колчедан)
Fe 2 O 3 *3H 2 O Лимонит
Fe3O4
(магнитный железняк
Fe2O3
(красный железняк)

Получение железа
FeO + C = Fe + CO
Fe3O4 + 4CO = 3Fe + 4CO2
Fe2O3 + Al = Fe + Al2O3

Химические свойства
При нагревании
2Fe + 3Cl 2 =2FeCl 3
3Fe +2O 2 = Fe 3 O 4 (FeO Fe 2 O 3 )
Fe +S =FeS
При очень высокой температуре
4Fe + 3C =Fe 4 C 3
4Fe + 3Si =Fe 4 Si 3
3Fe + 2P = Fe 3 P 2
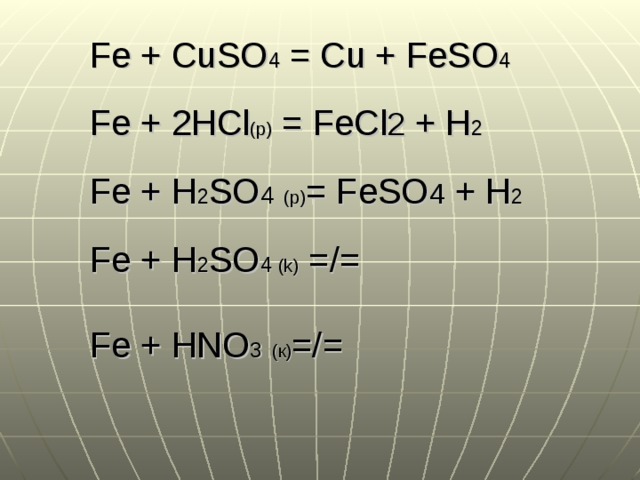
Fe + CuSO 4 = Cu + FeSO 4
Fe + 2HCl (р) = FeCl 2 + H 2
Fe + H 2 SO 4 ( p ) = FeSO 4 + H 2
Fe + H 2 SO 4 (k) =/=
Fe + HNO 3 (к) =/=

При нагревании
2Fe + 6H 2 SO 4 (k) =Fe 2 (SO 4 ) 3 + 3SO 2 + 6H 2 O
Fe+ 6HNO 3 (k ) = Fe(NO 3 ) 3 + 3NO 2 + 3H 2 O

Взаимодействие с раствором азотной кислоты
5 Fe + 12 HNO 3 (p) = 5 Fe(NO 3 ) 2 + N 2 + 6 H 2 O
Fe + 4 HNO 3 (р) = Fe (NO 3 ) 3 + NO + 2 H 2 0
4 Fe + 10 HNO 3 (р) = 4 Fe+ 2 (NO 3 ) 2 + NH 4 NO 3 + 3 H 2 O

Важнейшие источники железа
Содержание железа в
100 г продукта
печень
персики
9 мг
хлеб
грибы
свежие
4 мг
грибы сушёные
2 мг
5 мг
яблоки
35 мг
3 мг
![Качественная реакция на катионы железа K 3 [Fe(CN) 6 ] —красная кровяная соль K 4 [Fe(CN) 6 ] – желтая кровяная соль FeCl 2 + K 3 [Fe(CN) 6 = KFe[Fe(CN) 6 ] турнбуллева синь FeCl 3 + K 4 [Fe(CN) 6 ] = KFe[Fe(CN) 6 ] берлинская лазурь KFe [Fe(CN) 6 ] = KFe [Fe(CN) 6 ] Турнбуллева синь берлинская лазурь FeCI 3 + 3 KCNS = Fe(CNS ) 3 +3KCI кроваво-красный](https://fsd.videouroki.net/html/2017/11/16/v_5a0dc29eeab81/img10.jpg)
Качественная реакция на катионы железа
K 3 [Fe(CN) 6 ] —красная кровяная соль
K 4 [Fe(CN) 6 ] – желтая кровяная соль
FeCl 2 + K 3 [Fe(CN) 6 = KFe[Fe(CN) 6 ]
турнбуллева синь
FeCl 3 + K 4 [Fe(CN) 6 ] = KFe[Fe(CN) 6 ]
берлинская лазурь
KFe [Fe(CN) 6 ] = KFe [Fe(CN) 6 ]
Турнбуллева синь берлинская лазурь
FeCI 3 + 3 KCNS = Fe(CNS ) 3 +3KCI кроваво-красный

 Получите свидетельство
Получите свидетельство Вход
Вход












 Железо. Строение и свойства. Соединения железа. (700 KB)
Железо. Строение и свойства. Соединения железа. (700 KB)
 0
0 848
848 22
22 Нравится
0
Нравится
0


