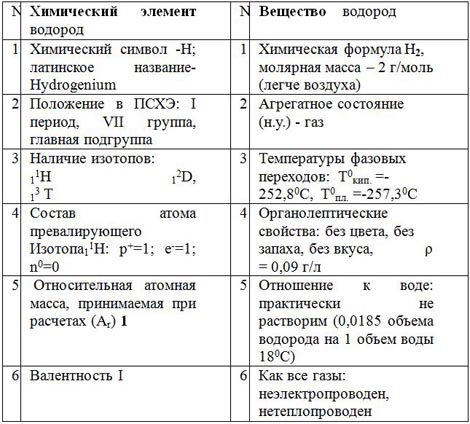
Материал (конспект) удобен при прохождении данной темы.
Вещество водород получают в лаборатории путем взаимодействия металлов с некоторыми кислотами, например:
Zn + 2HCl → Н2↑+ ZnCl2 или щелочных (активных) металлов с водой:
2Na + 2H2O → 2NaOH + H2↑
В промышленности водород получают либо электролитическим разложением воды (под воздействием постоянного тока):
Эл.ток
2Н2О → 2Н2↑+О2↑
либо из природного газа (термическое разложение углеводородов)
СН4 → С + 2Н2↑
Химические свойства водорода.
Молекулы водорода очень прочны: для разрушения 1 моль молекул водорода необходимо затратить 432 кДж энергии. Поэтому большинство реакций с водородом происходят при повышенной температуре или при ином воздействии (облучение). При обычных температурах он вступает в реакцию только с очень активными металлами или фтором.

 Получите свидетельство
Получите свидетельство Вход
Вход












 Водород. Физические и химические свойства (39 КB)
Водород. Физические и химические свойства (39 КB)
 0
0 777
777 123
123 Нравится
0
Нравится
0


