
Метали

Уперше розходження металів і неметалів визначив М. В. Ломоносов. “Метали - тіла тверді, ковкі, блискучі”.

Будова атома (елементи І групи головної підгрупи)
Li 1s 2 2s 1
Na 1s 2 2s 2 2p 6 3s 1
K 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1
Збільшується радіус атома

Будова атома (елементи ІІІ- го періоду)
Na 1s 2 2s 2 2p 6 3s 1
Mg 1s 2 2s 2 2p 6 3s 2
Al 1s 2 2s 2 2p 6 3s 2 3p 1
Збільшується кількість електронів на зовнішньому рівні
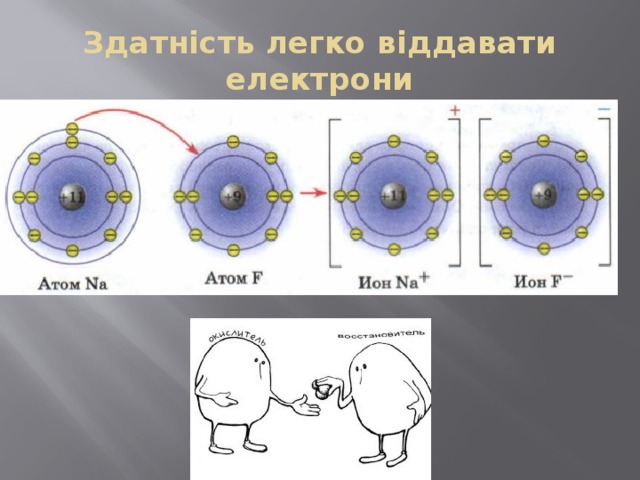
Здатність легко віддавати електрони

Метали - відновники
Me 0 – n e → Me +n

Найактивніший відновник

Элемент № 87 – Франций . Ещё в 1870 году Д.И. Менделеев предполагал возможность существования элемента № 87 и называл его экацезием . Все его попытки обнаружить экацезий в природе закончились неудачами.
В 1939 году французской исследовательницей Маргаритой Пере был официально открыт этот элемент - самый активный металл. В честь своей родины М. Пере назвала открытый элемент францием .
Франций самый тяжёлый и самый активный металл.
Этот элемент имеет период полураспада ядра
22 минуты.
В природе присутствует, но в ничтожных количествах (в поверхностном слое Земли толщиной 1,6 км содержится около 24,5 г) . Вот почему найти этот элемент в природе намного сложнее, чем иголку в стоге сена.
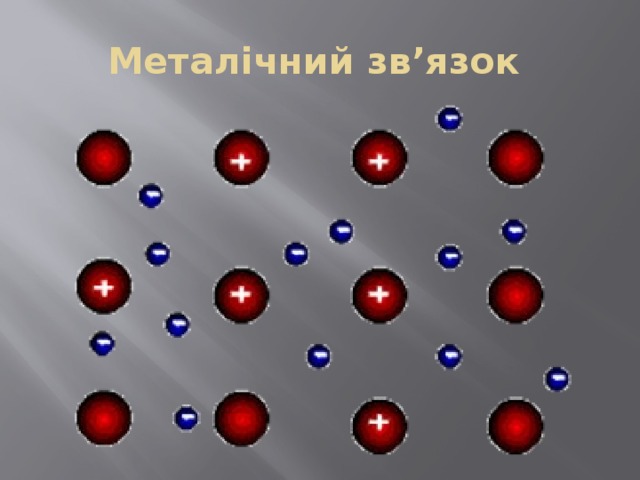
Металічний зв’язок

Фізичні властивості металів

Металічний блиск
Для всіх металів характерний металічний блиск, звичайно сірий колір і непрозорість, що пов’язано з наявністю вільних електронів.
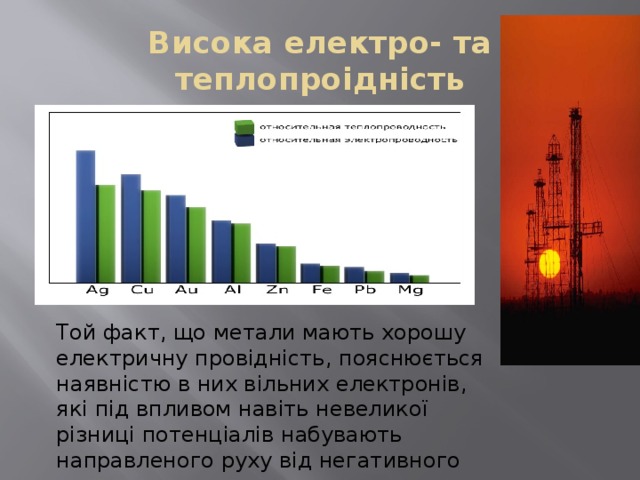
Висока електро- та теплопроідність
Той факт, що метали мають хорошу електричну провідність, пояснюється наявністю в них вільних електронів, які під впливом навіть невеликої різниці потенціалів набувають направленого руху від негативного полюса до позитивного.

Ковкість

Пластичність
Для металів характерна висока пластичність. Вона зменшується в ряду Au,Ag, Сu, Sn, Pb, Zn, Fe. Золото, наприклад, можна прокатувати в листи товщиною не більш як 0,003 мм, які використовують для позолоти різних предметів .

Густина
Різна густина металів. Вона тим менша, чим менша атомна маса елемента-металу і чим більший радіус його атома. Найлегший з металів — літій (густина 0,53 г/см 3 ), найважчий — осмій (густина 22,6 г/см 3 ). Як уже зазначалося, метали з густиною менш як 5 г/см називаються легкими, решта — важкими.

Задача
Розрахуйте масу літію та осмію , які займають об'єм 500 см 3
Li Оs
- ????
- ????

Температура плавлення
Найбільш легкоплавкий метал — ртуть , її температура плавлення
— 38,9°С , цезій і галій відповідно при 29,0 і 29,8°С . Вольфрам — найбільш тугоплавкий метал- З390°С . Він застосовується для виготовлення ниток електроламп. Метали, які плавляться при температурі понад 1000°С, називають тугоплавкими , при нижчій — легкоплавкими .


Твердість
Найтвердіший метал — хром (ріже скло), найм’якіші — калій, рубідій та цезій. Вони легко ріжуться ножем.


Зд атність до утворення сплавів


Некоторым металлическим сплавам, например нитинолу (55% никеля и 45% титана) , присущ эффект памяти формы. Он заключается в том, что деформированное изделие из такого материала при нагреве до определённой температуры возвращается к своей первоначальной форме. Это связано с тем, что данные сплавы имеют особую внутреннюю структуру под названием мартенсит, обладающую свойством термоупругости. В деформированных частях структуры возникают внутренние напряжения, которые стремятся вернуть структуру в исходное состояние. Материалы с памятью формы нашли широкое применение в производстве — например, для соединительных втулок, которые при очень низкой температуре сжимаются, а при комнатной — распрямляются, формируя соединение гораздо надёжнее сварки.

Интересные факты о металлах
Платина в переводе с испанского буквально означает «серебришко». Объясняется такое пренебрежительное название, данное этому металлу конкистадорами, исключительной тугоплавкостью платины, которая не поддавалась переплавке , долгое время не находила применения и ценилась вдвое ниже, чем серебро. Сейчас на мировых биржах платина дороже серебра примерно в 100 раз .
Самым крупным существующим в настоящий момент платиновым самородком является «Уральский гигант» весом
7 кг 860,5 г. Хранится в Алмазном фонде Московского Кремля.

Самым распространенным металлом в земной коре является алюминий . В недрах земли его содержится восемь процентов , в то время как золота — всего 5 миллионных частей процента .
Однако люди долго не знали алюминия: первый слиток его был выплавлен во Франции только в 1885 году, и металл этот считался тогда драгоценным.

Самым дорогим металлом в мире является Калифорний (Cf) .
Калифорний искусственно получили 1950 году в Калифорнийском Университете в Беркли – отсюда и название.
Калифорний извлекают из продуктов длительного облучения плутония нейтронами в ядерном реакторе. Самый дорогой металл можно встретить в таблице Менделеева под №98. Стоить ли говорить что металл поистине редкий: мировое производство калифорния-252 составляет всего несколько десятков миллиграммов в год.
Стоимость: 6 500 000 $ за 1 грамм

Только 7% добываемого в мире титана используется в машиностроении. 13% идет на производство бумаги, 20% — на производство пластика, а 60% — на производство краски.

Осмий - в совершенно чистом виде в природе этого металла нет, его добывают в связках с другим металлом – иридием. Осмий очень плотный и имеет голубовато-серебристый цвет. Так же металлу присущ неприятный запах, чем то похожий на смесь хлорки и чеснока. Был открыт в 1803 году вместе с иридием. США использует Осмий для производства лекарства – кортозин.

Предметы, изготовленные из такого металла как медь , а также из ее сплавов, не могут создавать искры. Это свойство меди применяется в производстве инструментов для проведения огнеопасных работ. В Японии, подверженной частым землетрясениям, медь применяют для производства газовых трубопроводов, которые отличаются высокой сейсмоустойчивостью. Еще одно интересное свойство меди было выявлено в ходе исследования водоемов, в которых обитают карпы. Оказывается, в воде, не содержащей медь, развивается грибок, который губительно влияет на развитие карпов, а в воде, содержащей медь, карпы хорошо растут и размножаются. Медь есть и в организме человека, но она регулярно выводится, и поэтому мы нуждаемся в своеобразной дозаправке ежедневно 2мг меди.

Ряд активності металів
Li, K, Ba, Sr, Ca, Na, Mg, Be, Al, Mn, Cr, Zn, Fe, Cd, Ni, Sn, Pb, (H), Bi, Cu, Ag, Hg, Pt, Au
- кожен метал розташований в ряду лівіше витісняє з солей інші метали, розташовані в цьому ряду правіше від нього, і може сам бути витіснений із солей металами, розташованими лівіше від нього;
- на початку ряду містяться найбільш активні метали, в кінці ряду – найменш активні.

Хімічні властивості металів
● Активні метали взаємодіють з воднем з утворенням гідридів, які є твердими сполуками. Наприклад:
2K + H 2 → 2KH (калій гідрид) Fe + H 2 ≠

● Метали взаємодіють з неметалами з утворенням солей.
Азот взаємодіє лише з лужними і лужноземельними металами і магнієм. Сірка – з усіма, крім золота і платини.
З галогенами багато металів взаємодіють без нагрівання.
Наприклад :
6K + N 2 → 2K 3 N (калій нітрид); 2Na + S = Na 2 S (натрій сульфід)

● При високій температурі більшість металів згорає в кисні, малоактивні метали окиснюються. Продуктами реакцій горіння активних металів можуть бути оксиди або пероксиди. Так, під час горіння натрію і калію в кисні утворюються пероксиди і як домішки – оксиди: 2Na + O 2 Na 2 O 2 (Натрій пероксид); 4Na + O 2 = 2Na 2 O (Натрій оксид); 2Mg + O 2 =2MgO (Магній оксид). Продуктами реакцій окиснення є оксиди: 2Cu + O 2 = 2CuO (Купрум оксид).

● Дуже активні метали взаємодіють з водою за звичайних умов з утворенням гідроксиду і виділенням водню:
2Na + 2H 2 O → 2NaOH + H 2 . Інші метали взаємодіють з водою при нагріванні: магній під час кипіння води, залізо в парі води при червоному розжарюванні. У цих випадках утворюються оксиди металів і водень:
Zn + H 2 O = ZnO + H 2 .


● Метали, які стоять в ряду активності до водню взаємодіють з кислотами (за винятком нітратної і концентрованої сульфатної кислот) з утворенням солі і водню:
Zn + 2HCl = ZnCl 2 + H 2 Cu + HCl ≠

При взаємодії з нітратною і концентрованою сульфатною кислотами водень ніколи не виділяється, а виділяється вода, сіль та оксиди Нітрогену чи Сульфуру відповідно:
8HNO 3 + 3Zn = 3Zn(NO 3 ) 2 + 2NO + H 2 O.

● Більш активні метали, які стоять в ряду напруг лівіше, можуть витісняти менш активні метали, які в ряду напруг стоять правіше з розчинів їх солей:
CuSO 4 + Fe = FeSO 4 + Cu FeSO 4 + Cu ≠

Написати рівняння хімічних реакцій
K + S → K + H 3 PO 4 → Zn + O 2 → Zn + N 2 → Na + Cl 2 → Al + O 2 → Al + Cl 2 →
Pb + H 2 O →

Zn + Br 2 → Fe + H 2 → Na + P → Al + Cl 2 → Ba + H 2 → Ca + H 2 O → Mg + F 2 →
Pb + AgNO 3 →
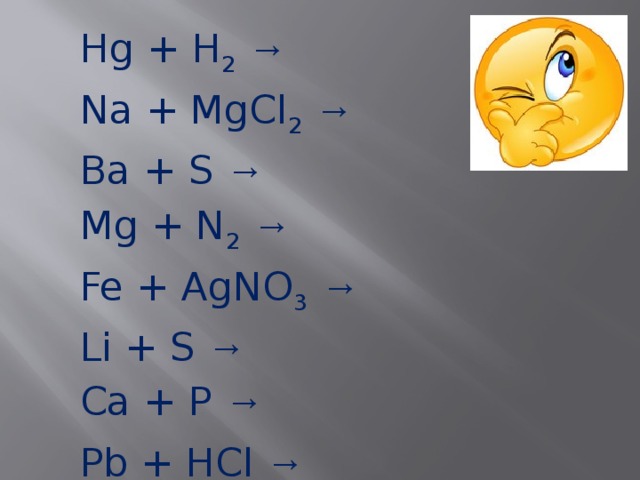
Hg + H 2 → Na + MgCl 2 → Ba + S → Mg + N 2 → Fe + AgNO 3 → Li + S → Ca + P →
Pb + HCl →
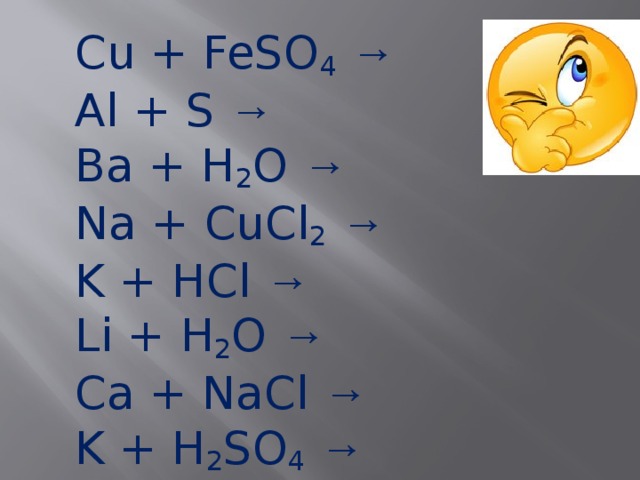
Cu + FeSO 4 → Al + S → Ba + H 2 O → Na + CuCl 2 → K + HCl → Li + H 2 O → Ca + NaCl → K + H 2 SO 4 →

Задача
На 10 г суміші порошків міді і алюмінію подіяли розбавленою сульфатною кислотою. При цьому виділилося 5,6 л газу. Визначте масову частку металів у суміші.

Задача
При взаємодії суміші цинку і міді масою 25 г з розбавленою сульфатною кислотою виділився водень об’ємом 448 мл. Визначте масу металів у суміші.

Задача
Назвіть елемент за такими даними: знаходяться в II групі відносна молекулярна маса гідроксиду 74. Напишіть рівняння реакцій характерні для цього елементу.


 Получите свидетельство
Получите свидетельство Вход
Вход












 Використання презентації на заняттях хімії (презентація з теми "Метали") (3.44 MB)
Використання презентації на заняттях хімії (презентація з теми "Метали") (3.44 MB)
 0
0 941
941 5
5 Нравится
0
Нравится
0


