
ВАЛЕНТНОСТЬ И ВАЛЕНТНЫЕ ВОЗМОЖНОСТИ АТОМА В СВЕТЕ ТЕОРИЙ СТРОЕНИЯ АТОМА И ХИМИЧЕСКОЙ СВЯЗИ
Цели урока:
Углубить знания учащихся о валентных возможностях атомов различных элементов.

Изучаемые вопросы: 1. Валентность и валентные возможности атома в свете теории строения атома. 2. Основное и возбуждённое состояние атома.

Ход урока
- Организационный момент.
- Повторение основных вопросов темы «Ковалентная связь».
- Изучение нового материала.
- Закрепление материала по изученной теме.
- Итоги урока.
- Рефлексия.
- Домашнее задание.

Тема урока:
ВАЛЕНТНОСТЬ И ВАЛЕНТНЫЕ ВОЗМОЖНОСТИ АТОМА В СВЕТЕ ТЕОРИЙ СТРОЕНИЯ АТОМА И ХИМИЧЕСКОЙ СВЯЗИ
ВАЛЕНТНОСТЬ – это способность атомов образовывать определенное количество ковалентных связей.

В образовании ковалентной связи по обменному механизму принимают участие неспаренные электроны
- Количество неспаренных электронов определяется у атомов неметаллов в основном состоянии
№ группы – 8
- При затрате некоторой энергии атомы многих элементов могут увеличивать число неспаренных электронов в результате перехода из основного состояния в возбужденное

Возбуждённое состояние атома – это состояние с более высокой энергией , чем основное.
Процесс перехода атома из основного состояния в возбуждённое называется возбуждением атома
E
Ве Ве
основное состояние возбуждённое
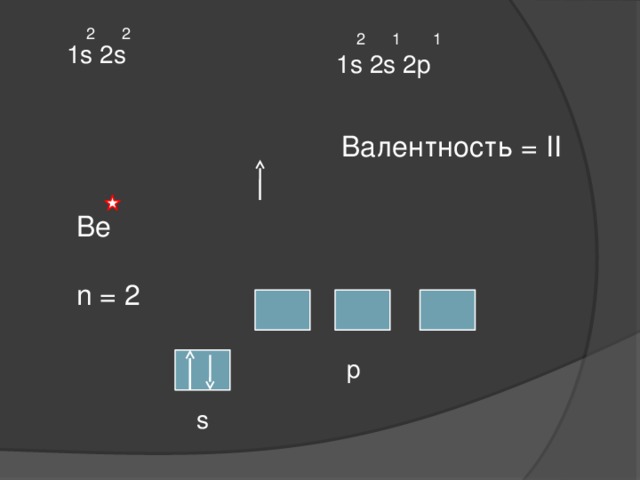
2 2
2 1 1
1s 2s
1s 2s 2p
Валентность = II
Ве
n = 2
p
s
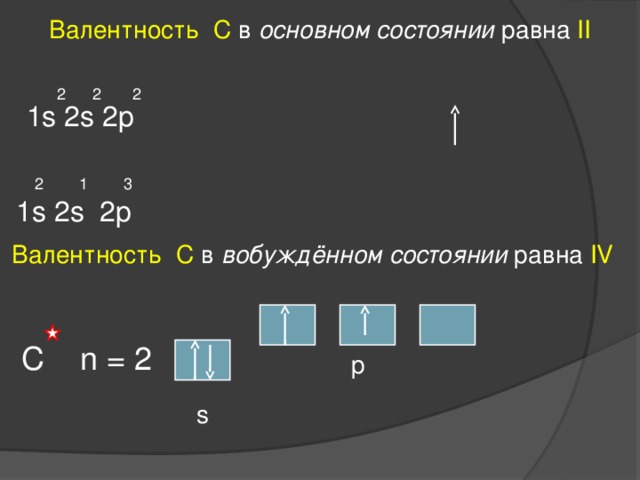
Валентность С в основном состоянии равна II
2 2 2
1s 2s 2p
2 1 3
1s 2s 2p
Валентность С в вобуждённом состоянии равна IV
C n = 2
p
s
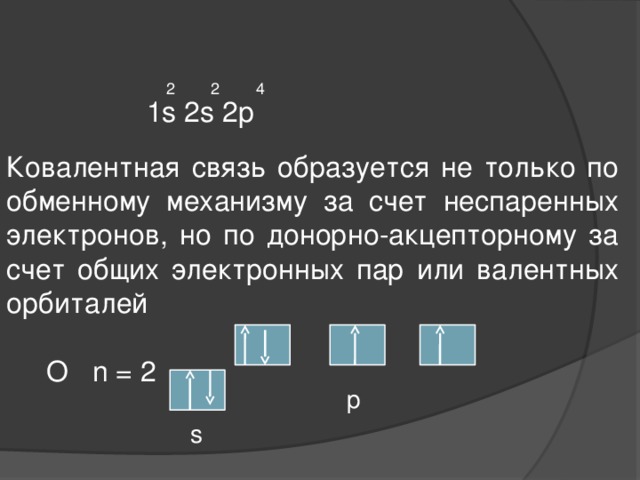
2 2 4
1s 2s 2p
Ковалентная связь образуется не только по обменному механизму за счет неспаренных электронов, но по донорно-акцепторному за счет общих электронных пар или валентных орбиталей
О n = 2
p
s
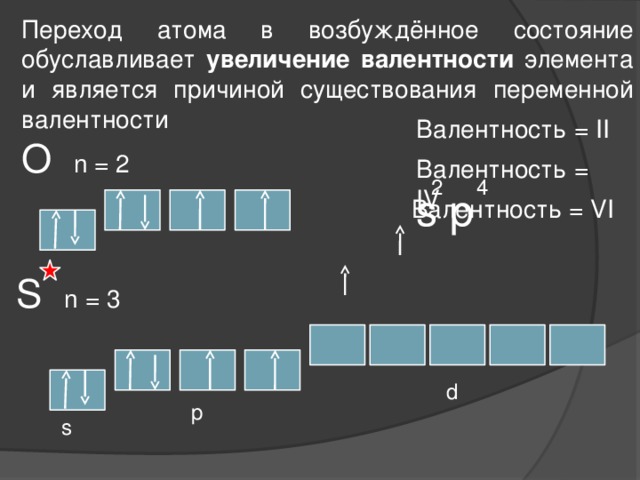
Переход атома в возбуждённое состояние обуславливает увеличение валентности элемента и является причиной существования переменной валентности
Валентность = II
О n = 2
Валентность = IV
2
4
s p
Валентность = VI
S n = 3
d
p
s
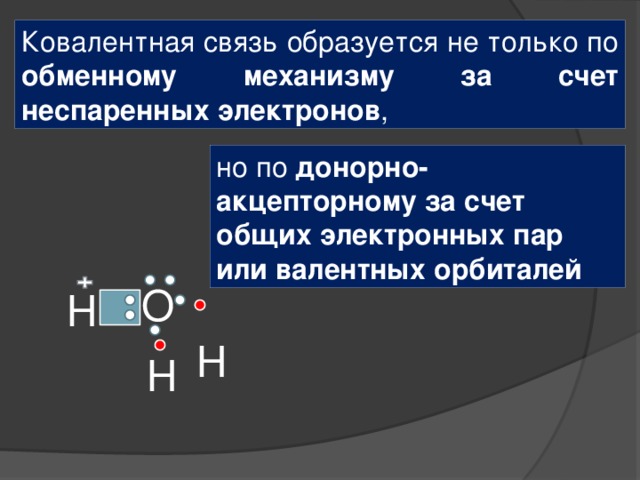
Ковалентная связь образуется не только по обменному механизму за счет неспаренных электронов ,
но по донорно-акцепторному за счет общих электронных пар или валентных орбиталей
О
Н
Н
Н

выводы
- При определении валентности не учитывается полярность образовавшихся связей, следовательно, валентность не имеет знака;
- Атомы большинства элементов проявляют переменную валентность;
- Максимальная валентность достигается атомами многих элементов лишь в возбуждённом состоянии
№ группы
элемент
1
2
Число неспаренных электронов в основном состоянии
Li
Число неспаренных электронов в возбуждённом состоянии
3
Be
4
Высшая валентность
B
5
C
(с учетом д-а механизма)
6
N
7
O
1
F
2
Na
3
Mg
4
Al
5
Si
6
P
7
S
Cl
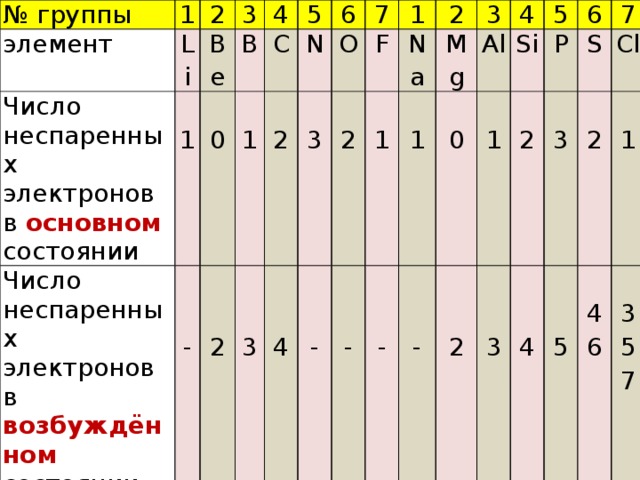
ВЗАИМОСВЯЗЬ МЕЖДУ ВЫСШЕЙ ВАЛЕНТНОСТЬЮ ЭЛЕМЕНТА И ЧИСЛОМ НЕСПАРЕННЫХ ЭЛЕКТРОНОВ В АТОМЕ
Образовательный портал "Мой университет" - www.moi-universitet.ru Факультет "Реформа образования" - www.edu-reforma.ru
№ группы
элемент
1
Число неспаренных электронов в основном состоянии
2
Li
Число неспаренных электронов в возбуждённом состоянии
Be
3
Высшая валентность
1
B
4
(с учетом д-а механизма)
1
C
0
5
2
-
N
6
1
3
2
2
O
7
4
3
F
1
3
4
4
Na
2
2
3
-
Mg
3
1
Al
4
1
-
1
1
5
Si
-
0
P
2
6
-
1
3
7
S
2
2
4
Cl
3
3
2
5
4
6
5
1
4
3
7
6
5
7

Домашнее задание
Параграф 6 (до степени окисления)


 Получите свидетельство
Получите свидетельство Вход
Вход


























 Валентность и валентные возможности атома (0.13 MB)
Валентность и валентные возможности атома (0.13 MB)
 0
0 2546
2546 366
366 Нравится
0
Нравится
0







