Цель:
Ознакомить учащихся с реакциями ионного обмена и условиями их протекания.
Планируемые образовательные результаты.
Предметные.
Дать определение сильных и слабых электролитов. Ввести понятие «степень диссоциации». Научить составлять полные ионные и ионно-молекулярные уравнения реакций. Рассказать об условиях протекания реакций ионного обмена до конца (правило Бертолле)
Метапредметные (УУД).
Развивать умение генерировать идеи, выявлять причинно-следственные связи, искать аналогии и работать в команде, пользоваться альтернативными источниками информации.
Личностные.
Формирование умений управлять своей учебной деятельностью, подготовка к осознанию выбора дальнейшей образовательной траектории.
способность к самооценке на основе наблюдения за собственной речью.
Организационная структура урока.
Мотивация (самоопределение) к учебной деятельности.
Приветствие, настрой на урок.
Актуализация знаний.
1. Проверяет наличие домашней работы в тетрадях.
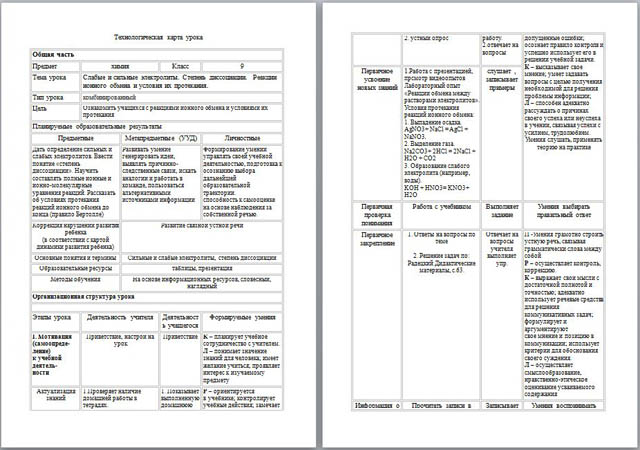
2. устный опрос.
Первичное усвоение новых знаний.
1. Работа с презентацией, прсмотр видеоопытов
Лабораторный опыт «Реакции обмена между растворами электролитов».
Условия протекания реакций ионного обмена:
1. Выпадение осадка.
AgNO3+ NaCl = AgCl + NaNO3
2. Выделение газа.![]()
Na2CO3+ 2HCl = 2NaCl + H2O + CO2
3. Образование слабого электролита (например, воды).
KOH + HNO3= KNO3+ H2O
Первичная проверка понимания.
Работа с учебником.
Первичное закрепление.
1. Ответы на вопросы по теме
2. Решение задач по: Радецкий Дидактические материалы, с.63.
Информация о домашнем задании, инструктаж по его выполнению.
Прочитать записи в тетр.
Домашнее задание: §3, §4, с.13 задача 2, с.22 №1, №3.
Рефлексия (подведение итогов занятия).
– Что мы узнали сегодня на уроке? Что узнали нового?
– Что осталось непонятным?
Весь материал - в документе.

 Получите свидетельство
Получите свидетельство Вход
Вход












 Технологическая карта урока по химии "Слабые и сильные электролиты. Степень диссоциации. Реакции ионного обмена и условия их протекания" (для детей с ОВЗ) (27.5 КB)
Технологическая карта урока по химии "Слабые и сильные электролиты. Степень диссоциации. Реакции ионного обмена и условия их протекания" (для детей с ОВЗ) (27.5 КB)
 0
0 1072
1072 153
153 Нравится
0
Нравится
0


