Муниципальное казённое общеобразовательное учреждение средняя общеобразовательная школа с углублённым изучением отдельных предметов №3
г. Яранска Кировской области
Урок по теме « Галогены»
Логинова Елена Викторовна,
учитель химии
1 квалификационная категория
стаж 18 лет
Пояснительная записка
Рабочее планирование в 9 классе составлено на основе авторской программы преподавания химии О.С.Габриеляна: О.С.Габриелян, Программа курса химии для 8-11 классов общеобразовательных учреждений, Москва, «Дрофа», 2006г. Данный урок разработан в соответствии с требованиями программы.
Проведение занятия построено на системно – деятельностном подходе к обучению. В ходе урока учащимся предлагается система заданий личностно-значимого содержания. Это способствует развитию интеллектуальных и личностных качеств, саморегуляции процесса обучения и способствует повышению мотивации в изучению предмета. Важными в данном занятии являются самоконтроль и самооценка обучающихся, составление плана действий. Такой подход к обучению позволяет формировать универсальные учебные действия: личностные, регулятивные, познавательные и коммуникативные. Материал урока очень насыщен, поэтому на занятии применяется видеофрагменты опытов, что позволяет экономить время. Также в урок включена виртуальная лабораторная работа «Получение хлора и изучение его свойств». Такие работы очень нравятся ребятам, так как позволяют им несколько раз повторить опыт, если что – то не получится и вносят в урок элемент игры, способствует развитию умений учащихся применять свои знания на практике.
Урок имеет и метапредметную тему «Пути познания», которую можно применить при изучении любой предметной темы.
По планированию на тему «Галогены» отводится 3 часа. Данный урок первый при изучении темы. Представленная форма проведения учебного занятия может быть использована как универсальная на примере многих тем курса химии.
Технологическая карта урока химии
Учитель - Логинова Елена Викторовна
Класс – 9 класс. Образовательная программа О.С. Габриелян
Тема. Галогены
Метапредметная тема. Пути познания
Тип урока. Урок первичного предъявления новых знаний
Место урока в изучаемой теме, разделе, курсе. Химия 9.Тема №3 «Неметаллы», третий урок в данной теме.
Цель урока. Сформировать знания учащихся о галогенах как типичных неметаллах
Задачи урока.
Образовательные: - установить зависимость между строением атомов галогенов, видом химической связи и свойствами веществ; - повторить, конкретизировать, закрепить и обобщить знания учащихся о строении молекул простых веществ – галогенов, их физических и химических свойствах.
Развивающие: развитие умений устанавливать причинно – следственные связи между строением и свойствами веществ.
Воспитательные: формирование личностного смысла в изучении химии ( я должен знать свойства вещества, чтобы правильно к ним относиться, с должной аккуратностью и вниманием, чтобы не навредить ни себе, ни другим)
Формируемые УУД.
Личностные: нравственно -этическое оценивание усваиваемого содержания;
Регулятивные: целеполагание, планирование путей достижения целей, контроль, оценка, самостоятельное управление и контроль своего времени;
Познавательные: самостоятельное выделение и формулирование познавательной цели; поиск и выделение необходимой информации; умение осознанно строить речевое высказывание письменно и устно; Рефлексия способов и условий действия, контроль и оценка процесса и результатов деятельности; анализ объектов с целью выделения признаков; выбор оснований для классификации объектов; установление причинно – следственных связей;
Коммуникативные: умение работать в группе, взаимный контроль и оказание необходимой помощи в сотрудничестве.
Методы обучения.
Основной дидактический метод: проблемный;
Частные методы и приёмы: объяснительно – иллюстративный, частично – поисковый, эвристическая беседа.
Формы работы. Фронтальная, парная, индивидуальная.
Применяемые технологии. ИКТ, технология проблемного обучения, технология личностно – ориентированного обучения.
Оборудование к уроку. Компьютер, проектор, презентация, диск «Виртуальная лаборатория». Продукты, содержащие галогены – «Доместос», « Белизна», «Мистер Пропер», зубная паста с фтором, йодомарин, бромгексин, раствор Люголя, поваренная соль, морская капуста. Реактивы: раствор йода, йод кристаллический, бром в ампулах.
Планируемые результаты
Личностные: формирование познавательного интереса к предмету
Предметные: расширение знаний о неорганических веществах - галогенах
Метапредметные: освоение УУД, овладение ключевыми компетенциями (регулятивными, коммуникативными, познавательными)
Ход урока
| Этапы урока | Деятельность учителя | Деятельность учеников |
| 1.Организационный момент | Приветствует учащихся, создает благоприятную обстановку на уроке. Обращает внимание учащихся на готовность к уроку. | Настраиваются на урок. Готовятся к уроку. |
| 2.Актуализация знаний | Вступительное слово учителя. Начать урок я хочу словами русского философа, публициста, писателя прошлого столетия Николая Бердяева: Познание – это солнечный свет, без которого человечество не может развиваться». Слайд №1,2 Мне хочется, чтобы эти слова стали не только эпиграфом сегодняшнего урока, но и девизом нашего успешного продвижения в познании мира, который нас окружает. Ведь человечество всегда стремилось к приобретению новых знаний. Овладение тайнами природы есть выражение высших устремлений творческой активности разума, составляющего гордость человечества. За годы своего развития оно прошло длительный и тернистый путь познания: от примитивного и ограниченного к глубокому и всестороннему проникновению в сущность Природы. Ребята, а как вы думаете, что такое познание? Слайд №3 Слово познание соотносится со словом метод. Видный английский философ 17 века Ф. Бэкон сравнивал метод познания с фонарём, освещающим дорогу путнику, идущему в темноте. Методология – область знания, важнейшей задачей которой является изучение методов познания. А как мы познаём окружающий мир? Слайд №4 Сегодня я предлагаю вам пройти путь познания и приоткрыть ещё одну тайну химии, так как по словам Жана Пиаже: «Понять что – либо, значит открыть вновь»
| Отвечают на вопрос (Познание – путь знания, поиск знания)
Через органы чувств. Наблюдаем, измеряем, вычисляем, проводим эксперименты, чертим схемы, таблицы, графики. Выдвигаем гипотезы, делаем выводы. |
| 3.Целеполагание, мотивация, планирование | Предлагает определить тему урока. Для этого обращает внимание на стол, где находятся следующие предметы: зубная паста, «Доместос», «Белизна», бромгексин, йодомарин, раствор Люголя, поваренная соль, морская капуста. Как вы думаете, что связывает такие разные предметы? О каких элементах идёт речь? Чтобы вам легче было ответить на вопрос, даю вам подсказки. Слайд №5 Для успешного познания необходимо спланировать свою деятельность.
Какие методы познания мы будем для этого использовать? Работа с учебником, рабочими листами, проведение эксперимента, наблюдения, выводы |
Предлагают свои версии.
Формулируют тему урока. Слайд №6,7
Формулируют цели урока. Слайд №8 Составляют план изучения. Слайд №9
|
| 4.Восприятие и осмысление новой информации | 1)Организует работу учащихся по добыванию новых знаний в парах с рабочим листом(приложение №1), учебником. Организует обсуждение результатов работы о строении атомов галогенов и их свойствах. Слайд №10 Проверка заданий – Слайды №11,12,13 2)Предлагает перейти к решению следующей задачи – строение молекулы галогенов и физические свойства. Слайд №14 Зависят ли свойства вещества от типа кристаллической решётки? Какими свойствами должны обладать вещества с молекулярной кристаллической решёткой? Какие физические свойства характерны для галогенов? Какую закономерность вы выявили при изменении агрегатного состояния галогенов? Какую закономерность вы выявили при изменении цвета галогенов? Какую закономерность вы выявили при изменении температур плавления и кипения? С чем это связано? Просмотр видеоролика – возгонка йода - слайд №17 3) Организует работу по изучению химических свойств галогенов. В чём сходство химических свойств галогенов? Как объяснить эти свойства, зная электронное строение галогенов? Просмотр видеороликов – взаимодействие галогенов с алюминием, железом, медью, сурьмой – слайды №18,19,20,21,22,23. Посмотрите на слайд, где записаны уравнения реакций галогенов с водородом. Как изменяются окислительные свойства галогенов? Почему? Слайд №24
Высокая химическая активность – общее свойство галогенов. Но от фтора к йоду активность падает. Поэтому можно составить ряд активности галогенов. Слайд №25 Наиболее активные галогены вытесняют из растворов солей менее активные галогены. Определите какие реакции возможны. Слайд №26 Видеофрагмент. Способен ли йод вытеснять другие галогены из растворов их солей? И снова мы, ребята, сталкиваемся с проявлением единичных свойств. Казалось бы, фтор должен вытеснять все галогены из растворов солей. Но как раз именно для фтора эта реакция не характерна. Почему? Слайд №28 – горение воды во фторе
| 1)Выполняют самостоятельную работу по добыванию новых знаний, участвуют в эвристической беседе. Проверяют задания.
2) Выполняют задания в рабочих листах, работают с таблицей №7учебник О.С. Габриелян стр. 105. Обсуждают результаты, отвечают на вопросы учителя.
3) Отвечают на вопросы. Обсуждают видеофрагменты опытов, записывают уравнения реакций в рабочий лист. Делают вывод: галогены – окислители в реакциях с металлами.
Делают вывод: в подгруппе галогенов с увеличением порядкового номера уменьшается электроотрицательность элемента, уменьшаются его окислительные свойства.
Делают предположения какие реакции возможны между галогенами и галогенидами металлов. Записывают уравнения в рабочем листе, проверяют друг у друга.
Смотрят видеофрагмент, записывают уравнения взаимодействия галогенов с водой в рабочем листе. Делают вывод: в реакции фтора с водой кислород является продуктом реакции горения, а не исходным веществом. |
| 5.Первичное закрепление и первичная проверка понимания | Итак, ребята посмотрите на наш план? Выполнили мы его? Какие методы познания мы использовали? А теперь я предлагаю вам ещё один метод познания – экспериментальный, так как химия – это наука экспериментальная. Но наш эксперимент будет не совсем обычный – виртуальный. |
Ребята садятся за компьютеры и выполняют виртуальную лабораторную работу «Получение хлора и изучение его свойств». После выполнения опытов, обсуждаем, из каких веществ в лаборатории можно получить хлор, условия протекания реакций, что делали и что наблюдали. |
| 6.Закрепление полученных знаний | Проводит игру «Химическое лото» На каждый стол выдаётся лист с напечатанными формулами галогенов, 8 карточек с характеристикой галогенов (4 с правильными ответами, 4 – не правильными). На обратной стороне карточек также написана характеристика одного из галогенов – другим цветом. Если ученик правильно закрыл все формулы в лото, то, перевернув карточки, он сможет прочесть характеристику галогена и назвать его. | Выполняют задание в парах. |
| 7.Рефлексия и домашнее задание | Что нового вы сегодня узнали на уроке? На все вопросы о галогенах мы получили ответ? Какие методы познания мы применили на уроке? Домашнее задание § 18 упр.2,4,5
|
|
Приложение №1
Рабочий лист по теме «Галогены».
| I. Строение атомов
| 1)Положение галогенов в Периодической системе:
Элементы ______________________Группа ______, подгруппа __________ 2)Строение атома количество электронов на внешнем энергетическом уровне ______ атомы галогенов проявляют _______________________ свойства возможные степени окисления у фтора ______, у остальных галогенов _________________ в подгруппе сверху вниз заряд ядра ________________,количество энергетических уровней ________________, атомный радиус ____________________ Электроотрицательность и окислительные свойства в подгруппе ____________________ F CI Br I At Выполните задание: 1) Составьте схемы строения атомов фтора и хлора
2) Определите степени окисления хлора в соединениях:
HCL HCLO HCLO2 HCLO3 HCLO4
|
| II. Простые вещества
(формулы, строение, физические свойства)
III.Химические свойства (взаимодействие с простыми и сложными веществами)
Ряд активности галогенов |
1.Формулы простых веществ_____________________________ 2.Вид химической связи_________________________________ 3.Кристаллическая решетка_______________________________ 4.Агрегатное состояние и цвет: F2_________________________________________________________________ CI2___________________________________ Br2___________________________________ J2____________________________________
|
| а) с Металлами
AL + I2  AI + Br2 AI + Br2   Fe + CI2 Fe + CI2   Cu + CI2 Cu + CI2   Sb + CI2   Вывод: Галогены ………………………… б) с H2
F2 + H2   CI2 + H2 CI2 + H2   Br2 + H2 Br2 + H2  I2 + H2 I2 + H2  Вывод: …………………. в) с H2O
Г2 + H2O  HГ + НГО HГ + НГО Исключение!!! 2 F2 + 2H2O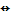 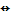 4 HF + О2 4 HF + О2 |
| CI2 Br2 I2 CI2 + NaBr  Br2 + NaI Br2 + NaI  I2 + KCL I2 + KCL 
|
|
Получение | а) в лаборатории MnO2+ HCI   MnCI2 + … + … MnCI2 + … + … *KМnO4 + HCI   MnCI2 + … + KCI+ … MnCI2 + … + KCI+ … в) в промышленности электролиз NaCI   расплав электролиз   *2 NaCI + 2H2O  2NaOH + CI2 + H2 2NaOH + CI2 + H2  раствор
|
Список использованной литературы
Учебно – методический комплекс.
Химия 9 класс.
Программа курса химии 8 – 11 классов общеобразовательных учреждений.
Автор: О.С. Габриелян. Издательство «Просвещение», Москва 2007 год.
Учебник «ХИМИЯ» 9 класс. Автор: О.С. Габриелян. Изд. «ДРОФА», Москва, 2009 год.
«Образовательная коллекция» - диски.
а) ХИМИЯ, базовый курс, 8 – 9 класс;
б) ХИМИЯ (весь школьный курс: теоретическая, неорганическая, органическая химия)
Габриелян О.С., Воскобойникова Н.П., Яшукова А.В. Настольная книга учителя. Химия. 9 класс: Методическое пособие. – М.: Дрофа, 2002г
Дополнительная литература.
1. «Пособие по химии», автор Г.П. Хомченко. Москва, Новая волна «ОНИКС», 2000год.
2. Дидактические карточки – задания по химии. Н.С, Павлова. К учебнику О.С. Габриеляна «Химия. 9 класс». Изд. «ЭКЗАМЕН» 2006 год.
3. ХИМИЯ в тестах, задачах и упражнениях 8-9 классы. Изд. «ДРОФА». Москва, 2006 год.
Электронные издания
Диск «Виртуальная лаборатория». Лаборатория систем мультимедиа, МарГТУ, 2004.


 Получите свидетельство
Получите свидетельство Вход
Вход












 Технологическая карта урока по химии на тему "Галогены" (41.1 КB)
Технологическая карта урока по химии на тему "Галогены" (41.1 КB)
 0
0 2049
2049 320
320 Нравится
0
Нравится
0



