
Реакции ионного обмена
Три пути ведут к знанию:
путь размышления – самый благородный,
путь подражания – самый легкий,
и путь опыта – это самый горький.

Цель урока:
- сформировать представление учащихся о реакциях, протекающих межу ионами, условий протекания реакций ионного обмена до конца, обратимых реакциях, полных и сокращенных ионных уравнениях.

Задачи урока:
- способствовать систематизации понятийного аппарата: ион, растворы, электролиты и неэлектролиты, основные типы реакций в неорганической химии, обратимые реакции, условия протекания реакций ионного обмена до конца
- способствовать совершенствованию специальных предметных умений: составлять полные и сокращенные ионные уравнения;
- способствовать формированию критического мышления учащихся (критически оценивать собственные знания по теме и сопоставлять их с научными);
- .
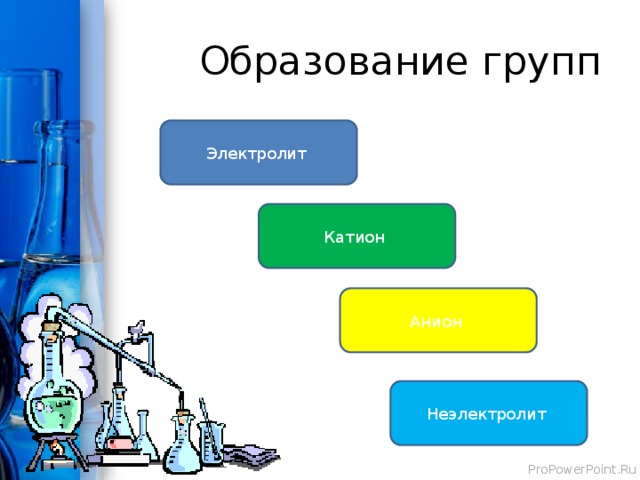
Образование групп
Электролит
Катион
Анион
Неэлектролит

Онлайн -тестирование
Тестирование «Электролиты –неэлектролиты»
«Фронтальный опрос»
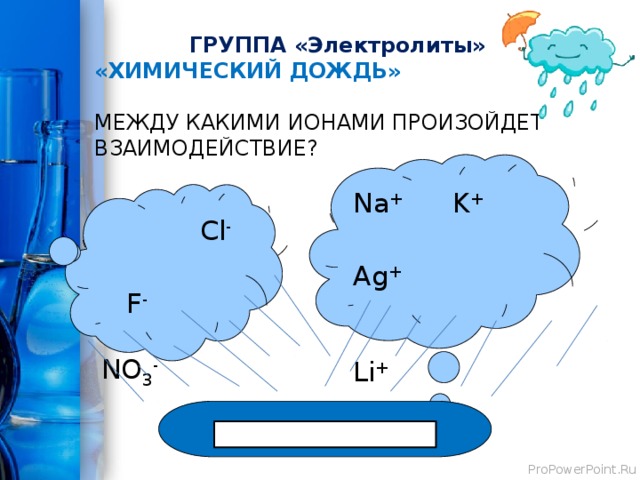
ГРУППА «Электролиты»
«ХИМИЧЕСКИЙ ДОЖДЬ»
МЕЖДУ КАКИМИ ИОНАМИ ПРОИЗОЙДЕТ ВЗАИМОДЕЙСТВИЕ?
Na + K +
Ag + Li +
Cl -
F - NO 3 -
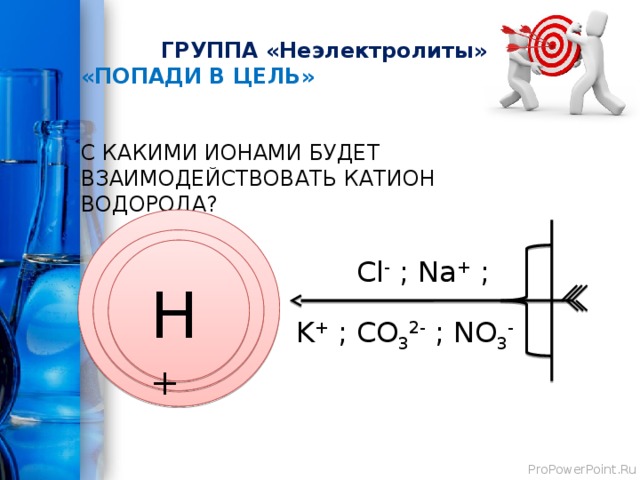
ГРУППА «Неэлектролиты»
«ПОПАДИ В ЦЕЛЬ»
С КАКИМИ ИОНАМИ БУДЕТ ВЗАИМОДЕЙСТВОВАТЬ КАТИОН ВОДОРОДА?
Cl - ; Na + ;
Н +
K + ; CO 3 2- ; NO 3 -

ГРУППА «Катионы»
«ХИМИЧЕСКИЙ АКВАРИУМ»
ВОЗМОЖНО ЛИ ОДНОВРЕМЕННОЕ ПРИСУТСТВИЕ В РАСТВОРЕ УКАЗАННЫХ ИОНОВ?

ГРУППА «Анионы» «ХИМИЧЕСКАЯ АТАКА»
СКОЛЬКО МЯЧЕЙ ПОЙМАЕТ ВРАТАРЬ?

«НАКОРМИ РЫБКУ»
КАКИЕ ИОНЫ БУДУТ «СЪЕДОБНЫ» ДЛЯ РЫБКИ?

ФИЗМИНУТКА

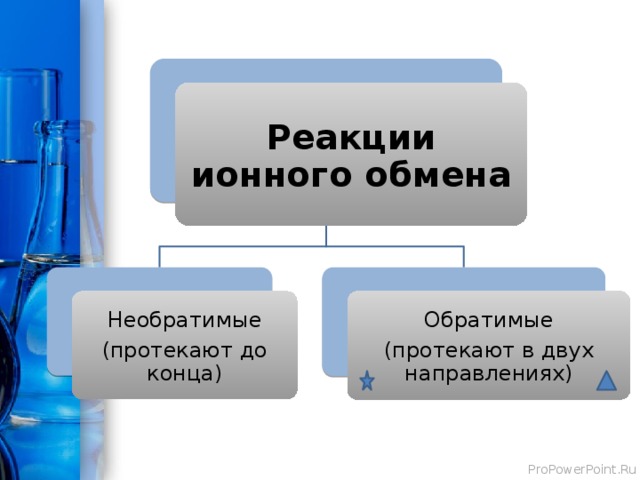
Реакции ионного обмена
Необратимые
Обратимые
(протекают до конца)
(протекают в двух направлениях)

Условия необратимого протекания реакций ионного обмена:
Если выделится газ - Это раз;
И получится вода - Это два;
А еще - нерастворимый
Осаждается продукт…
"Есть осадок ", - говорим мы.
Это третий важный пункт.
Химик "правила обмена"
Не забудет никогда:
В результате - непременно
Будет газ или вода,
Выпадет осадок –
Вот тогда порядок!
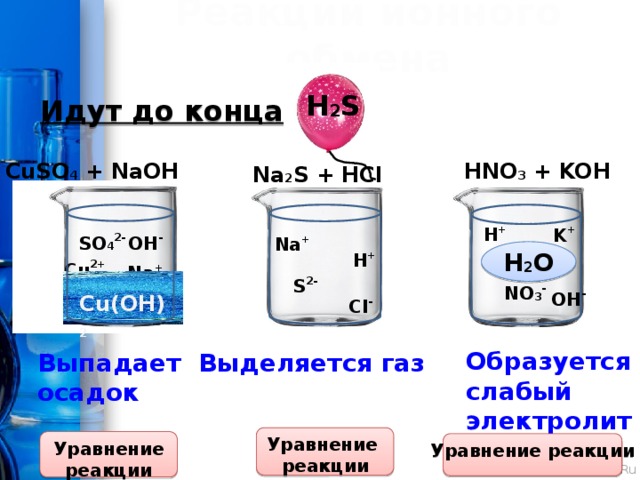
Реакции ионного обмена
H 2 S
Идут до конца:
CuSO 4 + NaOH
HNO 3 + KOH
Na 2 S + HCl
H +
K +
SO 4 2-
OH -
Na +
H 2 O
H +
Cu 2+
Na +
S 2-
NO 3 -
OH -
Сu(OH) 2
Cl -
Образуется
слабый
электролит
Выпадает
Выделяется газ
осадок
Уравнение
реакции
Уравнение
реакции
Уравнение реакции

1.Записать уравнение реакции в
молекулярном виде
2.По таблице растворимости определить
растворимость каждого вещества
3.Составить полное ионное уравнение (записать
диссоциацию растворимых исходных веществ
и продуктов реакции)
4.Найти одинаковые ионы в левой и
правой частях, сократить их и записать
сокращенное ионное уравнение
Алгоритм составления уравнений
- Молекулярное уравнение
CuSO 4 +2NaOH = Cu(OH) 2 + Na 2 SO 4
- Полное ионное уравнение
- Сокращенное ионное уравнение
Т1
-
+
+
2-
2-
2+
+
Na
SO 4
Cu(OH) 2
2
+
=
+
+
2
OH
Cu
SO 4
+
2
Na
-
2+
Cu(OH) 2
+
=
2OH
Cu

Составление уравнений
- Молекулярное уравнение
Na 2 S+2HCl = H 2 S + 2NaCl
- Полное ионное уравнение
- Сокращенное ионное уравнение
Т2
-
-
+
+
2-
+
Na
2
+
2
Cl
+
H 2 S
=
+
2
Cl
2
+
Na
+
2
S
H
+
2-
H 2 S
=
2H
+
S

Составление уравнений
- Молекулярное уравнение
HNO 3 +KOH = KNO 3 + H 2 O
- Полное ионное уравнение
- Сокращенное ионное уравнение
Т3
-
-
+
-
+
+
+
H 2 O
NO 3
K
+
+
+
=
+
OH
H
NO 3
K
+
-
H 2 O
+
OH
=
H
 1г на 100г Н 2 О) _ М OH - _ Р Р OH - Р Н Н Н _ Н Н Н Н Баженов А.А. Баженов А.А. М - вещество мало растворяется (от 0,1г до 1г на 100г Н 2 О) Р Р Р Р Р Р Р Р Р Р Р Р NO 3 - NO 3 - Р Р Р Р М Р Р Р Р Cl - Р Р Р Р Р Р Cl - Р Р Н Баженов А.А. Н - вещество не растворяется ( 2 О) Н Р _ S 2- _ Н Н Н Н Н М Р Н Р Р Р S 2- _ - вещество в водной среде разлагается Н М М М ? SO 3 2- Н ? М ? Р Н М Р Р Р SO 3 2- ? - нет достоверных сведений о существовании соединения Р Р М Р SO 4 2- Р М Н Р Р Н Р _ SO 4 2- Р Р Р Н Н Н Н Н CO 3 2- CO 3 2- ? Н Н Р Н Р Р Р ? ? NH 4 + H + - положительно заряженные ионы Катионы SiO 3 2- ? ? Н Н ? ? Н Н Н Н ? Р Р ? SiO 3 2- Н … Ионы Р Н Р _ Н Р Н PO 4 3- Н Н Н Н Н Н Н PO 4 3- Н - отрицательно заряженные ионы Cl - OH - Анионы … Р Р Р CH 3 COO - Р Р Р Р Р Р Р Р _ _ Р CH 3 COO - Р Выключить поиск Обозначения Включить поиск . 4 1 2 3 19 " width="640"
1г на 100г Н 2 О) _ М OH - _ Р Р OH - Р Н Н Н _ Н Н Н Н Баженов А.А. Баженов А.А. М - вещество мало растворяется (от 0,1г до 1г на 100г Н 2 О) Р Р Р Р Р Р Р Р Р Р Р Р NO 3 - NO 3 - Р Р Р Р М Р Р Р Р Cl - Р Р Р Р Р Р Cl - Р Р Н Баженов А.А. Н - вещество не растворяется ( 2 О) Н Р _ S 2- _ Н Н Н Н Н М Р Н Р Р Р S 2- _ - вещество в водной среде разлагается Н М М М ? SO 3 2- Н ? М ? Р Н М Р Р Р SO 3 2- ? - нет достоверных сведений о существовании соединения Р Р М Р SO 4 2- Р М Н Р Р Н Р _ SO 4 2- Р Р Р Н Н Н Н Н CO 3 2- CO 3 2- ? Н Н Р Н Р Р Р ? ? NH 4 + H + - положительно заряженные ионы Катионы SiO 3 2- ? ? Н Н ? ? Н Н Н Н ? Р Р ? SiO 3 2- Н … Ионы Р Н Р _ Н Р Н PO 4 3- Н Н Н Н Н Н Н PO 4 3- Н - отрицательно заряженные ионы Cl - OH - Анионы … Р Р Р CH 3 COO - Р Р Р Р Р Р Р Р _ _ Р CH 3 COO - Р Выключить поиск Обозначения Включить поиск . 4 1 2 3 19 " width="640"
Таблица растворимости
Т
Баженов А.А.
Ca 2+
Fe 2+
Pb 2+
Hg 2+
Cu 2+
Zn 2+
Mg 2+
Ba 2+
Al 3+
Ag +
Na +
K +
NH 4 +
H +
Ионы
Fe 3+
Ba 2+
Ca 2+
Pb 2+
Mg 2+
Ag +
Zn 2+
Cu 2+
Na +
Hg 2+
K +
H +
Fe 2+
Fe 3+
NH 4 +
Al 3+
Ионы
Р
- вещество растворяется (1г на 100г Н 2 О)
_
М
OH -
_
Р
Р
OH -
Р
Н
Н
Н
_
Н
Н
Н
Н
Баженов А.А.
Баженов А.А.
М
- вещество мало растворяется (от 0,1г до 1г на 100г Н 2 О)
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
NO 3 -
NO 3 -
Р
Р
Р
Р
М
Р
Р
Р
Р
Cl -
Р
Р
Р
Р
Р
Р
Cl -
Р
Р
Н
Баженов А.А.
Н
- вещество не растворяется ( 2 О)
Н
Р
_
S 2-
_
Н
Н
Н
Н
Н
М
Р
Н
Р
Р
Р
S 2-
_
- вещество в водной среде разлагается
Н
М
М
М
?
SO 3 2-
Н
?
М
?
Р
Н
М
Р
Р
Р
SO 3 2-
?
- нет достоверных сведений о существовании соединения
Р
Р
М
Р
SO 4 2-
Р
М
Н
Р
Р
Н
Р
_
SO 4 2-
Р
Р
Р
Н
Н
Н
Н
Н
CO 3 2-
CO 3 2-
?
Н
Н
Р
Н
Р
Р
Р
?
?
NH 4 +
H +
- положительно заряженные ионы
Катионы
SiO 3 2-
?
?
Н
Н
?
?
Н
Н
Н
Н
?
Р
Р
?
SiO 3 2-
Н
…
Ионы
Р
Н
Р
_
Н
Р
Н
PO 4 3-
Н
Н
Н
Н
Н
Н
Н
PO 4 3-
Н
- отрицательно заряженные ионы
Cl -
OH -
Анионы
…
Р
Р
Р
CH 3 COO -
Р
Р
Р
Р
Р
Р
Р
Р
_
_
Р
CH 3 COO -
Р
Выключить поиск
Обозначения
Включить поиск
.
4
1
2
3
19

Не расписываются на ионы:
- Вода H 2 O .
- Слабые кислоты (HNO 2 , H 2 CO 3 , H 2 SO 3 , CH 3 COOH и др.).
- Слабые и нерастворимые основания (NH 4 OH, Fe(OH) 2, Cu(OH) 2, и др.).
- Нерастворимые соли(↓): (AgCl , BaSO 4 , CaCO 3 , FeS и др.).
- Амфотерные гидрооксиды (↓): (Al(OH) 3 , Zn(OH) 2 , Cr(OH) 3 и др.).
- Газообразные вещества ( CO 2 , SO 2 , H 2 , H 2 S, NH 3 и др.).
- Оксиды металлов и неметаллов (Li 2 O, MgO, P 2 O 5 , SiO 2 , и др.).
Обратимые реакции
Na 2 SO 4 + KNO 3
1.Нет осадка
Na +
2.Не выделяется газ
NO 3 -
SO 4 2-
3.Не образуется
слабый электролит
K +

Составление уравнений
- Молекулярное уравнение
Na 2 SO 4 +2KNO 3 2NaNO 3 + K 2 SO 4
- Полное ионное уравнение
Т4
-
-
+
+
+
2-
2-
+
SO 4
+
+
NO 3
2
K
+
Na
2
+
2
NO 3
+
2
+
SO 4
K
2
2Na
Обратимые реакции – реакции, идущие
во взаимно
противоположных направлениях

ГРУППА «Электролиты»
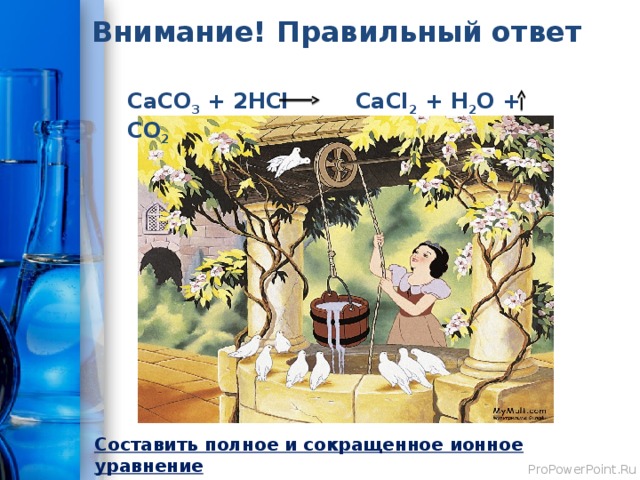
Колдунья с вороном отравили лечебный колодец, в котором был раствор хлористого кальция, который помогал целому городу. Он использовался горожанами при отравлениях, кровотечениях, аллергиях. Они превратили раствор СaCl 2 в нерастворимый известняк CaCO 3 . Помогите жителям «расколдовать» колодец, если в вашем распоряжении есть растворы NaCl, Na 2 CO 3 , HCl, H 2 SO 4 , Zn(NO 3 ) 2.

Внимание! Правильный ответ
СаСО 3 + 2HCl CaCl 2 + H 2 O + CO 2
Составить полное и сокращенное ионное уравнение

ГРУППА
«Неэлектролиты»
Олененок спешит к друзьям. Он шел долгих 3 дня. Ему осталось только перейти реку, но река оказалась испорчена – она наполнена раствором серной кислоты. Помогите Олененку воссоединиться с друзьями, если в вашем распоряжении есть растворы NaCl, Ba(OH) 2 HCl, CuSO 4 , Ba(NO 3 ) 2 .

Внимание! Правильный ответ
H 2 SO 4 + Ba(OH) 2 BaSO 4 + 2H 2 O
Составить полное и сокращенное ионное уравнение

ГРУППА «Катионы»
Тигренок и крокодил поранились, а у доктора Айболита закончились все лекарства. У него в распоряжении есть некоторые химикаты: NaNO 3 , CuOH) 2 H 2 SO 4 , НCl, BaCl 2 . Он знает, что раствор сульфата меди (II) может оказывать антисептическое, вяжущее, ранозаживляющее действие. Помогите доктору приготовить раствор и вылечить тигренка и крокодила.

Внимание! Правильный ответ
Cu(OH) 2 + H 2 SO 4 CuSO 4 + 2H 2 O
Составить полное и сокращенное ионное уравнение

ГРУППА «Анионы»
Однажды русалка заметила, что ее друзья рыбы перестали с ней играть и уплывают подальше от ее дома. Она не могла понять, в чем дело, ведь они не ссорились… И тогда ее мама рассказала ей, что рыбы уплывают, потому что около их дома почти нет растений, и рыбам не хватает кислорода… Русалка подумала, что можно посадить растения, но они будут расти долго… А из старых мудрых книжек она узнала, что можно насытить воду углекислым газом – повышение концентрации СО 2 в воде приводит к значительному ускорению в росте растений. В распоряжении русалки оказались: NaOH, ВaCO 3 , K 2 SO 4 , НCl, Ba(NO 3 ) 2 . помогите русалке получить углекислый газ.

Внимание! Правильный ответ
BаСО 3 + 2HCl BaCl 2 + H 2 O + CO 2
Составить полное и сокращенное ионное уравнение
Михаил и Алексей делали домашнее задание. Они составили уравнения реакций, но случайно на лист бумаги пролили чернила. Помогите ученикам восстановить запись. Составьте к восстановленным уравнениям полные и сокращенные ионные уравнения
1) NaOH + HCl NaCl + H 2 O
2) MgCl 2 + Na 2 SO 3 MgSO 3 + 2NaCl
3) K 2 SO 3 + HNO 3 KNO 3 + H 2 O + SO 2
4) ZnSO 4 + 2NaOH Zn(OH) 2 + Na 2 SO 4
5) Al(OH) 3 + 3HNO 3 Al(NO 3 ) 3 + 3H 2 O
6) CaCO 3 + 2 HCl CaCl 2 + H 2 O + CO 2
Внимание! Правильный ответ
- NaOH + HCl NaCl + H 2 O
Na +1 + OH -1 + H +1 + Cl -1 Na +1 + Cl -1 + H 2 O
OH -1 + H +1 H 2 O
2) MgCl 2 + Na 2 SO 3 MgSO 3 + 2NaCl
Mg +2 + 2Cl -1 + 2Na +1 + SO 3 -2 MgSO 3 + 2Na +1 +2Cl -1
Mg +2 + SO 3 -2 MgSO 3
3) K 2 SO 3 + 2HNO 3 2 KNO 3 + H 2 O + SO 2
2K +1 + SO 3 -2 + 2H +1 + 2NO 3 -1 2K +1 + 2NO 3 -1 + H 2 O + SO 2
SO 3 -2 + 2H +1 H 2 O + SO 2

Внимание! Правильный ответ (продолжение)
4) ZnSO 4 + 2NaOH Zn(OH) 2 + Na 2 SO 4
Zn +2 + SO 4 -2 + 2Na +1 + 2OH -1 2Na +1 + SO 4 -2 + Zn(OH) 2
Zn +2 + 2OH -1 Zn(OH) 2
5) Al(OH) 3 + 3HNO 3 Al(NO 3 ) 3 + 3H 2 O
Al(OH) 3 + 3H +1 + 3NO 3 -1 Al +3 + 3NO 3 -1 + 3H 2 O
Al(OH) 3 + 3H +1 Al +3 + 3H 2 O
6) CaCO 3 + 2 HCl CaCl 2 + H 2 O + CO 2
CaCO 3 + 2H +1 + 2Cl -1 Ca +2 + 2Cl -1 + H 2 O + CO 2
CaCO 3 + 2H +1 Ca +2 + H 2 O + CO 2

ПОДЪЕМ С ПРЕПЯТСТВИЯМИ
Дать определение понятиям.

Домашнее задание
- e.edu.kz -Цор 3576 http ://e.edu.kz/sui/#/ lcms/scorm/542736660
- https:// www.youtube.com/watch?v=CeHGqar-vtk
- https:// www.youtube.com/watch?v=pGcmZa400JI
- https:// www.youtube.com/watch?v=s9iVggylAdA

Лестница успеха
Выберите свой уровень успеха
3
2
1
4
5
6

 Получите свидетельство
Получите свидетельство Вход
Вход











 Реакции ионного обмена (3.86 MB)
Реакции ионного обмена (3.86 MB)
 0
0 1283
1283 19
19 Нравится
0
Нравится
0


