____________ Т.Н.Стратий _____________ М.В. Цыганкова
от ______________2013 г. от ________________ 2013 г.
Рабочая программа составлена на основе Примерной программы основного общего образования по химии (базовый уровень) для 9 класса общеобразовательных учреждений (автор О.С. Габриелян) и федерального компонента государственного образовательного стандарта, федерального перечня учебников, рекомендованных Министерством образования Российской Федерации к использованию в образовательном процессе в общеобразовательных учреждениях на 2013-2014 учебный год, с учетом требований к оснащению образовательного процесса в соответствии с содержанием наполнения учебных предметов компонента государственного стандарта общего образования, учебного плана на 2013-2014 учебный год.
В содержании курса 9 класса вначале обобщенно раскрыты сведения о свойствах классов веществ – металлов и неметаллов, а затем подробно освещены свойства щелочных и щелочно-земельных металлов и галогенов. Наряду с этим в курсе раскрываются также и свойства отдельных важных в народнохозяйственном отношении веществ. Заканчивается курс кратким знакомством с органическими веществами, в основе отбора которых лежит идея генетического развития органических веществ от углеводородов до биополимеров (белков и углеводов).
Характеристика элемента по его положению в периодической системе химических элементов Д.И. Менделеева. Свойства оксидов, кислот, оснований и солей в свете теории электролитической диссоциации и процессов окисления-восстановления. Генетические ряды металла и неметалла.
Понятие о переходных элементах. Амфотерность. Генетический ряд переходного элемента.
Периодический закон и периодическая система химических элементов Д.И. Менделеева в свете учения о строении атома. Их значение.
Положение металлов в периодической системе химических элементов Д.И. Менделеева. Металлическая кристаллическая решетка и металлическая химическая связь. Общие физические свойства металлов. Сплавы, их свойства и значение. Химические свойства металлов как восстановителей. Электрохимический ряд напряжений металлов и его использование для характеристики химических свойств конкретных металлов. Способы получения металлов: пиро-, гидро- и электрометаллургия. Коррозия металлов и способы борьбы с ней.
1. Осуществление цепочки химических превращений металлов. 2. Получение и свойства соединений металлов. 3. Решение экспериментальных задач на распознавание и получение веществ.
Общая характеристика неметаллов: положение в периодической системе Д.И. Менделеева, особенности строения атомов, электроотрицательность как мера «неметалличности», ряд электроотрицательности. Кристаллическое строение неметаллов – простых веществ. Аллотропия. Физические свойства неметаллов. Относительность понятий «металл», «неметалл».
Взаимодействие серы с металлами, водородом и кислородом.
Взаимодействие концентрированной азотной кислоты с медью.
Поглощение углем растворенных веществ или газов. Восстановление меди из ее оксида углем. Образцы природных соединений хлора, серы, фосфора, углерода, кремния. Образцы важнейших для народного хозяйства сульфатов, нитратов, карбонатов, фосфатов. Образцы стекла, керамики, цемента.
4. Решение экспериментальных задач по теме «Подгруппа кислорода». 5. Решение экспериментальных задач по теме «Подгруппы азота и углерода». 6. Получение, собирание и распознавание газов.
Вещества органические и неорганические, относительность понятия «органические вещества». Причины многообразия органических соединений. Химическое строение органических соединений. Молекулярные и структурные формулы органических веществ.
Метан и этан: строение молекул. Горение метана и этана. Дегидрирование этана. Применение метана.
Химическое строение молекулы этилена. Двойная связь. Взаимодействие этилена с водой. Реакция полимеризации этилена. Полиэтилен и его значение.
Понятие о предельных одноатомных спиртах на примере метанола и этанола. Трехатомный спирт – глицерин.
Понятие об альдегидах на примере уксусного альдегида. Окисление альдегида в кислоту.
Одноосновные предельные карбоновые кислоты на примере уксусной кислоты. Ее свойства и применение. Стеариновая кислота как представитель жирных карбоновых кислот.
Реакции этерификации и понятие о сложных эфирах. Жиры как сложные эфиры глицерина и жирных кислот.
Понятие об аминокислотах. Реакции поликонденсации. Белки, их строение и биологическая роль.
Понятие об углеводах. Глюкоза, ее свойства и значение. Крахмал и целлюлоза (в сравнении), их биологическая роль.
Физический смысл порядкового номера элемента в периодической системе химических элементов Д.И. Менделеева, номеров периода и группы. Закономерности изменения свойств элементов и их соединений в периодах и группах в свете представлений о строении атомов элементов. Значение периодического закона.
Типы химических связей и типы кристаллических решеток. Взаимосвязь строения и свойств веществ.
Классификация химических реакций по различным признакам (число и состав реагирующих и образующихся веществ; тепловой эффект; использование катализатора; направление; изменение степеней окисления атомов).
Простые и сложные вещества. Металлы и неметаллы. Генетические ряды металла, неметалла и переходного металла. Оксиды (основные, амфотерные и кислотные), гидроксиды (основания, амфотерные гидроксиды и кислоты) и соли: состав, классификация и общие химические свойства в свете теории электролитической диссоциации и представлений о процессах окисления-восстановления.
· приготовления растворов заданной концентрации.
| № п/п | Раздел про- грам- мы | Тема урока | Кол- во ча- сов | Основные элементы содержания. Дополнительные элементы содержания | Требования к уровню подготовки учащихся | Вид контроля. Измерители | Домашнее задание | Оборудование, демонстрации, лабораторные опыты | Дата |
| план | факт |
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 |
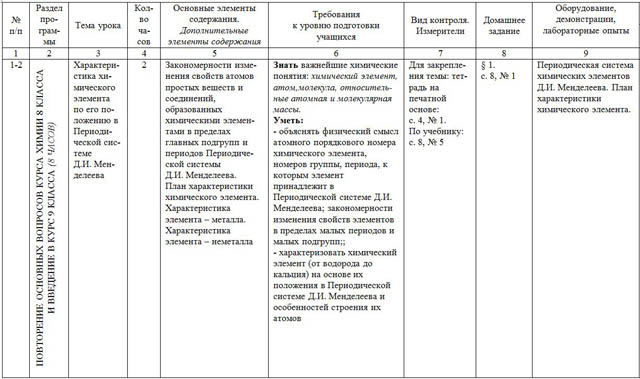
| 1-2 | ПОВТОРЕНИЕ ОСНОВНЫХ ВОПРОСОВ КУРСА ХИМИИ 8 КЛАССА И ВВЕДЕНИЕ В КУРС 9 КЛАССА (8 ЧАСОВ) | Характери- стика хи- мического элемента по его по- ложению в Периоди- ческой сис- теме Д.И. Мен- делеева | 2 | Закономерности изме- нения свойств атомов простых веществ и соединений, образованных химическими элемен- тами в пределах главных подгрупп и периодов Периодиче- ской системы Д.И. Менделеева. План характеристики химического элемента. Характеристика элемента – металла. Характеристика элемента – неметалла | Знать важнейшие химические понятия: химический элемент, атом,молекула, относитель- ные атомная и молекулярная массы. Уметь: - объяснять физический смысл атомного порядкового номера химического элемента, номеров группы, периода, к которым элемент принадлежит в Периодической системе Д.И. Менделеева; закономерности изменения свойств элементов в пределах малых периодов и малых подгрупп;; - характеризовать химический элемент (от водорода до кальция) на основе их положения в Периодической системе Д.И. Менделеева и особенностей строения их атомов | Для закрепле-ния темы: тет-радь на печатной основе: с. 4, № 1. По учебнику: с. 8, № 5 | § 1. с. 8, № 1 | Периодическая система химических элементов Д.И. Менделеева. План характеристики химического элемента. |
|
|
| 3 | ПОВТОРЕНИЕ ОСНОВНЫХ ВОПРОСОВ КУРСА ХИМИИ 8 КЛАССА И ВВЕДЕНИЕ В КУРС 9 КЛАССА (8 часов) | Свойства оксидов, кислот, оснований и солей в свете ТЭД | 1 | Характеристика свойств оксидов, кислот, оснований и солей в свете ТЭД | Знать: - химические свойства основ-ных классов неорганических веществ; - возможность протекания ре- акций ионного обмена. Уметь: - записывать уравнения хими-ческих реакций ионного обме-на в молекулярном и ионном виде;
| Текущий кон-троль. Работа по кар-точкам | осущест вить цепочку превраще ний
| ПСХЭ. «Контрольные и проверочные работы. Химия-9» к учебнику О.С. Габриеляна.
|
|
|
| 4 | Свойства оксидов, кислот, оснований и солей в свете процессов окисления-восстановления | 1 | Характеристика свойств оксидов, кислот, оснований и солей в свете процессов окисления-восстановления | Уметь: - составлять электронный ба-ланс для ОВР; - определять окислитель и восстановитель; - составлять формулы неорга-нических соединений изучен-ных классов, уравнения хими-ческих реакций
| Текущий кон-троль. Работа по кар-точкам: про-верочная ра-бота по сбор-нику «Кон-трольные и проверочные работы. Хи-мия-9» к учебнику О.С. Габриеляна, | составить электронный баланс | ПСХЭ. «Контрольные и проверочные работы. Химия-9» к учебнику О.С. Габриеляна.
|
|
|
| 5-6 | Амфотерные оксиды и гидроксиды | 2 | Зависимость химиче- ских свойств оксидов и гидроксидов элементов побочных подгрупп ПС Д.И. Менделеева от степеней окисления их атомов. Понятие амфотерно-сти на примере оксида и гидроксида алюминия | Знать: - химические свойства амфотерных оксидов и гидроксидов; - возможность протекания ре- акций ионного обмена. Уметь: - составлять формулы неорга-нических соединений изучен-ных классов, уравнения хими-ческих реакций
| Текущий кон-троль. Работа по кар-точкам: про-верочная ра-бота по сбор-нику «Кон-трольные и проверочные работы. Хи-мия-9» к учебнику О.С. Габриеляна
| § 2. Тетрадь на печатной основе: с. 11, № 3-4 | ПСХЭ. «Контрольные и проверочные работы. Химия-9» к учебнику О.С. Габриеляна. Д. Амфотерность гидроксида алюминия и гидроксида цинка (растворы едкого натра, соляной кислоты, солей цинка и алюминия) Л. Получение гидроксида цинка и исследование его свойств |
|
|
| 7 | Периодический закон и система элементов Д.И. Менделеева в свете учения о строении атома | 1 | Открытие Д.И. Менделеевым Периодического закона. Физический смысл порядкового номера химического элемента, номеров периода и группы. Закономерности изменения свойств элементов и образованных ими веществ в периодах и группах
| Знать: - положение металлов и неметаллов в ПСХЭ; - отличие физических свойств Ме и НеМе; - значение ПЗ для науки и практики. Уметь: - писать уравнения реакций химических свойств Ме и НеМе | Текущий кон-троль: опрос. | § 3, упр3-6 на с. 16.
| ПСХЭ. таблица «Генетические связи неорганических веществ» |
|
|
| 8 | Контроль ная работа №1 «Характеристика химическо го элемента на основании его положения в ПСХЭ» | 1 | Тематический контроль знаний | Знать: - химические свойства амфотерных оксидов и гидроксидов; - возможность протекания ре- акций ионного обмена. - положение металлов и неметаллов в ПСХЭ; - отличие физических свойств Ме и НеМе; - значение ПЗ для науки и практики. Уметь: - характеризовать химический элемент (от водорода до кальция) на основе их положения в Периодической системе Д.И. Менделеева и особенностей строения их атомов; - составлять формулы неорга-нических соединений изучен-ных классов, уравнения хими-ческих реакций;
|
|
| «Контрольные и проверочные работы. Химия-9» к учебнику О.С. Габриеляна. |
|
|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 |
| 9 | МЕТАЛЛЫ (16 часов) | Положение металлов в Периодической системе Д.И. Менделеева Общие физические свойства металлов | 1 | Краткий исторический обзор: век медный – век –бронзовый – век – железный. Характеристика поло-жения элементов- металлов в Периодической системе. Строение атомов металлов. Металлические кристаллические решетки. Металлическая химическая связь. Физические свойства металлов простых веществ. Легкие и тяжелые металлы. Драгоценные металлы. | Знать: - положение элементов металлов в ПС. - физические свойства метал-лов: пластичность, электро- и теплопроводность, металли-ческий блеск, твердость, плотность. Уметь: - характеризовать металлы на основе их положения в периодической системе Д.И. Менделеева и особенностей строения их атомов; - использовать приобретенные знания и умения в практи-ческой деятельность и повсед-невной жизни: · для безопасного обращения с металлами; · экологически грамотного поведения в окружающей среде; · критической оценки информации о веществах, используемых в быту | Текущий контроль: устный опрос | § 5-6. упр. 1-5 на с. 28 | ПСХЭ. Сборник «Контроль-ные и проверочные ра-боты. Химия-9» к учебнику Габриеляна. Л. Знакомство с образцами металлов (по коллекции). Таблицы: «Относительная твердость некоторых металлов», «Плотность некоторых металлов», «Температура плавления некоторых металлов» |
|
|
| 10 | Сплавы | 1 | Сплавы и их классифи-кация. Черные метал-лы: чугуны и стали. Цветные металлы: бронза, латунь, мель-хиор, дюралюминий. Характеристика сплавов, их свойства. Значение важнейших сплавов. | Знать классификацию сплавов на основе черных (чу-гун и сталь) и цветных металлов, характеристику физических свойств Ме. Уметь описывать свойства и области применения различных металлов и сплавов | Текущий кон-троль. | § 6-7, с. 34, № 2.
| Д. Знакомство с образ-цами металлов и сплавов (по коллекциям). Репродукции и фотографии произведений искусства из сплавов |
|
|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 |
| 11 | МЕТАЛЛЫ (16 часов) | Химичес-кие свой-ства метал-лов | 1 | Восстановительные свойства металлов. Взаимодействие металлов с кислородом и другими неметаллами | Знать общие химические свойства металлов: взаимодействие с неметаллами, водой, кислотами, солями. Уметь записывать уравнения реакций взаимодействия с неметаллами, кислотами, со-лями, используя электрохи-мический ряд напряжения металлов для характеристики химических свойств | Текущий кон-троль – опрос, краткие сооб-щения уча-щихся.
| § 8, до слов «…по восстано-вительной способ-ности…», с. 37, № 2 | Д. Горение магния, взаимод. натрия с кислородом. Взаимодействие натрия и кальция с водой (вода, фенолфталеин). Взаимодействие ме- талов с неметаллами (смесь порошка цинка с мелкорастертой серой), фарфоровая чашка, вода, пипетка).
|
|
|
| 12 | Химиче-ские свойства металлов (продолже-ние). Ряд активности металлов | 1 | Характеристика общих химических свойств металлов на основании их положения в ряду напряжения в свете представления об ОВР. Правила применения электрохимического ряда напряжений при определении возмож-ности взаимодействия с растворами кислот и солей. Поправки к правилам применения электро-химического ряда на-пряжения. Металлотермия | Уметь записывать уравнения реакций взаимодействия с неметаллами, кислотами, со-лями, используя электрохи-мический ряд напряжения металлов для характеристики химических свойств | Текущий кон-троль – опрос, работа по кар-точкам.
| § 8 (до конца). с. 37, № 5-7 | Ряд активности металлов. Слайд-лекция «Металлы», проектор, ноутбук. Л. Взаимодействие металлов с растворами кислот и солей (Растворение железа и цинка в соляной кислоте (гранулы цинка, железные опилки, соляная кислота), вытеснение одного металла другим из раствора соли (раствор медного купороса, железо))
|
|
|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 |
| 13 | МЕТАЛЛЫ (16 часов) | Металлы в природе, общие спо-собы полу-чения металлов | 1 | Самородные металлы. Минералы. Руды. Металлургия и ее виды: пиро-, гидро-, электрометаллургия. Металлотермия. Микробиологические методы получения металлов | Знать основные способы получения металлов в промышленности. Уметь характеризовать реакции восстановления металлов из их оксидов | Текущий кон-троль – опрос. СР по сборнику «Контрольные и проверочные работы. Химия-9» к учебнику О.С. Габриеляна, вариант 1, № 1 | § 9. с. 40, № 5, 6 | Л. Знакомство с образ-цами природных соединений натрия, кальция, алюминия, железа
|
|
|
| 14 | Общие по-нятия о коррозии металлов | 1 | Коррозия металлов, способы защиты металлов от коррозии | Знать причины и виды корро-зии металлов. Уметь обьяснять и применять доступные способы защиты от коррозии металлов в быту | Текущий кон-троль – опрос. Решение задач и упражнений из раздела «Металлы» | § 10, упр. 1-4.
| Ряд активности металлов. Образцы металлов и сплавов, подвергшихся коррозии |
|
|
| 15 | Щелочные металлы | 1 | Строение атомов эле-ментов главной под-группы первой группы. Щелочные металлы – простые вещества. Общие физические свойства щелочных ме- талов. Химические свойства щелочных металлов: взаимодейс-твие с простыми веществами, с водой. Природные соедине-ния, содержащие щелочные металлы, способы получения ме-таллов | Уметь: - характеризовать химические элементы натрий и калий по их положению в ПСХЭ Д.И. Менделеева и строению атомов; - составлять уравнения хими-ческих реакций (ОВР), характеризующих химические свойства натрия и калия | Текущий кон-троль – опрос. Для закрепления темы: тетрадь на печатной основе: с. 40, № 2, 5, 6; с. 44, № 2 (а-г) | § 11. с. 49 № 2-3 | Д. Образцы щелочных металлов. Д. Взаимодействие натрия с водой (вода, фенолфталеин, натрий). Схема «Натрий и калий в организме человека», «Натрий и калий в продуктах питания».
|
|
|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 |
| 16 | МЕТАЛЛЫ (16 часов) | Соединения щелочных металлов | 1 | Обзор важнейших соединений щелочных металлов: щелочи, соли (хлориды, карбонаты, сульфаты, нитраты). Природные соединения щелочных металлов | Знать применение соединений. Уметь характеризовать свойства важнейших соединений щелочных металлов | § 11, с. 48, упр. 1 |
| Л. Распознавание катионов натрия и калия по окраске пламени. CD «Виртуальная лаборатория» |
|
|
| 17 | Общая ха-рактерис-тика элементов главной подгруппы II группы | 1 | Строение атомов щелочноземельных металлов. Физические свойства. Химические свойства: взаимодействие с простыми веществами, с водой, с оксидами (магний, кальций – термия) | Уметь: - характеризовать химические элементы кальций и магний по положению в ПСХЭ Д.И. Менделеева и строению атомов; - составлять уравнения химических реакций (ОВР) | Текущий контроль -работа по сборнику «Контрольные и проверочные работы. Химия-9» к учебнику О.С. Габриеляна, работа по вариантам 1-2, № 1,2 | § 12. № 1-4 | Д. Образцы металлов: кальция, магния и их важнейших природных соединений. Д. Горение магния. Взаимодействие кальция с водой (вода, фенолфталеин, кальций, чашка Петри).
|
|
|
| 18 | Важнейшие соединения щелочно-земельных металлов | 1 | Важнейшие соединения: оксид кальция – негашеная известь, оксид магния- жженая магнезия, гидроксид кальция, соли (мел, мрамор, известняк, гипс, фосфаты и др.). Применение важней-ших соединений. Роль химических элементов кальция и магния в жизнедеятельности живых организмов | Знать важнейшие соединения щелочноземельных металлов. Уметь: - на основании знаний химических свойств важнейших соединений щелочноземельных металлов осуществлять цепочки превращений; - характеризовать свойства оксидов и гидроксидов щелочноземельных металлов | Тетрадь на печатной основе: с. 48, № 2, 5 (до характерис-тики реакций), 7; с. 52, № 3 | § 12. № 5-7
| Таблицы: «Магний и кальций в организме человека», «Магний и кальций в продуктах питания» |
|
|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 |
| 19 | МЕТАЛЛЫ (16 часов) | Алюминий | 1 | Строение атома алюминия. Физические, химиче-ские свойства алюми-ния: взаимодействие с простыми веществами, кислотами. Алюминотермия. Природные соединения алюминия и способы его получения. Области применения алюминия | Знать химические свойства. Уметь характеризовать химический элемент алюминий по его положению в ПСХЭ Д.И. Менделеева и строению атома | Текущий кон-троль. Работа по сборнику «Контрольные и проверочные работы. Химия-9» к учебнику О.С. Габриеляна, с. 155, вариант 4, № 1. | § 13. № 7 | Образцы алюминия (гранулы, пудра) и его природных соединений. Слайд-лекция, проектор, ноутбук. Таблица «Основные области применения алюминия и его сплавов». Д. Взаимодействие алюминия с кислотами (пробирки, гранулы алюминия, соляная кислота)
|
|
|
| 20 | Соединения алюминия | 1 | Соединения алюминия: амфотерность оксида и гидроксида. Важней-шие соли алюминия. Применение алюминия и его соединений | Знать природные соединения алюминия, применение алю-миния и его соединений. Уметь характеризовать свойства оксида и гидроксида алюминия | § 13, упр. 1, 3, 4, с. 62.
| § 13. № 6
| Л. Получение гидроксида алюминия и его взаимодействие с растворами кислот и щелочей |
|
|
| 21 | Железо, его строение, физические и химиче-ские свойства | 1 | Строение атома железа. Степени окисления железа. Физические, химические свойства железа: взаимодействие с простыми веществами, водой, кислотами, солями. Железо в природе, минералы железа | Уметь: - составлять схему строения атома; - записывать уравнения реакций химических свойств железа (ОВР) с образованием соединений с различными степенями окисления | Текущий кон-троль – опрос. СР по сбор-нику «Конт-рольные и про-верочные работы. Химия-9» к учебнику О.С. Габриеляна, с. 156, вариант 2, № 1.
| § 14. № 3,6,7 на с. 68 | Л. Знакомство с образ-цами руд и сплавов железа (коллекции). Растворение железа в соляной кислоте (пробирка, железные опилки, соляная кислота). Вытеснение одного металла другим из раствора соли (раствор медного купороса, железная скрепка или кнопка). |
|
|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 |
| 22 | МЕТАЛЛЫ (16 часов)
(18 часов) | Генетиче-ские ряды железа (II) и железа (III). Важнейшие соли железа | 1 | Соединения катионов железа: Fe2+ и Fe3+ Железо – основа современной техники. Понятие коррозии. Роль химического элемента железа в жизнедеятельности живых организмов | Знать химические свойства соединений железа (II) и (III). Уметь: - осуществлять цепочки превращений; - определять соединения. содержащие ионы Fe2+ и Fe3+ с помощью качественных реакций |
| § 14, упр 4, 5, 7, с. 68-82. Практическая работа 1, 2 | Д. Получение гидро-ксидов железа +2 и +3 и изучение их свойств (растворы солей железа +2 и +3, раствор гидроксида натрия, соляная или серная кислота, спиртовка, спички). Л. Качественные реакции на ионы железа +2 и +3 |
|
|
| 23 | Обобщение и система-тизация знаний по теме | 1 | Повторение ключевых моментов темы «Металлы». Физические и химические свойства металлов и их важнейших соединений | Знать - строение атомов металлических элементов; - физические и химические свойства; - применение металлов и их важнейших соединений. Уметь: - составлять уравнения реакций в молекулярной и ионной формах; - оъяснять ОВР металлов и их соединений
| Текущий кон-троль – опрос, выборочная проверка тетрадей с ДЗ | Повторить § 5-14. Тетрадь на печатной основе: с. 69, «Го-товимся к контроль-ной работе» | ПСХЭ. Ряд активности металлов. ДМ. Компьютерный тест «Металлы» |
|
|
| 24 | Контроль-ная рабо-та № 2. Металлы | 1 | Тематический контроль знаний |
| ДМ. «Контрольные и про-верочные работы. Химия-9 к учебнику О.С. Габриеляна
|
|
|
| 25 | Тема 2 ПРАКТИКУМ №1 СВОЙСТВА МЕТАЛЛОВ И ИХ СОЕДИНЕНИЙ (3 часа) | Практическая работа №1 Осуществление цепочки химических превращений металлов | 1 | Правила техники безо-пасности при выполнении данной работы. Объяснять результаты и записывать уравне- ния соответствующих реакций в молекулярной и ионной формах | Уметь: - обращаться с химической посудой и лабораторным оборудованием; - распознавать опытным путем соединения металлов;; - использовать приобретенные знания и умения в практической деятельности и повседневной жизни для безопасного обращения с веществами и материалами | Контроль знаний правил техники безо-пасности при выполнении данной работы | Повторе ние § 2-14 | Инструкции. Таблица растворимости. Химические реактивы. Химическая посуда. |
|
|
| 26 | Практическая работа №2 Получение и свойства соединений металлов | 1 | Правила техники безо-пасности при выполнении данной работы. Объяснять результаты и записывать уравне- ния соответствующих реакций в молекулярной и ионной формах | Уметь: - обращаться с химической посудой и лабораторным оборудованием; - распознавать опытным путем соединения металлов;; - использовать приобретенные знания и умения в практической деятельности и повседневной жизни для безопасного обращения с веществами и материалами
| Контроль знаний правил техники безо-пасности при выполнении данной работы | Повторе ние § 2-14 | Инструкции. Таблица растворимости. Химические реактивы. Химическая посуда. |
|
|
| 27 | Практическая работа №3 Решение экспериментальных задач на распознавание и получение веществ | 1 | Правила техники безо-пасности при выполнении данной работы. Объяснять результаты и записывать уравне- ния соответствующих реакций в молекулярной и ионной формах | Уметь: - обращаться с химической посудой и лабораторным оборудованием; - распознавать опытным путем соединения металлов;; - использовать приобретенные знания и умения в практической деятельности и повседневной жизни для безопасного обращения с веществами и материалами
| Контроль знаний правил техники безо-пасности при выполнении данной работы | Повторе ние § 2-14 | Инструкции. Таблица растворимости. Химические реактивы. Химическая посуда. |
|
|
| 28 | Тема 3 НЕМЕТАЛЛЫ (23 часа)
| Общая характеристика неметалловНеметаллы:атомы и простые вещества. Воздух. Кислород. Озон | 1 | Положение элементов-неметаллов в ПСХЭ Д.И. Менделеева, особенности строения их атомов. Свойства простых веществ неме-таллов. Электроотрицатель-ность как мера не-металличности, ряд электроотрицатель-ности. Кристаллическое строение неметаллов – простых веществ. Аллотропия, состав воздуха. Физические свойства неметаллов. Относительность понятий «металл» - «неметалл»
| Знать: - положение неметаллов в ПСХЭ Д.И. Менделеева; - строение атомов-неметаллов, физические свойства. Уметь: - характеризовать свойства неметаллов; - давать характеристику элементам-неметаллам на основе их положения в ПСХЭ; - сравнивать неметаллы с металлами | Текущий контроль: устный опрос, С.р. | § 15-16, № 1-4 | Д. Образцы неметалл-лов: водород, кислород, хлор в пробирках с пробками, бром (в ампуле), сера, йод, красный фосфор, активированный уголь. Л. Знакомство с образцами НеМе (коллекции). Таблица «Состав воздуха».
|
|
|
| 29 | Водород | 1 | Двойственное положение водорода в Периодической системе Д.И. Менделеева. Физические свойства водорода. Химические свойства водорода – окислительные и восстановительные. Применение водорода. Получение, собирание, распознавание водорода
| Уметь: - характеризовать химический элемент водород по его положению в ПСХЭ; - составлять уравнения реакций (ОВР) химических свойств водорода | Текущий кон-троль. Для закрепления: тетрадь на печатной основе: с. 76, № 1- устно; с. 78, № 4, 7 | § 17. № 2, 6 | Д. Получение, собирание и распознавание водорода (штатив, пробирка, прибор Кирюшкина, гранулы цинка, соляная кислота, спички).
|
|
|
| 30 | Галогены | 1
| Строение атомов гало-генов и их степени окисления. Физические свойства галогенов. Хи-мические свойства галогенов: взаимодействие с металлами, водородом, растворами солей и галогенов. Изменение окислительно-восстановительных свойств у галогенов от фтора к йоду
| Знать строение атомов галогенов, степени окисления, физические и химические свойства. Уметь: - составлять схемы строения атомов; - на основании строения атомов объяснять изменение свойств галогенов в группе; - записывать уравнения реакций с точки зрения ОВР
| Текущий контроль. Для закрепления темы: тетрадь на печатной основе: с. 79, № 1, 2,; с.80, № 4 | § 18, с. 89, № 1,
| Д. Образцы галогенов – простых веществ «Возгонка йода» «Взаимодействие алюминия с йодом» (смесь порошков алюминия и йода, фарфоровая чашка, пипетка, вода). Йодкрахмальная проба (крахмальный клейстер, спиртовая настойка йода) Образцы природных соединений хлора.
|
|
|
| 31 |
| Соединения галогенов | 1 | Галогеноводороды. Галогеноводородные кислоты: фтороводородная (плавиковая), хлороводородная (соляная). Бромоводородная, йодоводородная. Галогениды: фториды, хлориды, бромиды, йодиды. Качественные реакции на галогенид-ион. Природные соединения галогенов | Знать качественную реакцию на хлорид-ион. Уметь - характеризовать свойства важнейших соединений галогенов; - распознавать опытным путем раствор соляной кислоты среди других кислот | СР по сборнику «Контрольные и проверочные работы. Химия-9» к учебнику О.С. Габриеляна, с. 160, варианты 1, 3, № 1-3 | § 19, с. 95, № 3, 4.
| Л. Качественная реакция на хлорид-ион. Свойства соляной кислоты (магний, оксид магния, гидроксид натрия, лакмус, свежеприготовленный гидроксид меди (II), карбонат натрия)
|
|
|
| 32
|
| Получение галогенов. Биологиче-ское значение и применение галогенов и их соединений
| 1
| Получение галогенов электролизом расплавов или растворов солей. Биологическое значение галогенов. Применение галогенов и их соединений
| Знать способы получения галогенов. Уметь вычислять количество вещества, объем или массу по количеству вещества, объему или массе реагентов или продуктов реакции. Иметь навыки: -осуществления цепочек превращений; - составления различных уравнений реакций
| Текущий кон-троль | § 20. с. 102, № 4, 5 | Образцы изделий с тефлоном, фторсодержащие зубные пасты, хлор- и бромсодержащие материалы и лекарства
|
|
|
| 33 | НЕМЕТАЛЛЫ (23 часа) | Кислород | 1 | Кислород в природе. Химические свойства кислорода: взаимодействие с простыми веществами (металлами и неметаллами), сложными веществами. Горение и медленное окисление. Дыхание и фотосинтез. Получение кислорода. Применение кислорода | Знать: - способы получения кислорода; - значение кислорода в атмосфере и в жизнедеятельности человека. Уметь записывать уравнения реакций кислорода с простыми и сложными веществами | Текущий контроль – опрос. По учебнику: с. 110, № 1, 2, 4 | § 21. № 8 | Знакомство с образцами природных оксидов, солей кислородсодержащих кислот. Таблицы: «Фотосинтез», «Газообмен в легких и тканях», «Круговорот кислорода в природе». Слайд-лекция «Кислород», проектор, ноутбук. Д. Получение кислорода и и его взаимодействие с простыми веществами
|
|
|
| 34 | Сера, ее физические и химические свойства | 1 | Строение атомов серы и степени окисления серы. Аллотропия серы. Химические свойства серы: взаимодействие с металлами, кислородом. Демеркуризация. Сера в природе: самородная, сульфидная и сульфатная. Биологическое значение серы. Применение серы. Сероводород и сульфиды.Сернистый газ, сернистая кислота, сульфиты
| Уметь: - характеризовать химический элемент по положению в ПСХЭ Д.И. Менделеева и строению атома; - записывать уравнения реакции серы с металлами, кислородом и другими неметаллами | Текущий контроль. СР (2-3 человека): по сборнику «Контрольные и проверочные работы. Химия-9» к учебнику О.С. Габриеляна, с. 161, варианты 1, 2, № 2, 3 | § 22, 23. №1-3 с. 125 | Д. Взаимодействие серы с металлами и кислородом. (Взаимодействие серы с металлами (натрий, сера, фарфоровая ступка, пестик)) Образцы природных соединений серы.
|
|
|
| 35 | НЕМЕТАЛЛЫ (23 часа) | Оксиды серы (IV) и (VI) | 1 | Получение и свойства оксидов серы (IV) и (VI). Характеристика реакции получения оксда серы (VI) из оксида серы (IV) и рассмотрение условий смещения равновесия вправо | Знать: - свойства оксидов серы в свете представлений ТЭД; Уметь записывать уравнения реакций в ионном виде и с точки зрения ОВР | Текущий кон-троль – опрос.
| § 23,
№ 3, 8.
| Д. Получение оксида серы (IV) горением серы и взаимодействие с водой, и щелочью. |
|
|
| 36 | Серная кислота и ее соли. Окисли-тельные свойства серной кислоты | 1 | Серная кислота разбавленная и концентрированная. Применение серной кислоты. Соли серной кислоты: глауберова соль, гипс, сульфат бария, медный купорос. Производство серной кислоты. Качественная реакция на сульфат-ион | Знать: - свойства серной кислоты в свете представлений ТЭД; - окислительные свойства концентрированной серной кислоты в свете ОВР; - качественную реакцию на сульфат-ион. Уметь записывать уравнения реакций в ионном виде и с точки зрения ОВР | Текущий кон-троль – опрос.
| § 23, № 3, 8.
| Д. Взаимодействие разбавленной серной кислоты с металлами, оксидами металлов, растворимыми и нерас-творимыми гидрок-сидами металлов (гранулы цинка, алюминия, железные стружки, оксид магния, раствор гидроксида натрия+лакмус, свежеприготовленный гидроксид железа (III), разбавленная серная кислота). Свойства концентрированной серной кислоты (обугливание бумаги и сахарной пудры). Л. Распознавание сульфат-иона (раствор сульфата натрия, нитрата бария). Таблица «Применение серной кислоты» |
|
|
| 37 | НЕМЕТАЛЛЫ (23 часа) | Азот и его свойства | 1 | Строение атомов и мо- лекул азота. Свойства азота. Взаимодействие с металлами, водоро-дом и кислородом. По-лучение азота из жидкого воздуха. Азот в природе и его биологическое значение
| Знать круговорот азота в природе (корни культурных и бобовых растений с клубеньками). Уметь писать уравнения реакций в свете представлений об ОВР |
| § 24 упр. 2-4 | Получение азота (кристаллические бихромат аммония, нитрит натрия, спирт, ступка с пестиком , фарфоровая чашечка, пробирка, спички). Таблица «Круговорот азота в природе» |
|
|
| 38 | Аммиак и его свойства | 1 | Строение молекулы аммиака. Свойства аммиака: взаимодействие с водой, кислотами, кислородом. Донорно-акцепторный механизм образования связи в ионе аммония. Полу-чение, собирание и распознавание аммиака | Знать: - строение молекулы аммиака; - донорно-акцепторный механизм образования связи в ионе аммония; - свойства аммиака: взаимодействие с водой, кислотами, кислородом; - способы получения, собирания и распознавания аммиака. Уметь описывать свойства аммиака с точки зрения ОВР и его физиологическое воздействие на организм
| Текущий кон-троль – опрос. Для закрепления темы: тетрадь на печатной основе: с. 104, № 1 (кроме химических свойств), 4, 5, 6, 7, 9 (устно) | § 25, упр. 1-4
| Д. Получение, собирание и распознавание аммиака (гидроксид кальция и хлорид аммония, газоотводная трубка, штатив, спиртовка, спички, влажная индикаторная лакмусовая бумага, стеклянная палочка). Таблица «Применение аммиака» |
|
|
| 39 | Соли аммония | 1 | Свойство солей аммония, обусловленные ионом аммония и различными анионами. Разложение солей аммония. Хлорид, нитрат, карбонат аммония и их применение | Знать строение, свойства и применение солей аммония. Уметь распознавать ион аммония | Текущий контроль – опрос, работа по карточкам. Проверочная работа по сборнику «Контрольные и проверочные работы. Химия-9» к учебнику О.С. Габриеляна
| § 26, № 2-4
| Д. Получение солей аммония. Л. Распознавание солей аммония (растворы солей аммония и гидроксида натрия, спиртовка, спички, влажная лакмусовая бумага) |
|
|
| 40-41 | Кислород-ные соединения азота. Азотная и азотистая кислоты и их соли. Окисли-тельные свойства азотной кислоты | 2 | Несолеобразующие кислотные оксиды азота. Оксид азота (IV). Свойства азотной кислоты как электролита и как окислителя. Взаимодействие концентрированной и разбавленной кислоты с медью. Применение азотной кислоты. Нитраты, селитры | Знать свойства кислородных соединений азота. Уметь писать уравнения реакций, доказывающих их свойства с точки зрения ОВР. Знать свойства азотной кислоты как окислителя. Уметь писать реакции взаимодействия концентрированной и разбавленной азотной кислоты с металлами | Текущий контроль – опрос. Самостоятель-ная работа по ДМ. | § 27, с. 148, № 2, 4, 5.
| Ряд активности металлов. Д. Получение оксида азота NO2 и его взаимодействие с водой. Медь, оксид меди (II), азотная кислота концентрированная, вода, УИ бумага. Взаимодействие азотной кислоты с основаниями, основными оксидами, солями. (Растворы азотной кислоты, гидроксида натрия, мрамор свежеприготовленный, гидроксид меди (II). Образцы азотных удобрений
|
|
|
| 42-43 | НЕМЕТАЛЛЫ (23 часа)
| Фосфор и его соединения | 2 | Аллотропия фосфора: белый фосфор, красный фосфор. Свойства фосфора: образование фосфидов, оксида фосфора (V). Фосфорная кислота и три ряда ее солей: фосфаты, гидрофосфаты и дигидрофосфаты. Биологическое значение фосфора (фосфт кальция, АТФ, ДНК и РНК). Применение фосфора и его соединений | Знать: - строение атома, аллотропные видоизменения, свойства и применение; - применение фосфора. Уметь писать уравнения реакций образования фосфидов, фосфина, оксида фосфора (V), свойств фосфорной кислоты | Текущий контроль – опрос. Самостоятель-ная работа (2-3 человека): по сборнику «Контрольные и проверочные работы. Химия-9» к учебнику О.С. Габриеляна, с. 165, варианты 1, 3, задание 1 | § 28, с. 153, № 1, 2 | Горение фосфора, образование фосфорной кислоты. (Красный фосфор, ложечка для сжигания веществ, вода, лакмус, колба, спички, химический стакан). Взаимодействие фосфорной кислоты со щелочами и солями. Растворы фосфорной кислоты, гидроксида натрия, нитрата серебра, УИ бумага. Таблица «Круговорот фосфора в природе»
|
|
|
| 44 | Углерод | 1 | Строение атома и степень окисления углерода. Аллотропия углерода: алмаз и графит. Древесный активированный уголь. Адсорбция и ее применение. Химические свойства углерода. Взаимодействие с кислородом, металлами, водородом, с оксидами металлов. Карбиды кальция и алюминия. Ацетилен и метан. Ацетилен и метан. Круговорот углерода в природе
| Знать и уметь характе-ризовать свойства углерода. Уметь составлять схемы строения атома | Текущий кон-троль – опрос. | § 29. № 1, 4 (устно), 5, 8 |
Модели кристаллических решеток алмаза и графита. Адсорбция (древесный уголь, таблетки карболена, растворы чернил, сока свеклы, вишневого компота, одеколон. Д. Поглощение углем растворенных веществ или газов. Восстановление меди из ее оксида углем. |
|
|
| 45-46 | Кислород-ные соединения углерода | 2 | Оксид углерода (II) или угарный газ: полу-чение, свойства, приме-нение. Оксид углерода (IV) или углекислый газ. Получение, свойства, применение. Угольная кислота и ее соли: карбонаты и гидрокарбонаты. превращение карбонатов в гидрокарбонаты и обратно. Понятие жест-кости воды и способы ее устранения. Качественная реакция на соли угольной кислоты | Знать качественные реакции на углекислый газ и карбонаты. Уметь писать уравнения реакций, отражающие свойства оксидов углерода. Знать физиологическое действие на организм угарного газа. Уметь оказывать первую помощь при отравлении | Текущий кон-троль – опрос. | § 30, № 5, 6.
| Л. Получение, собирание и распознавание углекислого газа. (Мрамор, соляная кислота, стаканы, свечи, известковая вода.) Модель, имитирующая огнетушитель, и объясняющая принцип его работы. Л. Качественная реакция на карбонат – ион. (Образцы карбонатов, соляная кислота, пробирки с газоотводными трубками, известковая вода.)
|
|
|
| 47 | Кремний и его соединения | 1 | Природные соединения кремния: кремнезем, кварц, силикаты, алюмосиликаты, асбест. Биологическое значение кремния. Свойства кремния: полупроводниковые, взаимодействие с кислородом, металлами, щелочами. Оксид кремния (IV): его строение и свойства. Кремневая кислота и ее соли. Растворимое стекло. Применение кремния и его соединений.
| Знать свойства, значение соединений кремния в живой и неживой природе. Уметь составлять формулы соединений кремния, уравнения реакций, иллюстрирующие свойства кремния и силикатов | Карточки-задания | §31, № 1, 2.
| Л. Знакомство с образцами природных соединений неметалла – кремния. Д. Получение кремниевой кислоты. (Силикат натрия, соляная кислота, пробирка.) Образцы изделий из фарфора различных марок, фаянса, стекла. Иллюстрации витражей |
|
|
| НЕМЕТАЛЛЫ (23 часа) |
| 48 | Силикатная промышленность | 1 | Производство стекла, фарфора, цемента. Их применение в народном хозяйстве. | Знать особенности производства стекла, фарфора, цемента Уметь составлять уравнения химических реакции, происходящих при производстве силикатных изделий | Тематический контроль | § 31 | Л. Ознакомление с продукцией силикатной промышленности |
|
|
| 49 | НЕМЕТАЛЛЫ (23 часа) | Обобщение и система-тизация знаний по теме «Неметал-лы» | 1 | Обобщение, система-тизация и коррекция знаний, умений и навыков учащихся по теме «Неметаллы» | Уметь: - писать уравнения химических реакций в молекулярном и ионном виде; - производить вычисления массы и объемов продуктов реакции с определенной долей выхода | Тематический контроль, фронтальный опрос, работа по карточкам (2-3 человека). Работа по ДМ | Повторить § 15-30 | ДМ. ПСХЭ. Ряд активности металлов. Таблица растворимости |
|
|
| 50 | Контроль-ная работа № 3. Неметаллы | 1 | Контроль знаний, умений и навыков | Знать строение и свойства изученных веществ. Уметь выполнять упражнения и решать задачи |
| Повторить § 15-30, П.2 10,р. № 4 | Сборник «Контрольные и проверочные работы. Химия-9» к учебнику О.С. Габриеляна, с. 120 |
|
|
| 51 | Тема 4 ПРАКТИКУМ №2 СВОЙСТВА НЕМЕТАЛЛОВ И ИХ СОЕДИНЕНИЙ (3 часа) | Практическая работа №4 Решение экспериментальных задач по теме «Подгруппа кислорода» | 1 | Правила техники безопасности при выполнении данной работы. Технологическая схема работы. Способы собирания газов | Уметь: - обращаться с химической посудой и лабораторным оборудованием; - получать и собирать газы: водород, кислород, аммиак, углекислый; - распознавать опытным путем кислород, водород, углекислый газ и аммиак | Текущий контроль –опрос по правилам ТБ | П.р. № 5 | Инструкции. Химические реактивы. Химическая посуда |
|
|
| 52 | Практическая работа №5 Решение экспериментальных задач по теме «Подгруппа азота и углерода» | 1 | Правила техники безопасности при выполнении данной работы. Технологическая схема работы. Способы собирания газов | Уметь: - обращаться с химической посудой и лабораторным оборудованием; - получать и собирать газы: водород, кислород, аммиак, углекислый; - распознавать опытным путем кислород, водород, углекислый газ и аммиак | Текущий контроль –опрос по правилам ТБ | П.р. № 6 | Инструкции. Химические реактивы. Химическая посуда |
|
|
| 53 | Практическая работа №6 Получение, собирание и распознавание газов | 1 | Правила техники безопасности при выполнении данной работы. Технологическая схема работы. Способы собирания газов | Уметь: - обращаться с химической посудой и лабораторным оборудованием; - получать и собирать газы: водород, кислород, аммиак, углекислый; - распознавать опытным путем кислород, водород, углекислый газ и аммиак | Текущий контроль –опрос по правилам ТБ |
| Инструкции. Химические реактивы. Химическая посуда |
|
|
| 54 | Тема 5 ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ (11 часов) | Предмет органичес-кой химии. Особеннос-ти органи-ческих веществ | 1 | Первоначальные сведения о строении органических веществ. Теория витализма. Ученые, работы которых опровергли теорию витализма. Понятие об изомерии и гомологическом ряде | Знать: - особенности органических соединений; - валентность и степень окисления элементов в соединениях. Уметь определять изомеры и гомологи | Текущий опрос. | § 32, № 1, 2, 6 | Л. Изготовление моделей молекул УВ (метана и других УВ). Портреты Бутлерова, Велера |
|
|
| 55 | Предель-ные углеводо-роды. Алканы | 1 | Строение алканов. Номенклатура алканов. Углеводороды: метан, этан, особенности физических и химических свойств | Знать понятия: предельные углеводороды, гомологический ряд предельных углеводородов, изомерия. Уметь: - записывать структурные формулы изомеров и гомологов; - давать названия изученным веществам | Текущий опрос и индивидуаль-ная работа по карточкам. | § 33. с. 195 №2-4 | Д. Образцы нефти, каменного угля и продуктов их переработки, горение углеводородов и обнаружение продуктов их горения.
|
|
|
| 56 | Непредель-ные углеводо-роды. Алкены. Этилен и его гомологи | 1 | Непредельные углево-дороды: этилен. Химическое строение молекулы этилена. Двойная связь. Взаимодействие этилена с водой. Полимеризация. Полиэтилен и его значение | Уметь: - называть изученные вещества; - характеризовать химические свойства органических соединений | Текущий оп-рос и индивидуаль-ная работа по карточкам.
| § 34. с. 199 № 3-5 | Д. Образцы изделий из полиэтилена, качественные реакции на этилен (взаимодействие этилена с бромной водой и раствором перманганата калия)
|
|
|
| 57 | Спирты | 1 | Спирты и их атомность. Метанол, этанол, этиленгликоль, глицерин – важнейшие представители класса спиртов, их строение и свойства. Понятие о карбонильной группе
| Уметь описывать свойства и физиологическое действие на организм этилового спирта | Текущий опрос. | § 35, с. 206, № 4, 5. | Д. Образцы спиртов (этанол, глицерин). Качественная реакция на многоатомные спирты Л. Свойства глицерина
|
|
|
| 58 | Тема 5 ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ (11 часов) | Предель-ные одно-основные карбоновые кислоты. Сложные эфиры | 1 | Карбоксильная группа и общая формула пре-дельных одноосновных карбоновых кислот. Муравьиная и уксусная кислоты – важнейшие представители класса предельных однооснов-ных карбоновых кислот, их строение и свойства | Знать реакцию этерификации и формулы сложных эфиров. Уметь характеризовать типичные свойства уксусной | Текущий опрос и индивидуаль-ная работа по карточкам. | § 36. с. 214, № 2-4 | Д. Образцы кислот (муравьиной, уксусной, стеариновой). Лакмус, гранулы цинка, раствор гидроксида натрия, оксид магния, свежеприготовленный гидроксид меди (II). ДМ Д. Получение уксусно-этилового эфира |
|
|
| 59 | Жиры | 1 | Предельные и непре-дельные жирные кислоты. Жиры как сложные эфиры. Растительные и животные жиры, их применение. Понятие о мылах, синтетических моющих средствах | Иметь представление о биологически важных органических веществах: жирах как сложных эфирах глицерина и жирных кислот | Текущий опрос. | § 36. Самостоя-тельный поиск химичес-кой инфор-мации с использо-ванием различных источни-ков | Д. Образцы жиров. Таблицы Д. Омыление жира. |
|
|
| 60 | Аминокис-лоты. Белки | 1 | Аминокислоты. Получение и свойства. Биологическая роль аминокислот. Пептидная связь и полипептиды. Уровни организации структуры белка. Свойства белков и их биологические функции. Качественные реакции | Иметь первоначальные сведения о белках и аминокислотах, их роли в живом организме | Фронтальный опрос. | § 38. с 219 № 1-3 | Д. Качественные реакции на белки. Д. Доказательство наличия функциональных групп в растворах аминокислот. Горение белков.
|
|
|
| 61 | Тема 5 ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ (11 часов) | Углеводы | 1 | Углеводы: моносахари-ды, дисахариды, поли-сахариды. Глюкоза и фруктоза. Сахароза. Крахмал. Целлюлоза | Иметь первоначальные представления: - о строении углеводов; - глюкозе, ее свойствах и значении | Текущий опрос | § 39. с. 225 № 2-4 | Д. Глюкоза, сахароза, крахмал, целлюлоза (вата). Взаимодействие глюкозы с аммиачным раствором оксида серебра. Качественная реакция на крахмал. Л. Взаимодействие глюкозы с гидроксидом меди (II) без нагревания и при нагревании. Взаимодействие крахмала с иодом. |
|
|
| 62 | Полимеры | 1 | Основные понятия химии ВМС: полимер, мономер, структурное звено, степень полимеризации, средняя молекулярная масса полимера. Краткий обзор важнейших полимеров | Иметь первоначальные сведения о полимерах на примере полиэтилена | Текущий опрос | § 40. с. 231 № 4-6 | Демонстрация: образцы изделий из полиэтилена. Коллекция «Пластмассы», Слайд-лекция, проектор, ноутбук |
|
|
| 63 | Обобщение и система-тизация знаний по теме «Органиче-ские соедине-ния» | 1 | Отработка теоретического материала в рамках данной темы
| Знать формулы метана и его ближайших гомологов, этилена и его ближайших гомологов. Уметь: - писать уравнения реакций органических веществ, решать, простейшие цепочки превращений; - вычислять массы, объемы, количества по формулам органических соединений и уравнениям реакций
| Текущий опрос
| Повторе-ние гл. 5, задания по тетради | ДМ. Задачники. Электронный тест |
|
|
| 64 |
| Контроль ная работа № 4 по теме «Органические соедине ния» | 1 | Тематический контроль знаний | Знать формулы метана и его ближайших гомологов, этилена и его ближайших гомологов. Уметь: - писать уравнения реакций органических веществ, решать, простейшие цепочки превращений; - вычислять массы, объемы, количества по формулам органических соединений и уравнениям реакций |
| Повторе-ние гл. 5, задания по тетради |
|
|
|
| 65 | Тема 6 ПОВТОРЕНИЕ ОСНОВНЫХ ВОПРОСОВ КУРСА 9 КЛАССА (4 часа) | Периодический закон и Периодическая система химических элементов Д.И. Менделеева в свете учения о строении атома.
| 1 | Физический смысл порядкового номера и группы, закономерности изменения свойств элементов и их соединений в периодах и группах в свете представлений о строении атомов элементов. Значение Периодического закона. Виды химических связей и типы кристаллических решеток.
| Знать важнейшие химические понятия: химический элемент, атом,молекула, относитель- ные атомная и молекулярная массы. Уметь: - объяснять физический смысл атомного порядкового номера химического элемента, номеров группы, периода, к которым элемент принадлежит в Периодической системе Д.И. Менделеева; закономерности изменения свойств элементов в пределах малых периодов и малых подгрупп;; - характеризовать химический элемент (от водорода до кальция) на основе их положения в ПСХЭ и т.д. | тестовый контроль | задания в тетради |
|
|
|
| 66 | Типы химических связей и кристалли ческих решеток
| 1 | Виды химических связей и типы кристаллических решеток.
| Знать типы химических связей и типы кристаллических решеток. Взаимосвязь строения и свойств веществ Уметь записывать схемы образования веществ с различными хим. связями | тестовый контроль | задания в тетради |
|
|
|
| 67 | Классификация химических реакций | 1 | Классификация химических реакций по различным признакам (число и состав реагирующих веществ и образующихся; тепловой эффект; использование катализатора; направление; изменение степеней окисления атомов) | Знать классификацию химических реакций по различным признакам | тестовый контроль | задания в тетради |
|
|
|
| 68 | Простые и сложные вещества | 1 | Простые и сложные вещества. Металлы и неметаллы. Генетические ряды металла, неметалла и переходного металла. Оксиды, гидроксиды и соли: состав, классификация и общие химические свойства в свете теории электролитической диссоциации и представлений о процессах окисления-восстановления | Знать состав, классификацию, общие химические свойства простых и сложных веществ Уметь записывать формулы основных классов неорганических соединений по названиям и наоборот; записывать уравнения химических реакций, характерных для оксидов, гидроксидов и солей в свете ТЭД И ОВР | тестовый контроль |
|
|
|
|
1. Химия. 9 класс: учебник для общеобразовательных учреждений/ О.С. Габриелян. – М.: Дрофа, 2013.
2. Химия. 9 класс: Настольная книга учителя. Текст/ О.С. Габриелян - М.: Дрофа, 2006.
3. Химия. 8-9 классы: Методическое пособие. – 4-е изд., стереотип./ О.С. Габриелян – М.: Дрофа, 2006.
4. Химия. 9 класс: Контрольные и проверочные работы к учебнику О.С. Габриеляна «Химия. 9»/ О.С. Габриелян, П.Н. Березкин,
А.А. Ушакова и др. – 2-е изд., стереотип. – М.: Дрофа, 2004.
5. Сборник задач и упражнений по химии: 9-й кл.: к учебнику О.С. Габриеляна «Химия. 9 класс»/ Е.В. Савинкина, Н.Д. Свердлова. –
М.: Экзамен, 2006.
6. Химия. 9 кл.: тетрадь для лабораторных опытов и практических работ к учебнику О.С. Габриеляна «Химия. 9 класс»/ О.С. Габриелян,
А.В. Яшукова - М.: Дрофа, 2011.
7. Контрольно-измерительные материалы. Химия: 9 класс/ Сост. Н.П. Троегубова. – М.: ВАКО, 2012.
8. Тесты по основным разделам школьного курса химии: 8-9 классы./ С.В. Горбунцова – М.: «ВАКО», 2006.
9. Химия. 9 класс. Поурочные разработки к учебникам О.С. Габриеляна и др. / М.Ю. Горковенко – М.: «ВАКО», 2006

 Получите свидетельство
Получите свидетельство Вход
Вход


 униципальное бюджетное общеобразовательное учреждение
униципальное бюджетное общеобразовательное учреждение








 Рабочая программа по химии (9 класс) (0.34 MB)
Рабочая программа по химии (9 класс) (0.34 MB)
 0
0 842
842 126
126 Нравится
0
Нравится
0




