«Рассмотрено» «Согласовано» «Утверждено»
Руководитель НМС заместитель директора по УВР директор
________/ Мартышкина И.В / МБОУ «Лицей №4» МБОУ «Лицей №4»
Протокол №____ от __________/_Старостина Н.Н. ___________/Дуденкова Т.В.
«_____» августа 2013г. «_____» августа 20__г приказ № ___
от «___» августа 2013г
РАБОЧАЯ ПРОГРАММА
ХИМИЯ
Основная ступень, базовый уровень
Баймашкина Татьяна Александровна, высшая квалификационная категория
Муниципальное бюджетное общеобразовательное учреждение
«Лицей №4»
Рузаевского муниципального района Республики Мордовия
Класс: 11 КЛАСС
на 2013-2014 учебный год
Составлена на основе: Рабочая программа составлена на основе Примерной программы основного общего образования по химии,
Москва, Просвещение, 2010
Учебник: Г.Е. Рудзитис, Ф.Г. Фельдман «Химия -11»
ПРОГРАММА
СРЕДНЕГО (ПОЛНОГО) ОБЩЕГО ОБРАЗОВАНИЯ
ПО ХИМИИ (БАЗОВЫЙ УРОВЕНЬ)
ПОЯСНИТЕЛЬНАЯ ЗАПИСКА
Статус документа
Программа по химии составлена на основе федерального компонента государственного стандарта среднего (полного) общего образования.
Программа конкретизирует содержание предметных тем образовательного стандарта, дает примерное распределение учебных часов по разделам курса и рекомендуемую последовательность изучения тем и разделов учебного предмета с учетом межпредметных и внутрипредметных связей, логики учебного процесса, возрастных особенностей учащихся. В программе определен перечень демонстраций, лабораторных опытов, практических занятий и расчетных задач.
Программа выполняет две основные функции:
Информационно-методическая функция позволяет всем участникам образовательного процесса получить представление о целях, содержании, общей стратегии обучения, воспитания и развития учащихся средствами данного учебного предмета.
Организационно-планирующая функция предусматривает выделение этапов обучения, структурирование учебного материала, определение его количественных и качественных характеристик на каждом из этапов, в том числе для содержательного наполнения промежуточной аттестации учащихся.
Программа является ориентиром для составления авторских учебных программ и учебников. Программа определяет инвариантную (обязательную) часть учебного курса химии в старшей школе на базовом уровне, за пределами которого остается возможность авторского выбора вариативной составляющей содержания образования. Составители учебных программ и учебников химии могут предложить собственный подход в части структурирования и определения последовательности изучения учебного материала, а также путей формирования системы знаний, умений и способов деятельности, развития и социализации учащихся. Тем самым программа содействует сохранению единого образовательного пространства и предоставляет широкие возможности для реализации различных подходов к построению курса химии в старшей школе на базовом уровне.
Структура документа
Программа включает три раздела: пояснительную записку; основное содержание с примерным (в модальности «не менее») распределением учебных часов по разделам курса и возможную последовательность изучения тем и разделов; требования к уровню подготовки выпускников средней (полной) школы по химии на базовом уровне. В программе представлено минимальное по объему, но функционально полное содержание.
Общая характеристика учебного предмета
Основными проблемами химии являются изучение состава и строения веществ, зависимости их свойств от строения, конструирование веществ с заданными свойствами, исследование закономерностей химических превращений и путей управления ими в целях получения веществ, материалов, энергии. Поэтому, как бы ни различались авторские программы и учебники по глубине трактовки изучаемых вопросов, их учебное содержание должно базироваться на содержании программы, которое структурировано по пяти блокам: Методы познания в химии; Теоретические основы химии; Неорганическая химия; Органическая химия; Химия и жизнь. Содержание этих учебных блоков в авторских программах может структурироваться по темам и детализироваться с учетом авторских концепций, но должно быть направлено на достижение целей химического образования в старшей школе.
Цели
Изучение химии в старшей школе на базовом уровне направлено на достижение следующих целей:
освоение знаний о химической составляющей естественно-научной картины мира, важнейших химических понятиях, законах и теориях;
овладение умениями применять полученные знания для объяснения разнообразных химических явлений и свойств веществ, оценки роли химии в развитии современных технологий и получении новых материалов;
развитие познавательных интересов и интеллектуальных способностей в процессе самостоятельного приобретения химических знаний с использованием различных источников информации, в том числе компьютерных;
воспитание убежденности в позитивной роли химии в жизни современного общества, необходимости химически грамотного отношения к своему здоровью и окружающей среде;
применение полученных знаний и умений для безопасного использования веществ и материалов в быту, сельском хозяйстве и на производстве, решения практических задач в повседневной жизни, предупреждения явлений, наносящих вред здоровью человека и окружающей среде.
Место предмета в базисном учебном плане
Федеральный базисный учебный план для образовательных учреждений Российской Федерации отводит 68 часов для обязательного изучения учебного предмета «Химия» на этапе среднего (полного) общего образования на базовом уровне.
Программа рассчитана на 68 учебных часов. Данная рабочая программа составлена на основе программы общеобразовательных учреждений по химии для 8-11 классов и скорректирована на основе многолетнего опыта работы учителя, поэтому внесены некоторые изменения:
глава IV «Химические реакции» - учебник предлагает лабораторную работу «влияние различных факторов на скорость химических реакций», а программа предусматривает эту работу в виде демонстрационного опыта;
- лабораторную работу «проведение реакций ионного обмена для характеристики свойств веществ» - учебник не предусматривает, но она включена согласно программе;
- лабораторные работы «определение реакции среды универсальным индикатором» и «гидролиз солей» включены согласно теории, хотя данные лабораторные работы не предусматривает программа.
2. глава «Металлы» - лабораторные работы «взаимодействие цинка и железа с растворами кислот и щелочей» и «знакомство с образцами металлов и их рудами (работа с коллекциями)» - учебник не предусматривает, но они включены согласно программе.
3. глава «Неметаллы» - лабораторные работы «знакомство с образцами неметаллов и их природными соединениями (работа с коллекциями)» и «распознавание хлоридов, карбонатов и сульфатов» - учебник не предусматривает, но они включены согласно программе.
Общеучебные умения, навыки и способы деятельности
Программа предусматривает формирование у учащихся общеучебных умений и навыков, универсальных способов деятельности и ключевых компетенций. В этом направлении приоритетами для учебного предмета «Химия» в старшей школе на базовом уровне являются: умение самостоятельно и мотивированно организовывать свою познавательную деятельность (от постановки цели до получения и оценки результата); использование элементов причинно-следственного и структурно-функционального анализа; определение сущностных характеристик изучаемого объекта; умение развернуто обосновывать суждения, давать определения, приводить доказательства; оценивание и корректировка своего поведения в окружающей среде, выполнение в практической деятельности и в повседневной жизни экологических требований; использование мультимедийных ресурсов и компьютерных технологий для обработки, передачи, систематизации информации, создания баз данных, презентации результатов познавательной и практической деятельности.
Результаты обучения
Результаты изучения курса «Химия» приведены в разделе «Требования к уровню подготовки выпускников», который полностью соответствует стандарту. Требования направлены на реализацию деятельностного, практикоориентированного и личностно ориентированного подходов; освоение учащимися интеллектуальной и практической деятельности; овладение знаниями и умениями, востребованными в повседневной жизни, позволяющими ориентироваться в окружающем мире, значимыми для сохранения окружающей среды и собственного здоровья.
Рубрика «Знать/понимать» включает требования к учебному материалу, который усваиваются и воспроизводятся учащимися.
Рубрика «Уметь» включает требования, основанные на более сложных видах деятельности, в том числе творческой: объяснять, изучать, распознавать и описывать, выявлять, сравнивать, определять, анализировать и оценивать, проводить самостоятельный поиск необходимой информации и т.д.
В рубрике «Использовать приобретенные знания и умения в практической деятельности и повседневной жизни» представлены требования, выходящие за рамки учебного процесса и нацеленные на решение разнообразных жизненных задач.
ОСНОВНОЕ СОДЕРЖАНИЕ ( 68 ч.)
МЕТОДЫ ПОЗНАНИЯ В ХИМИИ (2 ч.)
Научные методы познания веществ и химических явлений. Роль эксперимента и теории в химии. Моделирование химических процессов.
Демонстрации
Анализ и синтез химических веществ.
ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ХИМИИ
Важнейшие химические понятия и законы (3ч.).
Атом. Изотопы. Химический элемент. Закон сохранения массы веществ, закон превращения энергии при химических реакциях, закон постоянства состава.
Периодический закон и периодическая система химических элементов Д.И.Менделеева с точки зрения строения атома (4ч.).
Атомные орбитали. Электронная классификация элементов (s-, p- элементы). Особенности строения электронных оболочек атомов переходных элементов.
Периодический закон и периодическая система химических элементов Д.И.Менделеева, их мировоззренческое и научное значение.
Расчётные задачи. Вычисление массы, объёма, количества вещества одного из вступивших в реакцию или получившихся в результате реакции.
Строение вещества (8ч.)
Ковалентная связь, ее разновидности и механизмы образования. Степень окисления и валентность химических элементов. Ионная связь. Катионы и анионы. Металлическая связь. Водородная связь, ее роль в формировании структур биополимеров. Единая природа химических связей.
Качественный и количественный состав вещества. Вещества молекулярного и немолекулярного строения. Кристаллические решетки.
Причины многообразия веществ: изомерия, гомология, аллотропия.
Чистые вещества и смеси. Способы разделения смесей и их использование. Явления, происходящие при растворении веществ – разрушение кристаллической решетки, диффузия, диссоциация, гидратация.
Истинные растворы. Способы выражения концентрации растворов: массовая доля растворенного вещества. Диссоциация электролитов в водных растворах. Сильные и слабые электролиты.
Понятие о коллоидах и их значение (золи, гели).
Расчётные задачи. Вычисление массы, объёма, количества вещества продуктов реакции, если для его получения дан раствор с определённой массовой долей исходного вещества.
Практическая работа. Приготовление растворов с заданной молярной концентрацией.
Химические реакции (13ч.)
Классификация химических реакций в неорганической и органической химии по различным признакам. Особенности реакций в органической химии.
Реакции ионного обмена в водных растворах. Гидролиз неорганических и органических соединений. Среда водных растворов: кислая, нейтральная, щелочная. Водородный показатель (рН) раствора.
Тепловой эффект химической реакции.
Окислительно-восстановительные реакции. Электролиз растворов и расплавов. Практическое применение электролиза.
Скорость реакции, ее зависимость от различных факторов. Катализаторы и катализ. Представление о ферментах, как биологических катализаторах белковой природы.
Обратимость реакций. Химическое равновесие и способы его смещения.
Демонстрации. Модели ионных, атомных, молекулярных и металлических кристаллических решеток.
Модели молекул изомеров и гомологов.
Получение аллотропных модификаций серы и фосфора.
Растворение окрашенных веществ в воде (сульфата меди (II), перманганата калия, хлорида железа (III)).
Зависимость скорости реакции от концентрации и температуры.
Разложение пероксида водорода в присутствии катализатора (оксида марганца (IV) и фермента (каталазы).
Образцы пищевых, косметических, биологических и медицинских золей и гелей.
Лабораторные опыты. Определение характера среды раствора с помощью универсального индикатора.
Проведение реакций ионного обмена для характеристики свойств электролитов.
Практическая работа. Влияние различных факторов на скорость химической реакции.
Расчётные задачи. Вычисление массы, объёма, количества вещества продуктов реакции, если известна масса исходного вещества, содержащего определённую долю примесей.
НЕОРГАНИЧЕСКАЯ ХИМИЯ
Металлы (13ч.)
Классификация неорганических соединений. Химические свойства основных классов неорганических соединений.
Металлы. Электрохимический ряд напряжений металлов. Общие способы получения металлов. Понятие о коррозии металлов. Способы защиты от коррозии.
Расчётные задачи. Расчёты по химическим уравнениям, связанные с массовой долей выхода продукта реакции от теоретически возможного.
Неметаллы (8ч.)
Неметаллы. Окислительно-восстановительные свойства типичных неметаллов (на примере водорода, кислорода, галогенов и серы). Общая характеристика подгруппы галогенов (от фтора до иода). Благородные газы.
Демонстрации. Образцы металлов и неметаллов.
Возгонка иода.
Изготовление иодной спиртовой настойки.
Взаимное вытеснение галогенов из растворов их солей.
Образцы металлов и их соединений.
Горение серы, фосфора, железа, магния в кислороде.
Взаимодействие щелочных и щелочноземельных металлов с водой.
Взаимодействие меди с кислородом и серой.
Опыты по коррозии металлов и защите от нее.
Лабораторные опыты. Взаимодействие цинка и железа с растворами кислот и щелочей.
Знакомство с образцами металлов и их рудами (работа с коллекциями).
Знакомство с образцами неметаллов и их природными соединениями (работа с коллекциями).
Распознавание хлоридов и сульфатов.
Генетическая связь неорганических и органических веществ. Практикум. (12ч.)
Генетическая связь неорганических и органических веществ.
Практическая работа. Решение экспериментальных задач по неорганической химии.
Решение экспериментальных задач по органической химии.
Решение практических расчётных задач.
Получение, собирание, распознавание газов.
ХИМИЯ И ЖИЗНЬ (5 ч.)
Химия и здоровье. Лекарства, ферменты, витамины, гормоны, минеральные воды. Проблемы, связанные с применением лекарственных препаратов.
Химия в повседневной жизни. Моющие и чистящие средства. Правила безопасной работы со средствами бытовой химии. Бытовая химическая грамотность.
Промышленное получение химических веществ на примере производства серной кислоты.
Химическое загрязнение окружающей среды и его последствия.
Демонстрации. Образцы лекарственных препаратов и витаминов.
Образцы средств гигиены и косметики.
Лабораторные опыты. Знакомство с образцами лекарственных препаратов домашней медицинской аптечки.
Знакомство с образцами моющих и чистящих средств. Изучение инструкций по их составу и применению.
РЕЗЕРВ СВОБОДНОГО ВРЕМЕНИ 2 ч.
ТРЕБОВАНИЯ К УРОВНЮ ПОДГОТОВКИ ВЫПУСКНИКОВ
В результате изучения химии на базовом уровне ученик должен
знать / понимать
важнейшие химические понятия: вещество, химический элемент, атом, молекула, относительные атомная и молекулярная массы, ион, аллотропия, изотопы, химическая связь, электроотрицательность, валентность, степень окисления, моль, молярная масса, молярный объем, вещества молекулярного и немолекулярного строения, растворы, электролит и неэлектролит, электролитическая диссоциация, окислитель и восстановитель, окисление и восстановление, тепловой эффект реакции, скорость химической реакции, катализ, химическое равновесие, углеродный скелет, функциональная группа, изомерия, гомология;
основные законы химии: сохранения массы веществ, постоянства состава, периодический закон;
основные теории химии: химической связи, электролитической диссоциации, строения органических соединений;
важнейшие вещества и материалы: основные металлы и сплавы; серная, соляная, азотная и уксусная кислоты; щелочи, аммиак, минеральные удобрения, метан, этилен, ацетилен, бензол, этанол, жиры, мыла, глюкоза, сахароза, крахмал, клетчатка, белки, искусственные и синтетические волокна, каучуки, пластмассы;
уметь
называть изученные вещества по «тривиальной» или международной номенклатуре;
определять: валентность и степень окисления химических элементов, тип химической связи в соединениях, заряд иона, характер среды в водных растворах неорганических соединений, окислитель и восстановитель, принадлежность веществ к различным классам органических соединений;
характеризовать: элементы малых периодов по их положению в периодической системе Д.И.Менделеева; общие химические свойства металлов, неметаллов, основных классов неорганических и органических соединений; строение и химические свойства изученных органических соединений;
объяснять: зависимость свойств веществ от их состава и строения; природу химической связи (ионной, ковалентной, металлической), зависимость скорости химической реакции и положения химического равновесия от различных факторов;
выполнять химический эксперимент по распознаванию важнейших неорганических и органических веществ;
проводить самостоятельный поиск химической информации с использованием различных источников (научно-популярных изданий, компьютерных баз данных, ресурсов Интернета); использовать компьютерные технологии для обработки и передачи химической информации и ее представления в различных формах;
использовать приобретенные знания и умения в практической деятельности и повседневной жизни для:
объяснения химических явлений, происходящих в природе, быту и на производстве;
определения возможности протекания химических превращений в различных условиях и оценки их последствий;
экологически грамотного поведения в окружающей среде;
оценки влияния химического загрязнения окружающей среды на организм человека и другие живые организмы;
безопасного обращения с горючими и токсичными веществами, лабораторным оборудованием;
приготовления растворов заданной концентрации в быту и на производстве;
критической оценки достоверности химической информации, поступающей из разных источников.
Учебно-методический комплект:
Рудзитис, Г.Е. Химия. 11 класс: учебник для общеобразовательных учреждений / Г.Е.Рудзитис, Ф.Г.Фельдман.- М.: Просвещение, 2009.
Радецкий, А.М. Проверочные работы по химии в 8-11 классах: пособие для учителя / А.М.Радецкий. – М.: Просвещение, 2002.
Примерная программа среднего (полного) общего образования по химии (базовый уровень). Химия: сборник материалов по реализации федерального компонента государственного стандарта общего образования в общеобразовательных учреждениях
Дополнительная литература:
Брейгер, Л.М. Химия для поступающих в вузы: ответы на примерные экзаменационные билеты / Л.М.Брейгер.- Волгоград: Учитель, 2007.
Ерёмин, В.В. Сборник задач и упражнений по химии: школьный курс / В.В.Ерёмин, - М.:ООО «Издательский дом «Оникс 21 век»; ООО»Издательство «Мир и Образование», 2005.
Корощенко, А.С. Химия. Дидактические материалы. 10-11 классы/ А.С.Корощенко, Р.Г.Иванова, Д.Ю. Добротин. – М.:владос, 2003.
Химия в школе6 науч.-метод. Журн. –М.:Центрхимпресс, 2007-2010.
Кузьменко, Н.Е. Начала химии: современный курс для поступающих в вузы / Н.Е. Кузьменко, В.В.Ерёмин, В.А.Попков. – М.:I Федеративная книготорговая компания, 2002.
Савин, Г.А. Олимпиадные задания по органической химии. 10-11 классы / Г.А.Савин. – Волгоград: Учитель, 2004.
Савин, Г.А. Олимпиадные задания по неорганической химии. 8-9классы / Г.А.Савин. – Волгоград: Учитель, 2003.
ЕГЭ – 2010. Химия: тематические тренировочные задания. – М.:Эксмо, 2010.
Кузьменко, Н.Е. Тесты по химии. 8-11 классы: учебное пособие / Н.Е. Кузьменко, В.В.Ерёмин. – М.:Экзамен, 2006.
MULTIMEDIA – поддержка предмета
Библиотека электронных наглядных пособий. Химия 8-11 классы. – ГУ РЦ ЭМТО «Кирилл и Мефодий», 2003
Интерактивный учебно-методический образовательный комплекс. Химия, 10-11 классы.
Мультимедиа комплекс для средней школы. Органическая химия 10-11 классы. – ЦНИТ СГАУ, 2001
Образовательная коллекция. «Химия для всех-XXI. Решение задач» - ЗАО «1С», 2004
Органическая химия. Мультимедийное сопровождение уроков. – Волгоград: Издательство «Учитель», 2012
CD-ROM «Химия для гуманитариев. Элективный курс» - Волгоград: Издательство «Учитель», 2012
CD-ROM «Химия общая и неорганическая. 10-11 классы». – Лаборатория систем мультимедиа, МарГТУ, 2004
Учебное электронное издание. Химия (8-11 классы). Виртуальная лаборатория. – Лаборатория систем мультимедиа, МарГТУ, 2004
http://files.school-collection.edu.ru
http://festival.1september.ru
При оформлении рабочей программы были использованы следующие условные обозначения:
-- урок изучения новых знаний УИНЗ
-- урок закрепления знаний УЗЗ
-- урок обобщения и систематизации знаний УОИСЗ
-- урок контроля УК
-- комбинированный урок КУ
-- дидактические материалы ДМ
-- упражнение упр.
-- страница с.
-- Периодическая система химических
элементов Д.И.Менделеева ПС
-- теория электролитической диссоциации ТЭД
--практическая работа п/р
-- контрольная работа к/р
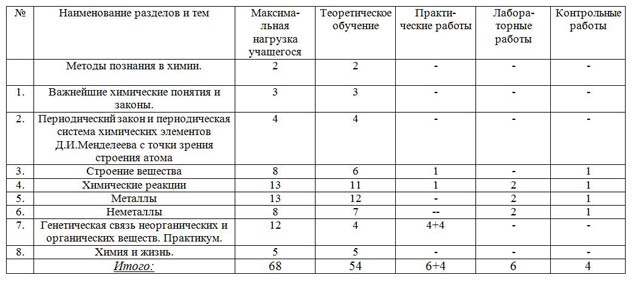
Тематическое планирование по дисциплине_____Химия________________
| № | Наименование разделов и тем | Максима- льная нагрузка учащегося | Теоретическое обучение | Практи- ческие работы | Лабора- торные работы
| Контрольные работы |
|
| Методы познания в химии.
| 2 | 2 | - | - | - |
| 1. | Важнейшие химические понятия и законы. | 3 | 3 | - | - | - |
| 2. | Периодический закон и периодическая система химических элементов Д.И.Менделеева с точки зрения строения атома | 4 | 4 | - | - | - |
| 3. | Строение вещества | 8 | 6 | 1 | - | 1 |
| 4. | Химические реакции | 13 | 11 | 1 | 2 | 1 |
| 5. | Металлы | 13 | 12 | - | 2 | 1 |
| 6. | Неметаллы | 8 | 7 | -- | 2 | 1 |
| 7. | Генетическая связь неорганических и органических веществ. Практикум. | 12 | 4 | 4+4 | - | - |
| 8. | Химия и жизнь. | 5 | 5 | - | - | - |
|
| Итого: | 68 | 54 | 6+4 | 6 | 4 |
Лабораторные работы 11 класс.
проведение реакций ионного обмена для характеристики свойств электролитов.
определение характера среды раствора с помощью универсального индикатора.
- взаимодействие цинка и железа с растворами кислот и щелочей.
знакомство с образцами металлов и их рудами (работа с коллекциями).
знакомство с образцами неметаллов и их природными соединениями (работа с коллекциями).
распознавание хлоридов, карбонатов и сульфатов.
Практические работы 11 класс.
Приготовление растворов с заданной молярной концентрацией.
Влияние различных факторов на скорость химической реакции.
Решение экспериментальных задач по неорганической химии.
Решение экспериментальных задач по органической химии.
Решение практических расчётных задач.
Получение, собирание и распознавание газов.
Минимальные требования к оснащению
для реализации практической части программы
| Тема практической работы
| Лабораторное оборудование
|
| Приготовление растворов с заданной молярной концентрацией. | Весы, колба, мерный цилиндр, поваренная соль, вода дистиллированная, пипетка, пробка. |
| Влияние различных факторов на скорость химической реакции. | Пробирки, спиртовка, раствор соляной кислоты, кусочки магния, цинка, меди; растворы соляной и уксусной кислоты одинаковой концентрации, гранулы цинка; кусочек и порошок мела (или гранула и порошок цинка), пероксид водорода, оксид марганца (IV), лучинка. |
| Решение экспериментальных задач по неорганической химии. | 3 пробирки с кристаллическими веществами без надписей (сульфат аммония, нитрат меди (II), хлорид железа (III)), спиртовка, пробиркодержатель, универсальный индикатор, раствор гидроксида натрия; Кусочек железа, раствор соляной кислоты; Кусочек алюминия, раствор серной кислоты, гидроксид алюминия кристаллический. |
| Решение экспериментальных задач по органической химии. | 5 пронумерованных пробирок с органическими веществами (этанол, уксусная кислота, глюкоза, глицерин, формальдегид), аммиачный раствор оксида серебра (I), растворы гидроксида натрия, сульфата меди (II), пробирки. Пробирка с пробкой и газоотводной трубкой, карбид кальция, бромная вода; пробирка с этанолом, оксид меди (II), спиртовка. |
| Решение практических расчетных задач. | Пробирка, цинк, раствор соляной кислоты; Пробирка, раствор гидроксида натрия. |
| Получение, собирание и распознавание газов
| Получение кислорода: штатив, пробирка с пробкой и газоотводной трубкой, 2 пробирки, спиртовка (или электронагреватель), кристаллизатор с водой, 2стеклянные пластинки, лучинка, уголек, ложечка для сжигания веществ. Получение аммиака: штатив, пробирка с пробкой и газоотводной трубкой, твердые хлорид аммония и гидроксид кальция, спиртовка, пробирка с пробкой для собирания аммиака, кристаллизатор с водой, универсальный индикатор. Получение этилена: штатив, пробирка с пробкой и газоотводной трубкой, спиртовка, 2 мл конц. серной кислоты, 1 мл этилового спирта, несколько крупинок оксида алюминия, бромная вода, раствор перманганата калия. |
| № п/п | Тема урока | Кол-во часов | Тип урока | Химический эксперимент (оборудование) | Требования к уровню подготовки учащихся | Планируе- мая дата | Фактиче-кая дата |
|
1
|
Методы познания в химии (2ч.).
Вводный инструктаж по технике безопасности при работе в химическом кабинете. Научные методы познания веществ и химических явлений. |
1
|
УИНЗ
|
|
Знать технику безопасности, определение химических явлений и методы познания веществ. Уметь моделировать химические процессы. |
03.09.13. |
|
| 2
| Роль эксперимента и теории в химии. Моделирование химических процессов.
|
1 | УИНЗ
| Демонстрации: - анализ и синтез химических веществ.
|
| 05.09.13. |
|
|
1.1 |
Теоретические основы химии Тема 1. Важнейшие химические понятия и законы. (3ч.)
Атом. Химический элемент. Изотопы. Простые и сложные вещества.
|
1 |
КУ |
Демонстрации: -- ПС; --плакат «Классификация веществ»;
|
Знать определения понятий атома, химического элемента, изотопа, простых и сложных веществ. Уметь различать понятия «химический элемент» и «простое вещество». |
10.09.13. |
|
| 1.2 | Закон сохранения массы вещества. Закон превращения энергии при химических реакциях. | 1 | КУ | Демонстрации: -- видеофильм «Химические элементы»
| Знать определение закона сохранения массы веществ и закона постоянства состава, их практическое значение; взаимосвязь закона сохранения массы веществ и закона превращения энергии, классификацию неорганических веществ.
| 12.09.13. |
|
| 1.3 | Закон постоянства состава веществ. Вещества молекулярного и немолекулярного строения. | 1 | КУ | Демонстрации: -- видеофильм «Химические элементы»
| Знать определение закона постоянства состава, его практическое значение. | 17.09.13. |
|
|
2.1. | Тема 2. Периодический закон и периодическая система химических элементов Д.И.Менделеева с точки зрения строения атома (4ч.).
Строение электронных оболочек атомов химических элементов. Короткий и длинный вариант таблицы химических элементов.
|
1 |
КУ |
Демонстрации: -- ПСХЭ; -- таблицы по строению атомов.
|
Знать структуру ПС, определение периодического закона, строение электронных оболочек атомов химических элементов, расположение электронов на уровнях и подуровнях, значение периодического закона. Уметь различать понятия «электронное облако» и «орбиталь», характеризовать s-, p-, d-электроны, определять максимальное число электронов на уровне, характеризовать порядок заполнения электронами подуровней в атомах химических элементов, составлять электронные и графические формулы. |
19.09.13. |
|
| 2.2. | Положение в периодической системе Д.И.Менделеева водорода, лантаноидов, актиноидов и искусственно полученных элементов. | 1 | КУ | Демонстрации: -- ПСХЭ; -- таблицы по строению атомов.
| Знать строение электронных оболочек атомов лантаноидов, актиноидов, расположение электронов на уровнях и подуровнях. Уметь характеризовать порядок заполнения электронами подуровней в атомах лантаноидов, актиноидов, составлять электронные и графические формулы. | 24.09.13. |
|
| 2.3. | Валентность. Валентные возможности и размеры атомов химических элементов. | 1 | КУ | Демонстрации: --комплект таблиц «Электронные оболочки атомов» .
| Знать определение валентности в свете строения атомов, валентные возможности атомов элементов 2-го периода. Уметь объяснять причину высшей валентности атомов, определять валентность элементов при образовании химической связи по донорно-акцепторному механизму, составлять графические схемы строения внешних электронных слоёв атомов химических элементов в возбуждённом и невозбуждённом состоянии. | 26.09.13. |
|
| 2.4. | Изменение свойств соединений химических элементов в периодах и группах. | 1 | КУ | Демонстрации: -- ПСХЭ.
| Знать состав, строение, свойства оксидов, гидроксидов, водородных соединений химических элементов малых периодов и главных подгрупп. Уметь характеризовать химические свойства соединений, изменение состава и свойств соединений в периодах и группах (главных подгруппах). | 01.10.13. |
|
|
3.1 | Тема 3. Строение вещества (8ч.)
Основные виды химической связи. |
1 |
КУ |
Демонстрации: -- таблицы «Химическая связь»; --транспаранты «Виды химической связи». |
Знать определение химической связи, виды химической связи, механизмы их образования. Уметь определять вид химической связи в простых и сложных веществах, составлять схемы образования веществ с различными видами связи, объяснять механизм донорно-акцепторной, ковалентной связи, особенности водородной связи. |
03.10.13. |
|
| 3.2- 3.3 | Характеристика химической связи. Пространственное строение молекул. | 2 | КУ |
| Знать основные характеристики химической связи, типы кристаллических решёток. Уметь доказывать зависимость характеристик химической связи от различных факторов, определять тип кристаллической решётки. | 08.10.13. – 10.10.13. |
|
| 3.4 | Типы кристаллических решёток. | 1 |
| Демонстрации: -- модели кристаллических решёток. | Знать основные типы кристаллических решёток. Уметь определять тип кристаллической решётки. | 15.10.13. |
|
| 3.5 | Причины многообразия веществ. Решение задач. | 1 | КУ | Демонстрации: -- модели молекул гомологов, изомеров. --получение аллотропных модификаций серы и фосфора.
| Знать определения изомеров, гомологов, аллотропии, изотопии.
| 17.10.13. |
|
| 3.6 | Чистые вещества и смеси. Истинные растворы. Способы выражения концентрации растворов: массовая доля растворенного вещества. (Дисперные системы. Понятие о коллоидах и их значение – обзорно).
| 1 | КУ | Демонстрации: - видеофильм «Химия. 8 класс. ч.3» (Вода, растворы) --плакат «Количественные величины в химии»; --образцы пищевых, косметических, биологических и медицинских золей и гелей.
| Знать определение растворимости, массовой доли растворённого веществ, определение молярной концентрации вещества. Уметь вычислять массовую долю и массу вещества в растворе .молярную концентрацию.
| 22.10.13. |
|
| 3.7 | Практическая работа №1. «Приготовление растворов с заданной молярной концентрацией». | 1 | УЗЗ | Практическая работа | Уметь приготавливать раствор соли с определённой массовой долей растворённого вещества. Уметь решать задачи на определение массовой доли и массы растворённого вещества. | 24.10.13. |
|
| 3.8 | Контрольная работа №1. по теме 1-3. | 1 | УК |
| Уметь применять теоретические и практические ЗУН, полученные при изучении тем 1- 3, на контрольной работе. | 29.10.13. |
|
|
4.1 |
Тема 4. Химические реакции (13ч.)
Классификация химических реакций в неорганической и органической химии по различным признакам. Особенности реакций в органической химии.
|
1 |
КУ |
Демонстрации: -- реакции экзо- и эндотермические; --разложение пероксида водорода в присутствии катализатора (оксида марганца (IV) и фермента (каталазы).
|
Знать признаки и классификации химических реакций. Уметь классифицировать предложенные химические реакции или приводить примеры различных типов химических реакций, решать задачи на тепловой эффект. |
31.10.13. |
|
|
|
| 4.2 | Окислительно-восстановительные реакции. Электролиз растворов и расплавов. Практическое применение электролиза.
| 1 | КУ | Демонстрации: -- таблицы «Процессы окисления – восстановления». | Знать определение окислительно-восстановительной реакции, окислителя, восстановителя. Уметь определять окислительно – восстановительные реакции, составлять схему электронного баланса, расставлять коэффициенты, использовать метод электронного баланса. | 12.11.13. |
|
|
|
| 4.3-4.4
| Скорость реакции, ее зависимость от различных факторов. Закон действующих масс. Катализаторы и катализ. Представление о ферментах, как биологических катализаторах белковой природы.
| 2 | КУ | Демонстрации: --зависимость скорости реакции от концентрации и температуры.
| Знать понятие скорости для гомогенной и гетерогенной реакции, факторы, влияющие на скорость реакции, сущность катализа, применение катализаторов и ингибиторов. Уметь объяснять действие каждого фактора, влияющего на скорость реакции на конкретных примерах. | 14.11.13. – 19.11.13. |
|
|
|
| 4.5 | Практическая работа №2. «Влияние различных факторов на скорость химической реакции». | 1 | УЗЗ | Практическая работа | Уметь решать практические задачи на скорость химической реакции, соблюдая правила техники безопасности. | 21.11.13. |
|
|
|
| 4.6 | Обратимость реакций. Химическое равновесие и способы его смещения.
| 1 | КУ | Демонстрации: --видеофильм «Основы молекулярно-кинетической теории». | Знать определение состояния химического равновесия, факторы, влияющие на смещение химического равновесия, определение принципа Ле Шателье, определение обратимых и необратимых реакций. Уметь объяснять на конкретных примерах способы смещения химического равновесия, пименяя принцип Ле Шателье, записывать константу равновесия для гомогенных и гетерогенных реакций. | 26.11.13. |
|
|
|
| 4.7 | Производство серной кислоты. Решение задач. | 1 | КУ | Демонстрации: --таблица «производство серной кислоты» | Знать определение состояния химического равновесия, факторы, влияющие на смещение химического равновесия, определение принципа Ле Шателье, определение обратимых и необратимых реакций.
| 28.11.13. |
|
|
|
| 4.8-4.9 | Электролитическая диссоциация. Сильные и слабые электролиты. Водородный показатель. | 2 | КУ | Демонстрации: -- испытание веществ и их растворов на электропроводность; -- образцы кристаллогидратов; --видеофильм «Химия. 9 класс. Электролитическая диссоциация». | Знать определение электролитов и неэлектролитов, электролитическая диссоциация определение – «основание», «кислота», «соль» в свете ТЭД, определение кристаллогидратов, степень электролитической диссоциации. | 03.12.13. – 05.12.13. |
|
|
|
| 4.10 | Реакции ионного обмена в водных растворах. | 1 | КУ | Лабораторный опыт №1: --проведение реакций ионного обмена для характеристики свойств электролитов.
| Знать определение реакций ионного обмена, условия осуществления данных реакций. Уметь составлять молекулярные, полные и сокращённые ионные уравнения, необратимые реакции, объяснять их сущность в свете ТЭД, выполнять лабораторные опыты по проведению реакций ионного обмена, делать выводы. | 10.12.13. |
|
|
|
| 4.11 | Гидролиз неорганических и органических соединений. Среда водных растворов: кислая, нейтральная, щелочная.
| 1 | КУ | Лабораторный опыт №2: --определение характера среды раствора с помощью универсального индикатора.
| Знать определение гидролиза солей. Уметь записывать уравнения гидролиза солей, определять рН среды. | 12.12.13. |
|
|
|
| 4.12 | Обобщение и систематизация знаний по теме «Химические реакции». Решение расчетных задач | 1 | УОИСЗ |
| Уметь применять ЗУН при выполнении тренировочных заданий и упражнений. | 17.12.13. |
|
|
|
| 4.13 | Контрольная работа №2. по теме 4(в форме ЕГЭ). | 1 | УК |
| Уметь применять теоретические и практические ЗУН, полученные при изучении темы 4, на контрольной работе. | 19.12.13. |
|
|
|
|
5.1 | Неорганическая химия Тема 5. Металлы (13ч.)
Общая характеристика металлов.
|
1 |
УИНЗ |
Демонстрации: -- образцов металлов, их оксидов, некоторых солей
|
Знать строение, свойства, способы получения и применения простых веществ металлов. Уметь характеризовать химические элементы металлы по положению в ПС и строению атомов, характеризовать химические свойства металлов, записывать уравнения реакций в молекулярном и окислительно-восстановительном виде. |
24.12.13. |
|
|
|
| 5.2- 5.3 | Общие способы получения металлов. Электролиз растворов и расплавов. | 2 | КУ | Демонстрации: -- плакаты «Способы получения металлов» | Знать способы получения и применения простых веществ металлов. Уметь записывать уравнения реакций в молекулярном и окислительно-восстановительном виде. | 26.12.13.- 31.12.13. |
|
|
|
| 5.4 | Химические свойства металлов. | 1 | КУ | Демонстрации: -- взаимодействия металлов и неметаллов. Лабораторный опыт №3: --взаимодействие цинка и железа с растворами кислот и щелочей.
| Знать физические и химические свойства металлов. Уметь доказывать химические свойства металлов, записывать уравнения реакций в молекулярном и окислительно-восстановительном виде. | 14.01.14. |
|
|
|
| 5.5 | Понятие о коррозии металлов. Способы защиты от коррозии. | 1 | КУ | Демонстрации: --опыты по коррозии металлов и защите от нее.
| Знать определение коррозии металлов, основные методы защиты от коррозии.
| 16.01.13. |
|
|
|
| 5.6- 5.7 | Металлы главных подгрупп (А-групп) ПСХЭ. | 2 | УИНЗ | Демонстрации: -- образцов металлов, их оксидов, некоторых солей; -- взаимодействия металлов с кислородом, кислотами, водой; --доказательство амфотерности алюминия и его гидроксида.
| Знать характеристику металлов главных подгрупп ПС, исходя из положения в ПС и строения атомов металлов. Уметь объяснять изменение свойств простых веществ металлов, а также их соединений (оксидов, гидроксидов, гидридов) в пределах одного периода и главной подгруппы ПС, характеризовать химические свойства простых веществ металлов. | 21.01.14 – 23.01.14. |
|
|
|
| 5.8- 5.9 | Металлы побочных подгрупп (В-групп) ПСХЭ. | 2 | УИНЗ | Демонстрации: -- образцы меди, железа, хрома, их соединений; --взаимодействие меди и железа с кислородом, кислотами, -- получение гидроксидов меди, хрома, оксида меди; --доказательство амфотерности соединений хрома (III), кислотных свойств хромовой кислоты. | Знать характеристику металлов побочных подгрупп (меди, железа, хрома), исходя из положения в ПС и строения атомов металлов. Уметь объяснять изменение свойств простых веществ металлов, а также их соединений (оксидов, гидроксидов, гидридов) в пределах одного периода и главной подгруппы ПС, характеризовать химические свойства простых веществ металлов. | 28.01.14. – 30.01.14 |
|
|
|
| 5.10 | Оксиды и гидроксиды металлов. | 1 | КУ | Демонстрации: -- получение гидроксидов меди, хрома, оксида меди; --доказательство амфотерности соединений хрома (III), кислотных свойств хромовой кислоты. | Знать состав, строение, свойства оксидов, оснований, солей металлов. Уметь доказывать химические свойства оксидов, оснований, солей металлов, записывать уравнения реакций в молекулярном и окислительно-восстановительном виде. | 04.02.14. |
|
|
|
| 5.11 | Сплавы металлов. Решение задач. | 1 | КУ | Лабораторный опыт №4: -знакомство с образцами металлов и их рудами (работа с коллекциями).
| Знать состав, строение основных сплавов металлов.
| 06.02.14. |
|
|
|
| 5.12 | Обобщение и систематизация знаний по теме «Металлы». Решение расчетных задач | 1 | УОИСЗ |
| Уметь применять ЗУН при выполнении тренировочных заданий и упражнений. | 11.02.14. |
|
|
|
| 5.13 | Контрольная работа №3. по теме 5(в форме ЕГЭ). | 1 | УК |
| Уметь применять теоретические и практические ЗУН, полученные при изучении темы 5, на контрольной работе. | 13.02.14. |
|
|
|
|
6.1-6.2 | Тема 6. Неметаллы (8ч.)
Общая характеристика неметаллов. |
2 |
УИНЗ |
Демонстрации: --образцы и неметаллов; --модели кристаллических решёток йода, алмаза, графита. Лабораторный опыт №5: --знакомство с образцами неметаллов и их природными соединениями (работа с коллекциями).
|
Знать строение, свойства, способы получения и применения простых веществ неметаллов. Уметь характеризовать химические элементы неметаллы по положению в ПС и строению атомов, определять вид химической связи, тип кристаллической решётки в простых веществах неметаллах, характеризовать химические свойства неметаллов. |
18.02.14. – 20.02.14.
|
|
|
|
| 6.3 | Оксиды неметаллов. | 1 | КУ | Демонстрации: --сжигание угля в кислороде; --определение химических свойств продуктов сгорания. | Знать классификацию оксидов, их состав, строение, свойства, применение. Уметь составлять формулы оксидов химических элементов неметаллов I-IV ПС, определять в них вид химической связи, тип кристаллической решётки. | 25.02.14. |
|
|
|
| 6.4 | Кислородсодержащие кислоты. | 1 | КУ | Демонстрации: --таблицы
| Уметь составлять формулы кислородсодержащих и бескислородных кислот, образованных неметаллами II-III периодов, определять вид химической связи, тип кристаллической решётки, характеризовать химические свойства кислот, записывать уравнения реакций в молекулярном и окислительно-восстановительном виде. | 27.02.14. |
|
|
|
| 6.5 | Окислительные свойства серной и азотной кислот. | 1 | КУ | Демонстрации: --взаимодействие концентрированной серной, концентрированной и разбавленной азотной кислот с медью. | Уметь характеризовать окислительные свойства азотной и концентрированной серной кислот, расставлять коэффициенты методом электронного баланса. | 04.03.14. |
|
|
|
| 6.6 | Водородные соединения неметаллов. | 1 | КУ | Демонстрации: -- получение аммиака и хлороводорода, растворение их в воде; --доказательство кислотно-основных свойств. | Знать состав, строение, свойства, применение летучих водородных соединений. Уметь составлять формулы летучих водородных соединений неметаллов на основе строения их атомов и электроотрицательности, определять вид химической связи, тип кристаллической решётки, характеризовать физические и химические свойства, записывать уравнения химических реакций. | 06.03.14. |
|
|
|
| 6.7 | Решение качественных расчётных задач. | 1 | УЗЗ | Лабораторный опыт №6: --распознавание хлоридов, карбонатов и сульфатов.
| Уметь применять ЗУН при выполнении тренировочных заданий и упражнений. | 11.03.14. |
|
|
|
| 6.8 | Контрольная работа №4. по теме 6(в форме ЕГЭ). | 1 | УК |
| Уметь применять теоретические и практические ЗУН, полученные при изучении темы 6, на контрольной работе. | 13.03.14. |
|
|
|
|
7.1- 7.2 |
Тема 7. Генетическая связь неорганических и органических веществ. Практикум. (12ч.)
Генетическая связь неорганических и органических веществ.
|
2 |
УЗЗ |
|
Уметь применять теоретические и практические ЗУН, полученные при изучении химии. |
18.03.14. – 20.03.14 |
|
|
|
| 7.3- 7.4 | Практическая работа №3. «Решение экспериментальных задач по неорганической химии». | 2 | УЗЗ | Практическая работа | Уметь проводить химический эксперимент по изучению химических свойств металлов и их соединений, соблюдая правила техники безопасности. | 01.04.14. – 03.04.14. |
|
|
| 7.5- 7.6 | Практическая работа №4. «Решение экспериментальных задач по органической химии». | 2 | УЗЗ | Практическая работа | Уметь проводить химический эксперимент по изучению химических свойств органических соединений, соблюдая правила техники безопасности. | 08.04.14. – 10.04.14 |
|
|
| 7.7- 7.8 | Практическая работа №5. «Решение практических расчётных задач». | 2 | УЗЗ | Практическая работа | Уметь проводить химический эксперимент по решению практических задач, соблюдая правила техники безопасности. | 15.04.14. – 17.04.14. |
|
|
| 7.9- 7.10 | Практическая работа №6. «Получение, собирание и распознавание газов». | 2 | УЗЗ | Практическая работа | Уметь правильно проводить химический эксперимент по решению практических задач, получать, собирать, распознавать газы, соблюдая правила техники безопасности. | 22.04.14. – 24.04.14. |
|
|
| 7.11 | Анализ выполнения практикума. | 1 | УЗЗ |
|
| 29.04.14. |
|
|
| 7.12 | Обобщение и повторение изученного материала. | 1 | УОИСЗ |
| Уметь применять ЗУН при выполнении тренировочных заданий и упражнений. | 06.05.14. |
|
|
|
8.1 |
Тема 8. Химия и жизнь. (5ч.)
Химия и здоровье. |
1 |
КУ |
|
сообщения |
08.05.14. |
|
|
| 8.2 | Лекарства, ферменты, витамины, гормоны, минеральные воды. Проблемы, связанные с применением лекарственных препаратов. | 1 | КУ |
| сообщения | 13.05.14. |
|
| 8.3 | Химия в повседневной жизни. Моющие и чистящие средства. Правила безопасной работы со средствами бытовой химии. Бытовая химическая грамотность. | 1 | КУ |
| сообщения | 15.05.14. |
|
| 8.4 | Промышленное получение химических веществ на примере производства серной кислоты.
| 1 | КУ |
| сообщения | 20.05.14. |
|
| 8.5 | Химическое загрязнение окружающей среды и его последствия.
| 1 | КУ |
| сообщения | 22.05.14. |
|
|
| Итого: |
68 |
| Контрольных работ – 4
| Практических работ – 6; Лабораторных работ -6
|
|
|

 Получите свидетельство
Получите свидетельство Вход
Вход











 Рабочая программа по химии (11 класс) (84.61 КB)
Рабочая программа по химии (11 класс) (84.61 КB)
 0
0 590
590 34
34 Нравится
0
Нравится
0




