Элективный курс по химии
Самое необыкновенное вещество в мире
Локайчук Г.И.
г. Магнитогорск, МОУ СОШ №6
Пояснительная записка
Вода среди необозримого множества веществ занимает совершенно особое, исключительное место. Потому что не смотря на распространенность, таит в себе много неизвестного, загадочного, удивительного. Предлагаемый курс позволяет учащимся расширить свои знания об этом веществе и процессах, протекающих с его участием.
Курс рассчитан на аудиторию 9 классов и даёт возможность слушателям систематизировать и закрепить знания по темам: «Строение атома», «Классы неорганических соединений», «Теория электролитической диссоциации», «Окислительно-восстановительные реакции». Вместе с тем в данный курс включены вопросы, которые в базовом курсе основной школы рассматриваются не достаточно полно или не рассматриваются совсем, но включены в программу единого регионального экзамена.
Цель курса:
систематизация и углубление знаний учащихся, развитие познавательного интереса к предмету.
Задачи курса:
формирование научного мировоззрения учащихся;
совершенствование навыков составления уравнений реакций, электронного баланса, решения задач;
совершенствование навыков проведения химического эксперимента, умений наблюдать химический эксперимент и анализировать увиденное;
развитие самостоятельности в работе с различными источниками информации;
подготовка к олимпиадам, предметным конкурсам, научно-практическим конференциям.
Наряду с основной формой организации учебных занятий – уроком, предлагаются продвинутые лекции, практические работы, чередующиеся с нетрадиционными уроками, защитой проектов и выполнением творческих заданий.
Формами контроля над уровнем достижений учащихся служат текущие, рубежные и итоговые контрольные работы, семинары, конференции, защита проектов.
В связи с этим целесообразно, чтобы курс вёл педагог, имеющий квалификацию учителя химии.
Требования к результатам обучения
Прослушав элективный курс, учащиеся должны
понимать основные законы химии;
знать теорию строения атома, ТЭД, теорию ОВР, свойства классов неорганических соединений, практическое значение гидролиза и электролиза;
уметь описывать химические процессы с помощью уравнений реакций, определять окислитель и восстановитель, с помощью электронного баланса расставлять коэффициенты, определять продукты гидролиза и электролиза, решать задачи разных типов и разными способами, применять свои знания на практике.
Курс рассчитан на 35 часов.
Содержание курса
Тема 1. Самый распространенный элемент в природе (4 часа).
Кислород в природе. Строение атома и молекулы. Изотопы кислорода. Физические и химические свойства. Аллотропия. Получение и применение кислорода. Состав воздуха. Основные загрязнители воздуха. Охрана воздуха от загрязнений.
Практическая работа №1. Получение кислорода и изучение его свойств.
Демонстрации. Горение простых веществ в кислороде (фосфора, серы, углерода). Горение и затухание свечи в сосуде. Демонстрация образцов оксидов.
Тема 2. Рождающий воду (3 часа).
Водород в природе. Строение атома и молекулы. Изотопы водорода. Физические и химические свойства. Получение и применение. Водород – восстановитель.
Практическая работа №2. Получение водорода и изучение его свойств.
Демонстрации. Взрыв гремучего газа. Проверка водорода на чистоту.
Тема №3. Самое необыкновенное вещество в мире (9 часов).
Вода в природе. Строение молекулы воды. Водородная связь. Физические и химические свойства воды. Амфотерность воды. Кристаллизационная вода. Кристаллогидраты. Вода – растворитель. Растворы. Массовая доля растворенного вещества. Решение задач с применением понятия «массовая доля». Охрана водных ресурсов.
Практическая работа №3. Приготовление раствора с заданной массовой долей растворенного вещества из двух растворов с разной концентрацией этого вещества.
Демонстрации. Растворение в воде твёрдых, жидких, и газообразных веществ. Взаимодействие воды с кислотными и основными оксидами с целью установления характера воды как оксида. Образование голубого раствора при растворении безводного сульфата меди (II) в воде.
Тема 4. Электролитическая диссоциация (13 часов).
Электролиты и неэлектролиты. Механизмы диссоциации веществ с различным типом связи. Кислоты, основания, соли в свете теории электролитической диссоциации. Степень диссоциации и её зависимость от концентрации и природы электролита. Константа диссоциации. Ступенчатая диссоциация. Диссоциация воды. Водородный показатель – рН. Среды водных растворов. Окраска индикаторов. Понятие гидролиза. Гидролиз солей. Практическое применение гидролиза. Решение задач, связанные с расчетом массы, объема продукта реакции, если одно из реагирующих веществ дано в избытке.
Практическая работа №4. Химические свойства кислот, оснований и солей в свете ТЭД.
Практическая работа №5. Качественные реакции на ионы (Cl-, Br-, I-, SO4 2-,CO3 2-, PO4 3-, SiO3 2-, S2-, NH4 + )
Практическая работа №6. Экспериментальные задачи по теме «Гидролиз».
Демонстрации. Влияние воды на электрическую проводимость веществ. Свойства растворов – свойства ионов. Электропроводность концентрированных и разбавленных растворов. Испытание растворов индикаторами.
Тема 5. Окислительно – восстановительные реакции (6 часов).
Окислительно – восстановительные реакции, протекающие в водных растворах. Взаимодействие металлов с водой, кислотами, солями. Понятие коррозии. Химическая коррозия, электрохимическая коррозия. Способы защиты металлов от коррозии. Экономический и экологический ущерб, причиняемый коррозией. Электролиз воды. Электролиз растворов соединений металлов и его практическое значение.
Практическая работа №7. Химическая и электрохимическая коррозия металлов.
Демонстрации. Взаимодействие воды с металлами различной активности. Взаимодействие металлов с кислотами разной концентрации (азотной и серной). Взаимодействие металлов с солями.
Тематический план. 9 класс
(всего 35 ч.)
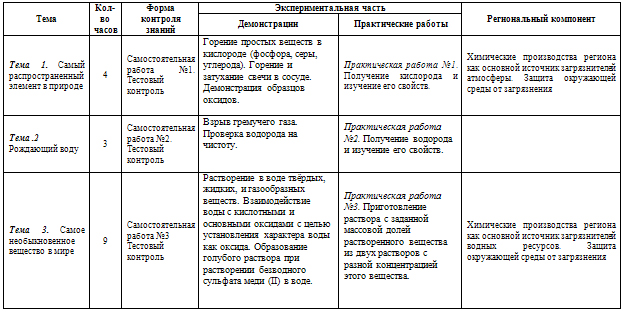
| Тема | Кол-во часов | Форма контроля знаний | Экспериментальная часть | Региональный компонент |
| Демонстрации | Практические работы |
| Тема 1. Самый распространенный элемент в природе | 4 | Самостоятельная работа №1. Тестовый контроль | Горение простых веществ в кислороде (фосфора, серы, углерода). Горение и затухание свечи в сосуде. Демонстрация образцов оксидов.
| Практическая работа №1. Получение кислорода и изучение его свойств. | Химические производства региона как основной источник загрязнителей атмосферы. Защита окружающей среды от загрязнения |
| Тема .2 Рождающий воду | 3 | Самостоятельная работа №2. Тестовый контроль | Взрыв гремучего газа. Проверка водорода на чистоту.
| Практическая работа №2. Получение водорода и изучение его свойств.
|
|
| Тема 3. Самое необыкновенное вещество в мире | 9 | Самостоятельная работа №3 Тестовый контроль | Растворение в воде твёрдых, жидких, и газообразных веществ. Взаимодействие воды с кислотными и основными оксидами с целью установления характера воды как оксида. Образование голубого раствора при растворении безводного сульфата меди (II) в воде.
| Практическая работа №3. Приготовление раствора с заданной массовой долей растворенного вещества из двух растворов с разной концентрацией этого вещества.
| Химические производства региона как основной источник загрязнителей водных ресурсов. Защита окружающей среды от загрязнения |
| Тема 4. Электролитическая диссоциация | 13 | Контрольная работа № 1 | Влияние воды на электрическую проводимость веществ. Свойства растворов – свойства ионов. Электропроводность концентрированных и разбавленных растворов. Испытание растворов индикаторами.
| Практическая работа №4. Химические свойства кислот, оснований и солей в свете ТЭД. Практическая работа №5. Качественные реакции на ионы (Cl-, Br-, I-, SO4 2-,CO3 2-, PO4 3-, SiO3 2-, S2-, NH4 + ) Практическая работа №6. Экспериментальные задачи по теме «Гидролиз».
| Реакции ионного обмена , встречающиеся на производстве. Кислотность почв, известкование. Химическая мелиорация почв в регионе. |
| Тема 5. ОВР
| 6
| Контрольная работа №2 | . Взаимодействие воды с металлами различной активности. Взаимодействие металлов с кислотами разной концентрации (азотной и серной). Взаимодействие металлов с солями.
| Практическая работа №7. Химическая и электрохимическая коррозия металлов.
| Способы защиты металлов от коррозии на предприятиях региона. Производство металлов на ММК. |
Календарно тематическое планирование
| N п/п | Дата | Тема | Кол-во часов |
| Тема 1. Самый распространенный элемент в природе (4ч)
|
| 1 |
| Кислород в природе. Строение атома и молекулы. Изотопы кислорода. | 1 |
| 2 |
| Физические свойства кислорода. Аллотропия. Химические свойства кислорода. Оксиды | 1 |
| 3 |
| Состав воздуха. Основные загрязнители атмосферы. Охрана воздуха от загрязнителей. | 1 |
| 4 |
| Практическая работа №1 « Получение кислорода и изучение его свойств» | 1 |
| Тема 2. Рождающий воду (3ч)
|
| 5 |
| Водород в природе. Строение атома и молекулы. Изотопы водорода. | 1 |
| 6 |
| Физические и химические свойства. Гидриды. Водород – восстановитель. Получение и применение. | 1 |
| 7 |
| Практическая работа №2 «Получение водорода и изучение его свойств». | 1 |
| Тема 3. Самое необыкновенное вещество в мире (9ч)
|
| 8 |
| Строение молекулы воды. Физические свойства. Водородная связь. | 1 |
| 9 |
| Химические свойства воды. | 1 |
| 10 |
| Амфотерность воды. | 1 |
| 11 |
| Кристаллизационная вода. Кристаллогидраты. Решение задач на кристаллогидраты. | 1 |
| 12 |
| Вода – растворитель. Растворы. | 1 |
| 13 |
| Массовая доля растворенного вещества в растворе. | 1 |
| 14 |
| Решение задач разных типов с применением понятия «массовая доля» | 1 |
| 15 |
| Вода в природе. Тяжелая вода. Охрана водных ресурсов | 1 |
| 16 |
| Практическая работа №3 «Приготовление раствора с заданной массовой долей растворённого вещества из двух растворов с разной концентрацией этого вещества» | 1 |
| Тема 4. Электролитическая диссоциация (13ч)
|
| 17 |
| Электролиты и неэлектролиты. Механизмы диссоциации веществ с различным характером связи. | 1 |
| 18 |
| Диссоциация кислот, солей, оснований. Уравнения диссоциации. Реакции ионного обмена. | 1 |
| 19 |
| Кислоты в свете теории электролитической диссоциации. | 1 |
| 20 |
| Основания в свете теории электролитической диссоциации. | 1 |
| 21 |
| Соли в свете теории электролитической диссоциации. | 1 |
| 22 |
| Степень электролитической диссоциации. Константа диссоциации. Ступенчатая диссоциация. | 1 |
| 23 |
| Диссоциация воды. Водородный показатель – рН. Индикаторы. | 1 |
| 24 |
| Понятие гидролиза. Гидролиз солей. Практическое применение гидролиза. | 1 |
| 25 26 |
| Решение задач на избыток | 2 |
| 27 |
| Практическая работа №4 «Химические свойства кислот, оснований и солей в свете ТЭД» | 1 |
| 28 |
| Практическая работа №5 «Качественные реакции на ионы» | 1 |
| 29 |
| Практическая работа №6 Решение экспериментальных задач по теме « Гидролиз».
| 1 |
| Тема 5. Окислительно-восстановительные реакции (5ч)
|
| 30 |
| ОВР, протекающие в водных растворах. | 1 |
| 31 |
| Взаимодействие металлов с водой, кислотами, солями | 1 |
| 32 |
| Коррозия металлов. Виды коррозии. Защита металлов от коррозии | 1 |
| 33 |
| Электролиз расплавов и растворов. Практическое значение электролиза. | 1 |
| 34 |
| Практическая работа №7 «Химическая и электрохимическая коррозия металлов». | 1 |
| Итог |
| 34 |
Рекомендуемая литература для учителя
Аликберова Л.Ю., Степин Б.Д. Занимательные задания и эффектные опыты по химии.- М: Дрофа,2002.
Аранская О.С., Бурая И.В. Проектная деятельность школьников в процессе обучения химии. 8-11 классы.-М:. «Вентана-Граф»,2005.
Габриелян О.С., Остроумов И.Г. Настольная книга учителя «Химия. 9 класс». – М: Дрофа,2002.
Габриелян О.С., Остроумов И.Г. Решетов П.В. Задачи по химии и способы их решения. – М: Дрофа,2004
Гроссе Э., Вайсмантель Х. Химия для любознательных. – Л.: Химия,1985.
Добровольский В.В. Химия Земли. –М:, Просвещение,1988.
Маршанова. Г.Л. Техника безопасности в школьной химической лаборатории: Сборник инструкций и рекомендаций. – М.: Аркти,2002.
Малышкина В. Занимательная химия. – Санкт-Петербург, «Тригон», 1998.
Оржековский П.А., Давыдов В.Н., Титов Н.А. Творчество учащихся на практических занятиях по химии. Книга для учителя.-М:, АРКТИ,1999.
Петрянов И.В. Самое необыкновенное вещество в мире. – М:, Педагогика, 1985.
Смирнов В.Ф., Чирва А.Н. Путешествие в страну тайн (Познавательные игры в семье). – М.: Новая школа, 1993.
Рекомендуемая литература для учащихся
Юдин А.М., Сучков В.Н., Коростелин Ю.А. Химия для вас, – 4-е изд., стереотипн. – М.: Химия,1988.
Габриелян О.С. Химия. 9 класс. – М.: дрофа,2000 -2003.
Габриелян О.С., Лысова Г.Г. Химия. 11 класс – М.: Дрофа,2001-2003.
Девяткин В.В., Ляхова Ю.М. Химия для любознательных, или О чём не узнаешь на уроке. – Ярославль: академия К˚: академия холдинг, 2000.
Ольгин о.М. Опыты без взрывов. – М.: Химия,1986.
Смирнов Ю.Н. Мир химии. – СПб.: МиМЭкспресс,1995.
Шульгин. Г.Б. Эта увлекательная химия. – М.: Химия ,1984.
Приложение 1.
Разработка урока по теме « Получение кислорода и его свойства.
Цель урока. Получить кислород и изучить его свойств
Задачи.
Познакомить учащихся со способами получения кислорода, его физическими и химическими свойствами.
Научить учащихся наблюдать химический эксперимент, выявлять признаки реакции, делать выводы, опираясь на результаты эксперимента.
Развивать умения составлять уравнения химических реакций, расставлять коэффициенты, определять тип реакции, анализировать, обобщать, сравнивать.
Через групповую работу развивать такие качества личности как коллективизм и ответственность.
Оборудование и реактивы. Прибор для получения кислорода, спиртовка, металлическая ложка для сжигания веществ, круглые колбы. конические колбы, школьные весы с разновесами, пипетка. спички. перманганат калия, сера, красный фосфор, уголь, вода, лакмус, кислород.
Ход урока.
Изучение нового материала.
1.Объявляется тема урока и план действий, форма работы (групповая), творческие группы и представляется консультант каждой группы.
2. Объясняются задачи и цели каждой творческой группе, вручаются инструкции.
3. Демонстрация эксперимента – задачи*:
а) получение кислорода (для группы№1)
б) горение простых веществ в кислороде (для группы №2)
в) экспериментальное осуществление цепочки (для группы №3)
P P2O5 H3PO4 Na3PO4
* - демонстрации могут быть «живыми», а можно использовать ЦОРы.
4. Работа творческих групп.
Девиз: «Чтобы познать нужно, научиться наблюдать»
А.Н. Несмеянов
Группа №1.
Задание. Описать физические свойства кислорода и сконструировать прибор для его собирания.
Инструкция 1.
Наблюдать получение кислорода (О2) и заполнение им колбы, описать свои наблюдения.
Записать уравнение реакции.
Определить тип реакции, аргументировать.
Описать физические свойства газа по плану:
а) агрегатное состояние (ж., тв., г.)
б) цвет
в) запах
г) плотность по воздуху (тяжелее, легче)
д) теплопроводность
е) электропроводность
ж) температура плавления
з) температура кипения
и) растворимость в воде
5. Сконструировать прибор для получения и собирания кислорода.
6. Сделать обоснованный вывод о способе (способах) собирания кислорода.
7. Составить опорную схему – конспект физических свойств кислорода.
Группа №2.
Задание. Описать химические свойства кислорода на примере реакций горения в нём простых веществ: серы, красного фосфора, угля.
Инструкция 2.
Наблюдать горение в кислороде простых веществ: серы, красного фосфора, угля.
Записать уравнения химических реакций с электронным балансом.
Охарактеризовать реакции по всем признакам классификации (тепловому эффекту, составу и кол – ву исх. и обр. в – в, обратимости, фазе, катализатору, с.о.)
Сделать выводы об особенностях горения простых веществ и окислительных возможностях кислорода.
Сравнить горение простых веществ на воздухе и в кислороде. Объяснить причины различий.
Группа №3.
Задание. Записать уравнения реакций отражающих связь между простыми и сложными веществами, между классами неорганических соединений.
Инструкция 3.
Наблюдать за превращениями, происходящими с красным фосфором и его соединениями, описать наблюдения.
Записать уравнения реакций, рассмотрев одно из них в свете теории ОВР, а другое – ТЭД (электронный баланс, полное и сокращенное ионное уравнение).
Определить тип реакций, аргументировать.
С помощью формул и стрелок записать в виде цепочки превращения, происходящие с фосфором, назвать вещества.
Отметить признаки качественной реакции на кислоты.
Сделать вывод о связи между веществами.
Группа №4.
Задание. Пользуясь дополнительной литературой изучить другие способы получения кислорода и составить схему его применения.
Инструкция 4.
Выписать способы получения кислорода:
а) лабораторные
б) промышленные
2. Записать соответствующие уравнения реакций.
3. Составить схему использования кислорода человеком.

Обсуждение результатов работы и выводов творческих групп (выступление представителей творческих групп)
Закрепление и проверка знаний (тест). Взаимоконтроль, самоконтроль (пары обмениваются работами, проверяют, оценивают). Код ответов и критерии оценок на экране.
Аргументированное оценивание ответов.
Домашнее задание с инструктированием.
Приложение 2
ЗАДАЧИ РАЗЛИЧНЫХ ТИПОВ ПО ТЕМЕ «ВОДОРОД»
10.1. Имеется 5 л молекулярного водорода и 5 л аммиака (н. у.). Какой из газов содержит большее
число атомов водорода?
Ответ. Аммиак.
10.2. Порция водорода имеет массу, равную массе 33,6 л гелия (н. у.). Сколько молекул водорода содержится в данном образце?
Ответ. N(H2) = 1,806 • 1024.
10.3. Какой объем водорода (н. у.) можно получить при взаимодействии 32,5 г цинка с избытком
соляной кислоты?
Ответ. V(H2)= 11,2 л.
10.4. Вычислите объем водорода (н. у.), который можно получить при взаимодействий 14 г железа с 245 г 8% -ного раствора серной кислоты.
Ответ. V(H2) = 4,48 л.
10.5. 21,6 г алюминия обработали 354 мл 12%-ного раствора гидроксида натрия (р = 1,13 г/мл). Какой объем водорода (н. у.) получен при этом?
Ответ: V(H2) = 26,88 л.
10.6. Найдите объем водорода (н. у.), который образуется при взаимодействии избытка водяного пара с 600 кг раскаленного угля, если выход продукта реакции составляет 80%.
О т в е т: V(H2) = 896 м3.
10.7. 14 г металла, проявляющего в соединениях степень окисления +2, прореагировало при нагревании с избытком водорода. При этом образовалось 14,7 г гидрида металла. Назовите неизвестный металл.
О т.в е т. Кальций.
10.8. Смесь водорода и кислорода общим объемом 15,68 л поместили в реактор и взорвали. После реакции остался непрореагировавший водород объемом 5,6 л. Найдите объемную долю водорода в исходной смеси. Все объемы приведены к нормальным условиям.
Ответ. φ(Н2) = 78,57%.
10.9. 31,36 л (н. у.) смеси водорода с хлором облучили УФ-светом. По окончании реакции осталось 4,48 л непрореагировавшего хлора (н. у.). Вычислите массовую долю водорода в исходной смеси. Ответ. w(Н2) = 2,07%.
10.10. Вычислите массу гидрида кальция, необходимую для получения такого количества водорода, которым можно восстановить 5,6 г оксида меди (II).
Ответ. m(СаН2) = 1,47 г.
10.11. Какой объем водорода (н. у.) потребуется для восстановления 375,6 г смеси оксида рутения (IV) и оксида молибдена (VI), массовые доли которых в смеси равны соответственно 42,49 и 57,51%?
Ответ. V(H2) = 154,56 л.
10.12. 23,4 г металла, проявляющего в соединениях степень окисления +1, обработали водой. В результате выделилось 6,72 л (н. у.) газа. Определите неизвестный металл.
Ответ. Калий.
10.13. Газовая смесь состоит из водорода (объемная доля 25%), аммиака (объемная доля 40%) и метана (объемная доля 35%). Объем смеси (н. у.) равен 67,2 л. Вычислите общее число атомов водорода, входящих в состав данной смеси.
Ответ. N(H) = 5,6 • 1024.
10.14. Массовая доля водорода в соединении с элементом, проявляющим степень окисления -4, равна 12,5%. Определите неизвестный элемент.
Ответ. Кремний.
10.15. 21 г технического гидрида кальция, массовая доля примесей в котором 10%, обработали
избытком воды. Полученный газ прореагировал с 32 г технической серы, массовая доля примесей в
которой 20%. Какой объем (н. у.) сероводорода был при этом получен?
Ответ. V(H2S)= 17,92 л.
10.16. Смесь водорода с неизвестным газообразным простым веществом имеет плотность по гелию, равную 4,075. Массовая доля неизвестного газа в этой смеси равна 94,48%. Определите неизвестное вещество.
Ответ. Азот.
10.17. Водород, полученный при действии избытка соляной кислоты на 15,6 г магния, пропустили над 100,8 г нагретого оксида железа (II), при этом произошло частичное восстановление оксида. Вычислите массовую долю металла в смеси, образовавшейся после восстановления.
Ответ. w (Fe) = 40,27%.
10.18. 31,36 л (н. у.) смеси водорода и гелия пропустили над раскаленным оксидом меди (II), при
этом масса оксида уменьшилась на 12,8 г. Найдите массовую долю водорода в исходной смеси.
О т в е т. w(Н2) = 40%.
10.19. Смесь хлора с избытком водорода общим объемом 35,84 л (н. у.) облучили УФ-светом. Газовую смесь, образовавшуюся в ходе реакции, пропустили через 200 мл воды, при этом образовался раствор с массовой долей НСl 12,74%. Рассчитайте массовую долю водорода в исходной смеси газов.
От в е т. w(Н2) = 7,8% .
10.20. Массовая доля водорода в смеси обычной воды и тяжелой воды равна 8,11%. Вычислите массовую долю тяжелой воды в смеси.
Ответ. m(D20) = 27%.
Календарно тематическое планирование
| N п/п | Дата | Тема | Кол-во часов |
| Тема 1. Самый распространенный элемент в природе (4ч)
|
| 1 |
| Кислород в природе. Строение атома и молекулы. Изотопы кислорода. | 1 |
| 2 |
| Физические свойства кислорода. Аллотропия. Химические свойства кислорода. Оксиды | 1 |
| 3 |
| Состав воздуха. Основные загрязнители атмосферы. Охрана воздуха от загрязнителей. | 1 |
| 4 |
| Практическая работа №1 « Получение кислорода и изучение его свойств» | 1 |
| Тема 2. Рождающий воду (3ч)
|
| 5 |
| Водород в природе. Строение атома и молекулы. Изотопы водорода. | 1 |
| 6 |
| Физические и химические свойства. Гидриды. Водород – восстановитель. Получение и применение. | 1 |
| 7 |
| Практическая работа №2 «Получение водорода и изучение его свойств». | 1 |
| Тема 3. Самое необыкновенное вещество в мире (9ч)
|
| 8 |
| Строение молекулы воды. Физические свойства. Водородная связь. | 1 |
| 9 |
| Химические свойства воды. | 1 |
| 10 |
| Амфотерность воды. | 1 |
| 11 |
| Кристаллизационная вода. Кристаллогидраты. Решение задач на кристаллогидраты. | 1 |
| 12 |
| Вода – растворитель. Растворы. | 1 |
| 13 |
| Массовая доля растворенного вещества в растворе. | 1 |
| 14 |
| Решение задач разных типов с применением понятия «массовая доля» | 1 |
| 15 |
| Вода в природе. Тяжелая вода. Охрана водных ресурсов | 1 |
| 16 |
| Практическая работа №3 «Приготовление раствора с заданной массовой долей растворённого вещества из двух растворов с разной концентрацией этого вещества» | 1 |
| Тема 4. Электролитическая диссоциация (13ч)
|
| 17 |
| Электролиты и неэлектролиты. Механизмы диссоциации веществ с различным характером связи. | 1 |
| 18 |
| Диссоциация кислот, солей, оснований. Уравнения диссоциации. Реакции ионного обмена. | 1 |
| 19 |
| Кислоты в свете теории электролитической диссоциации. | 1 |
| 20 |
| Основания в свете теории электролитической диссоциации. | 1 |
| 21 |
| Соли в свете теории электролитической диссоциации. | 1 |
| 22 |
| Степень электролитической диссоциации. Константа диссоциации. Ступенчатая диссоциация. | 1 |
| 23 |
| Диссоциация воды. Водородный показатель – рН. Индикаторы. | 1 |
| 24 |
| Понятие гидролиза. Гидролиз солей. Практическое применение гидролиза. | 1 |
| 25 26 |
| Решение задач на избыток | 2 |
| 27 |
| Практическая работа №4 «Химические свойства кислот, оснований и солей в свете ТЭД» | 1 |
| 28 |
| Практическая работа №5 «Качественные реакции на ионы» | 1 |
| 29 |
| Практическая работа №6 Решение экспериментальных задач по теме « Гидролиз».
| 1 |
| Тема 5. Окислительно-восстановительные реакции (5ч)
|
| 30 |
| ОВР, протекающие в водных растворах. | 1 |
| 31 |
| Взаимодействие металлов с водой, кислотами, солями | 1 |
| 32 |
| Коррозия металлов. Виды коррозии. Защита металлов от коррозии | 1 |
| 33 |
| Электролиз расплавов и растворов. Практическое значение электролиза. | 1 |
| 34 |
| Практическая работа №7 «Химическая и электрохимическая коррозия металлов». | 1 |
| Итог |
| 34 |

 Получите свидетельство
Получите свидетельство Вход
Вход













 Программа элективного курса по химии "Самое необыкновенное вещество в мире" (0.17 MB)
Программа элективного курса по химии "Самое необыкновенное вещество в мире" (0.17 MB)
 0
0 545
545 10
10 Нравится
0
Нравится
0


