МОУ«Средняя общеобразовательная школа № 36»
Тема : Спирты
(лекция 10 кл.)
То, что вы ищите, вы найдете в самом
последнем месте.
Закон Буба

Цель лекции
Д ать понятие о спиртах, как о кислородосодержащих соединениях, ввести понятие о «функциональной группе», «водородной связи», показать взаимное влияние атомов, рассмотреть свойства спиртов и их применение.

Оборудование
Реактивы : этиловый спирт, глицерин, Na, NaOH, H 2 O.
Оборудование: спички, спиртовка, лучинка, стакан, компьютер,
проектор, экран, учебник, схемы, таблицы, штатив, пробирки.

План лекции
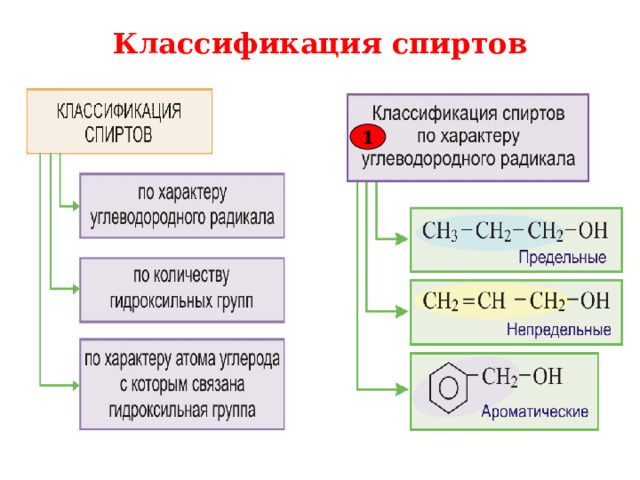
1. Классификация спиртов.
2. Номенклатура и изомерия.
3. Строение спиртов.
4. Физические свойства.
5. Водородные связи.
6. Химические свойства.
7. Получение спиртов.
8. Применение.

Многочисленную и исключительную важную группу органических соединений составляют кислородсодержащие производные УВ: спирты, фенолы, простые эфиры, альдегиды и кетоны, органические кислоты и др. Свойства каждого класса определяются наличием функциональных групп в молекулах.
Группа - OH (гидроксильная) является в молекуле спирта функциональной группой (характеристической) .
Определение: Спиртами называются производные углеводородов, в которых один или несколько атомов H заменены на гидроксильную группу OH .
Попробуем вывести общую формулу спиртов
CnH 2 n + 2 CnH 2 n + 1 OH или R- OH
Алканы Спирты
Классификация спиртов
1
Классификация спиртов
3
2

Классификация спиртов
1
В зависимости от строения углеводородного радикала различают:
Предельные
Непредельные
CH 3 - CH 2 - OH
этиловый спирт
Ароматические
CH 2 =CH- H 2- OH
амиловый спирт
C 6 H 5 - CH 2- OH
бензиловый спирт
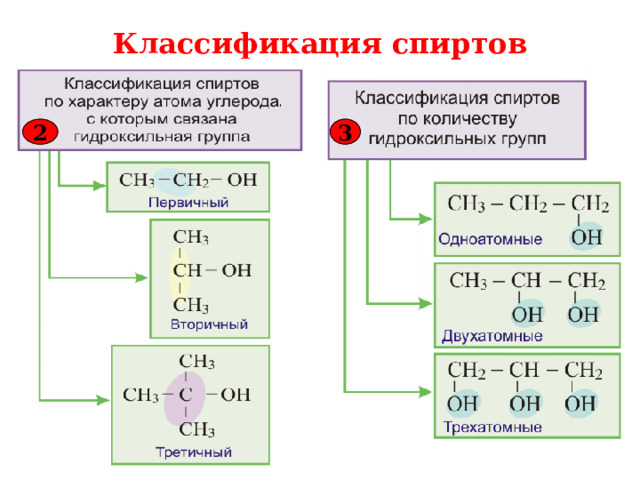
В зависимости от числа гидроксильных групп, спирты делятся на:
2
Одноатомные
CH 3 - CH 2 - OH
этиловый спирт
Двухатомные
H 2 C - CH 2
OH OH
этиленгликоль
Трёхатомные
H 2 C- CH-CH 2
OH OH OH
глицерин

В зависимости от того, при каком атоме углерода находится гидроксильная группа, различают первичные, вторичные, третичные спирты.
3
Первичные
Вторичные
R – OH
Третичные
R – CH – R′
OH
R ″
R′ – C – R″′
OH
Вывод: существует три типа классификации спиртов:
1 - по характеру углеводородного радикала (насыщенность, ароматичность);
2 - по числу гидроксильных групп;
3 - по типу связанного с гидроксильной группой атома углерода
(вторичный, третичный, четвертичный).
Все учитываемые в классификациях особенности строения молекул
спиртов определяют характерные особенности их физических и химических свойств.

Номенклатура спиртов
При наименовании отдельных спиртов широко применяются исторические названия : CH 3 – OH (древесный спирт), C 2 H 5 OH (винный спирт). По международной номенклатуре (ИЮПАК) названия спиртов составляют от названия родоначального углеводорода с прибавлением суффикса ол . Нумерация главной цепи начинается с того конца, ближе к которому находится гидроксогруппа. Например:
H 3 C-CH 2 - CH 2 - CH 2 - CH 2 - OH
пентан ол - 1
H 3 C - CH 2 - CH 2 - CH - CH 3
OH
пентан ол - 2
Многоатомные спирты это органические вещества, содержащие несколько гидроксильных групп, соединенных с углеводородным радикалом. Простейший двухатомный спирт - этиленгликоль.

По рациональной номенклатуре названия углеводородов производят от названия углеводородного радикала, связанного с гидроксильной группой, с прибавлением слова «спирт». Например:
CH 3 - OH - метиловый спирт
CH 3 - CH 2 - OH - этиловый спирт
CH 3 - CH 2 - CH 2 - OH - пропиловый спирт
CH 3 - CH 2 - CH 2 - CH 2 – OH - бутиловый спирт т.д .
Номенклатура многоатомных спиртов
(пропантриол - 1,2,3)
(этандиол -1,2)

Изомерия. Изомеры
1. Изомерия углеродного скелета
а) CH 3 - CH 2 - CH 2 - CH 2 –CH 2 - OH - пентан ол -1
б) H 3 C - CH - CH 2 - CH 2 - OH -3-метил бутан ол -1
CH 3
CH 3
в) H 3 С - C - CH 2 - OH - 2,2 -диметил пропан ол -1
CH 3
2. Изомерия функциональной группы
а) CH 3 - CH 2 - CH 2 - CH 2- CH 2 - OH - пентан ол -1
б) CH 3 -CH 2 - CH 2 - CH - CH 3 пентан ол -2
OH
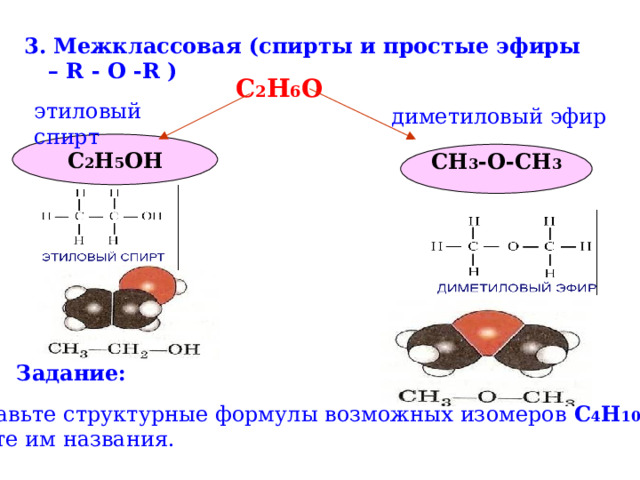
3. Межклассовая (спирты и простые эфиры – R - O -R )
С 2 Н 6 О
этиловый спирт
диметиловый эфир
С 2 Н 5 ОН
CH 3 -O-CH 3
Задание:
Составьте структурные формулы возможных изомеров С 4 Н 10 О .
Дайте им названия.

Проверка самостоятельной работы
Изомерия углеродного скелета
Изомерия функциональной группы
H 3 C- CH 2 - CH 2 - CH 2 - OH бутан ол - 1
H 3 C- CH 2- CH 2 - CH 2- OH бутан ол - 1
H 3 C - CН - CH 2 - OH
CH 3
Межклассовая
(спирты и простые эфиры
R - O -R )
H 3 C - CH 2- O - CH 2- CH 3
2-метил пропан ол - 1
H 3 C - CH 2 - CH -СH 3 OH
СH 3
H 3 C - C - CH 2- OH
CH3
2,2 – диметил пропан ол - 1
-
ди метиловый эфир
Бутан ол -2
H 3 C-CH 2- CH 2 - O- CH 3
H 3 C - CH - O - CH 3
CH 3
метил пропилолвый эфир
метил изопропиловый эфир

Строение спиртов
В молекуле этанола атомы углерода, водорода и кислорода связаны только одинарными связями. Поскольку электроотрицательность кислорода больше электроотрицательности углерода и водорода, общие электронные пары связей смещены в сторону атома кислорода.
H
δ- δ+ δ - δ +
R O H или Н C O H
H
Атом H в молекуле спирта становится более подвижным, и способным отщепляться в виде протонов.

Физические свойства
Физические свойства спиртов существенно зависят от строения углеводородного радикала и положения гидроксогруппы. Спирты бесцветны. Нейтральные соединения. Окраску индикаторов не изменяют
CH 3 OH – метон ол сильный яд!
C 1 – C 10 – жидкость
C 11 и выше – твёрдые вещества.
Спирты с C 1 – C 3 обладают резким «спиртовым» запахом, C 4 – C 6 с резким, неприятным «сивушным» запахом. Третичные спирты обладают запахом плесени.
Низшие двухатомные и трехатомные спирты: вязкие, бесцветные жидкости, не имеющие запаха, хорошо растворимы в H 2 O, обладают сладким вкусом.

Растворимость спиртов
Первые гомологи спиртов хорошо растворяются в воде, по мере усложнения углеводородного радикала растворимость уменьшается. Высшие спирты не растворимы. Почему растворимость спиртов падает? (Ответ: Увеличение массы радикала не позволяет H - связям удержать молекулу спирта в воде).
фильм № 2
фильм № 1
Вывод: 1. Этиловый спирт является хорошим растворителем.
2. С увеличением М r растворимость спиртов уменьшается.

Водородные связи
Водородная связь- своеобразная химическая связь. Она возникает между молекулами, в состав которых входит H и атомы с сильной электроотрицательностью. Например: F , O , N .
δ- δ+
H – O . . . H – O
R R
Молекулы, связанные между собой водородными связями, образуют ассоциаты (т.е. объединение молекул друг с другом). Образование ассоциатов как бы увеличивает массу спирта и понижает его летучесть. Прочность H - связей невелика (в 10 раз слабее ковалентной связи), но для их разрыва при переходе молекулы от жидкого до газообразного состояния требуется дополнительная энергия. Этим и объясняются высокие t кипения спиртов
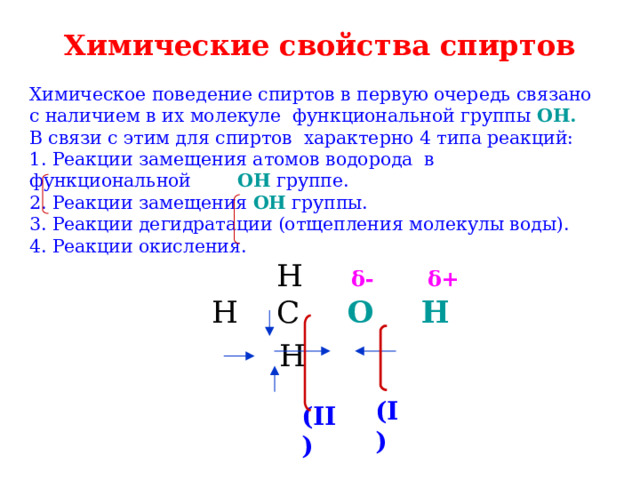
Химические свойства спиртов
Химическое поведение спиртов в первую очередь связано с наличием в их молекуле функциональной группы ОН. В связи с этим для спиртов характерно 4 типа реакций: 1. Реакции замещения атомов водорода в функциональной OH группе. 2. Реакции замещения OH группы. 3. Реакции дегидратации (отщепления молекулы воды). 4. Реакции окисления. H δ- δ+
Н C O H
H
(I)
(II)

Реакция, протекающая с разрывом связи О-Н Реакция замещения
1. Спирты, взаимодействуют с металлическим натрием, образуют алкоголяты - твердые вещества белого цвета:
в общем виде
2R – OH + 2Na 2R – ONa + H 2 ↑
2C 2 H 5 OH + 2Na 2C 2 H 5 ONa + H 2 ↑
этанол этилат натрия
R – OH + NaOH → Спирты не реагируют с щелочами.
фильм № 3

Реакция, протекающая с разрывом связи С - ОН Реакция замещения
Спирты вступают в реакции гидрогалогенирования, при этом происходит обмен всей гидроксильной группы на атом галогена.
1. Взаимодействие этанола с бромоводородом:
фильм № 4
бромоводород
этанол
бромэтан
2 . Взаимодействие метанола с хлороводородом:
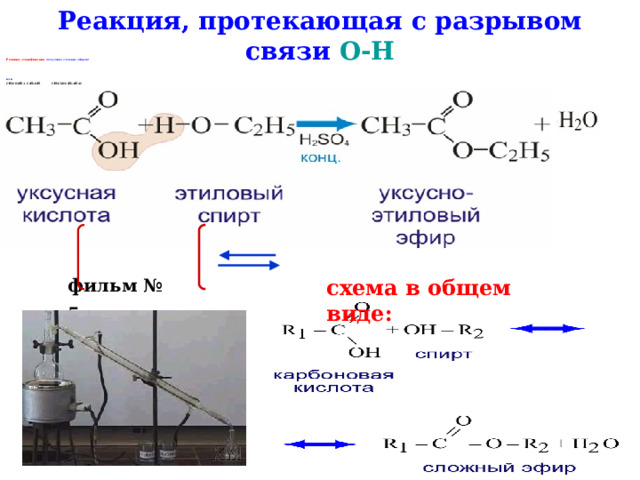
Реакция, протекающая с разрывом связи О-Н
Реакция этерификации (получение сложных эфиров)
или
СН 3 СООН + С 2 Н 5 ОН СН 3 СООС 2 Н 5 +Н 2 О
фильм № 5
схема в общем виде:

Реакции дегидратации (отнятия воды)
а) Внутримолекулярная дегидратации:
Спирты вступают в реакции дегидратации (отщепления воды), при этом происходит отрыв всей гидроксильной группы в присутствии водоотнимающих веществ (концентрированной серной кислоты).
C 2 H 5 OH C 2 H 4 + H 2 O при t больше 140 0
этанол этилен (этен)
б) Межмолекулярная дегидратация:
2C 2 H 5 OH C 2 H 5 – O – C 2 H 5 + H 2 O при t меньше 140 0
этанол диэтиловый эфир
в) Реакция Лебедева
2C 2 H 5 OH CH 2 =CH–CH=СH 2 + 2 H 2 O + Н 2
этанол бутадиен-1,3
фильм № 6
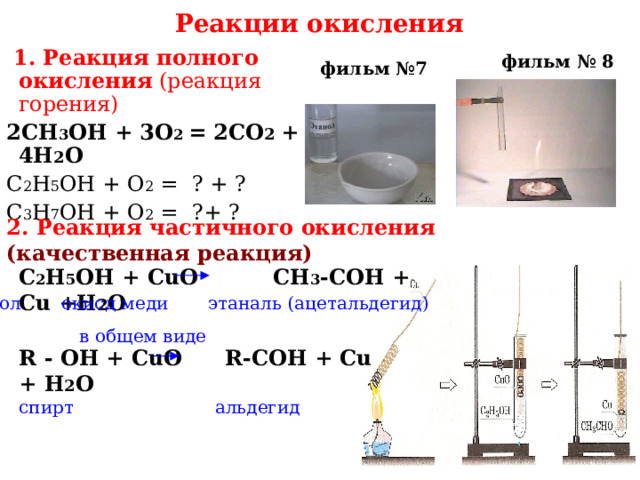
Реакции окисления
1. Реакция полного окисления (реакция горения)
2CH 3 OH + 3О 2 = 2СО 2 + 4Н 2 О
С 2 Н 5 ОН + О 2 = ? + ?
С 3 Н 7 ОН + О 2 = ?+ ?
фильм № 8
фильм №7
2. Реакция частичного окисления (качественная реакция)
С 2 Н 5 ОН + CuO CH 3 -COH + Cu + H 2 O
этанол окисд меди этаналь (ацетальдегид)
в общем виде
R - ОН + CuO R-COH + Cu + H 2 O
спирт альдегид
![Реакция окисления Окисление спиртов обычно проводят сильными окислителями - хромовой смесью или смесью перманганата калия с серной кислотой. Так первичные спирты дают сначала альдегиды , а затем кислоты с тем же числом атомов углерода. Вторичные спирты окисляются до кетонов . фильм № 11 фильм № 9 фильм № 10 С 2 Н 5 ОН + [O] CH 3 - COH уксусный альдегид или (этаналь) С 2 Н 5 ОН + [O] CH 3 - CO О H уксусная кислота (этановая кислота)](https://fsd.videouroki.net/html/2023/02/17/v_63ef421a12364/img24.jpg)
Реакция окисления
Окисление спиртов обычно проводят сильными окислителями - хромовой смесью или смесью перманганата калия с серной кислотой. Так первичные спирты дают сначала альдегиды , а затем кислоты с тем же числом атомов углерода. Вторичные спирты окисляются до кетонов .
фильм № 11
фильм № 9
фильм № 10
С 2 Н 5 ОН + [O] CH 3 - COH уксусный альдегид или (этаналь)
С 2 Н 5 ОН + [O] CH 3 - CO О H уксусная кислота
(этановая кислота)
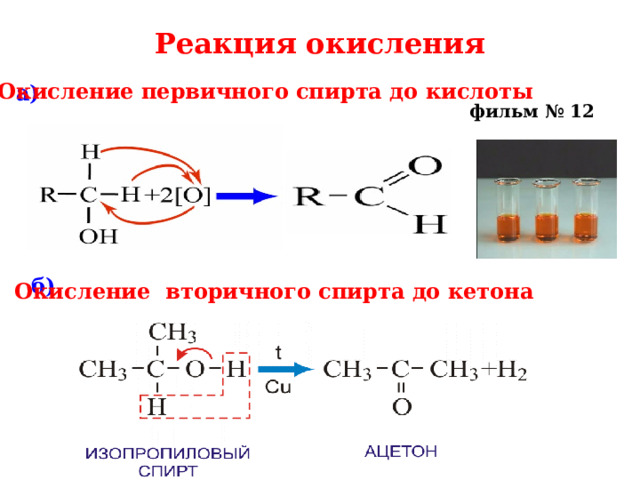
Реакция окисления
Окисление первичного спирта до кислоты
а)
фильм № 12
б)
Окисление вторичного спирта до кетона
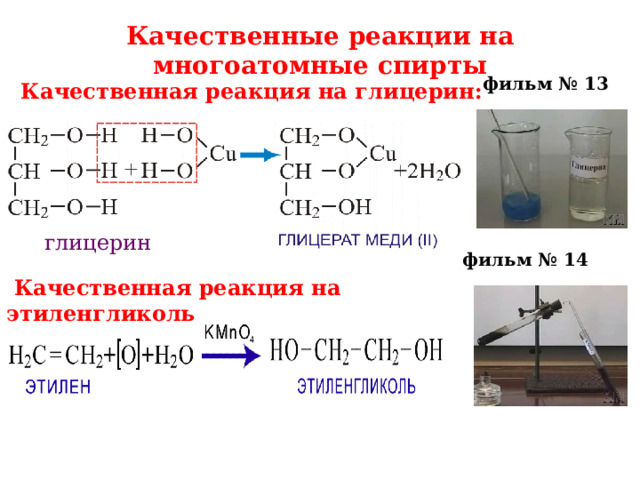
Качественные реакции на многоатомные спирты
фильм № 13
Качественная реакция на глицерин:
глицерин
фильм № 14
Качественная реакция на этиленгликоль
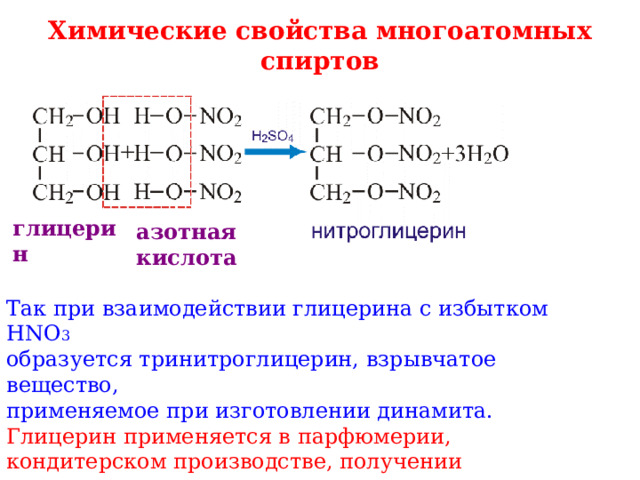
Химические свойства многоатомных спиртов
глицерин
азотная
кислота
Так при взаимодействии глицерина с избытком HNO 3
образуется тринитроглицерин, взрывчатое вещество,
применяемое при изготовлении динамита.
Глицерин применяется в парфюмерии, кондитерском производстве, получении взрывчатых веществ, полимеров.
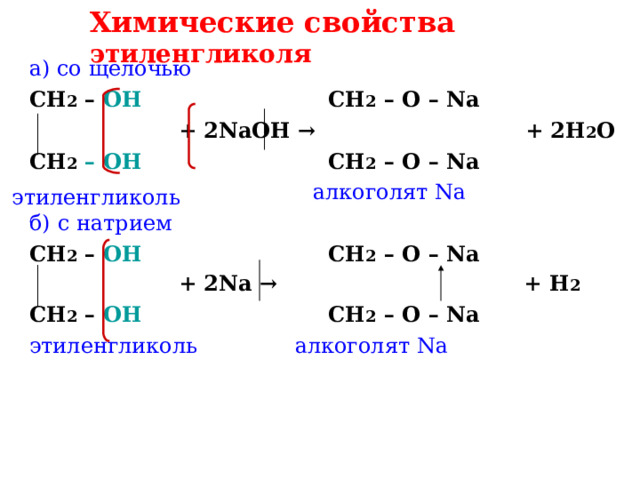
Химические свойства этиленгликоля
а) со щелочью
CH 2 – OH CH 2 – O – Na
+ 2NaOH → + 2H 2 O
CH 2 – OH CH 2 – O – Na
алкоголят Na
б) с натрием
CH 2 – OH CH 2 – O – Na
+ 2Na → + H 2
CH 2 – OH CH 2 – O – Na
этиленгликоль алкоголят Na
этиленгликоль
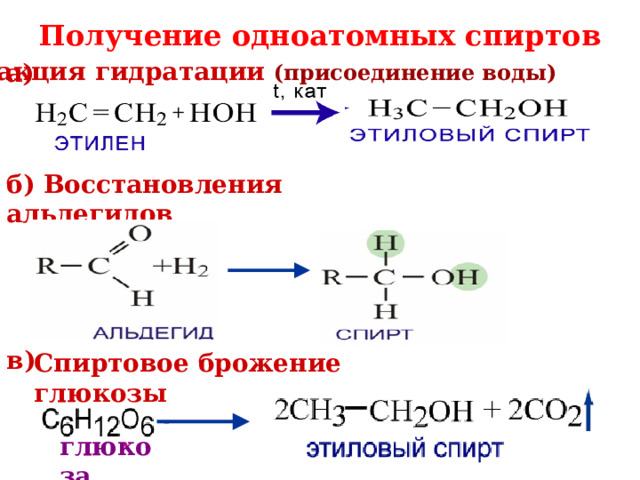
Получение одноатомных спиртов
Реакция гидратации (присоединение воды)
а)
б) Восстановления альдегидов
в)
Спиртовое брожение глюкозы
глюкоза
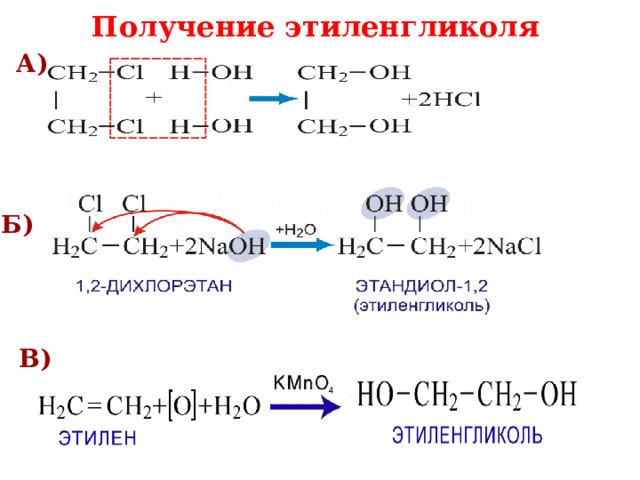
Получение этиленгликоля
А)
Б)
В)

Запомните!
Спирты – ядовитые вещества. Они отрицательно влияют на жизнедеятельность всех органов. Особенно угнетают нервную систему, свойства желудочного сока.
Демонстрационный опыт:
В стакан с C 2 H 5 OH опускаем кусочек сырого мяса. Через некоторое время мясо приобретает вид варёного. Таково действие спирта на живые ткани .
Фильм № 15

Применение спиртов
1 -производство уксусной кислоты; 2 - косметика и парфюмерия; 3 -медицинские препараты; 4 - лекарственные средства; 5 - производство сложных эфиров; 6 - лаки; 7, 8 - синтетические каучуки. Этанол используют в пищевой промышленности и в медицине.

Физиологическое действие спиртов
Этиловый спирт относится к веществам наркотического типа и оказывает угнетающее действие на центральную нервную систему человека. В организме спирт окисляется до кислых продуктов (CO 2 и H 2 O) через стадии образования ацетальдегида и уксусной кислоты. Прием спиртных напитков приводит к отравлению организма. При злоупотреблении спиртными напитками развивается хронический гастрит, цирроз печени, страдает интеллект, память, развиваются психические заболевания . Для лечения алкоголизма используют выработку отрицательных условные рефлексов, например рвотное средство - апоморфин. Механизм действия другого препарата - тетурама - основан на том, что под его влиянием задерживается процесс окисления этанола на стадии образования ацетальдегида. Накопление последнего в организме вызывает неприятные ощущения (тошнота, рвота, головная боль, чувство страха).
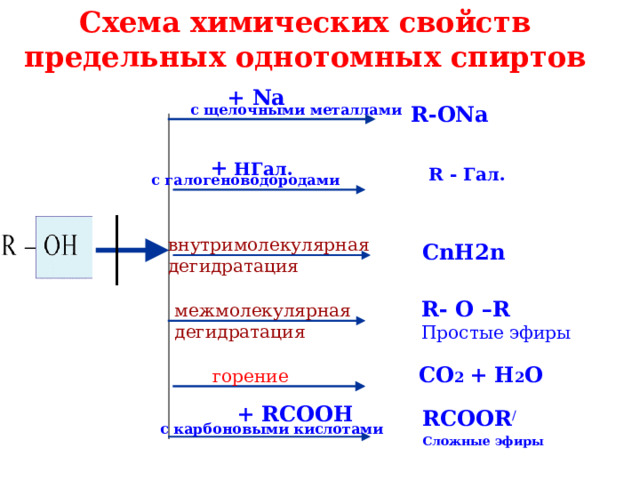
Схема химических свойств предельных однотомных спиртов
+ Na
с щелочными металлами
R-ONa
+ H Гал.
R - Гал.
с галогеноводородами
внутримолекулярная
дегидратация
С nH2n
R- O –R
Простые эфиры
межмолекулярная
дегидратация
CO 2 + H 2 O
горение
+ RCOOH
RCOOR /
Сложные эфиры
с карбоновыми кислотами

Литература
- «1C: Образовательная коллекция. Органическая химия. 10-11 классы».
- Единая коллекция цифровых образовательных ресурсов. http :// www . edu . yar . ru
- CD Уроки химии КиМ (10-11 класс).

 Получите свидетельство
Получите свидетельство Вход
Вход











 Презентация по теме: "Спирты" (2.28 MB)
Презентация по теме: "Спирты" (2.28 MB)
 0
0 2568
2568 51
51 Нравится
0
Нравится
0



