
Агрегатные состояния вещества
Водяной пар
Лёд
Вода
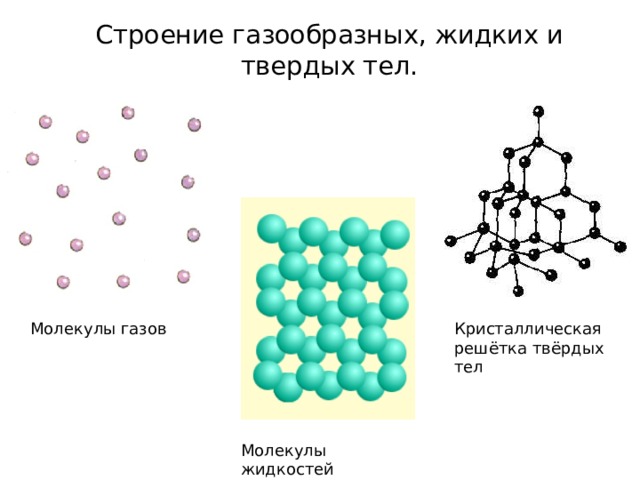
Строение газообразных, жидких и твердых тел.
Молекулы газов
Кристаллическая решётка твёрдых тел
Молекулы жидкостей

Свойства газов
- Объём и форму не сохраняют.
- Расстояние между молекулами большое, во много раз больше самих молекул .
- Легко сжимаемы.
- Молекулы газов совершают беспорядочное движение, поэтому заполняют собой весь предоставленный им объём.
- При повышении температуры расширяются. Если сосуд отсутствует, то расширяются неограниченно.

Свойства твердых тел
- Объём и форму сохраняют
- Молекулы соединены кристаллической решеткой
- Сильное взаимодействие между молекулами
- Сжатие почти невозможно
Аморфные тела
- Не имеют кристаллическую решетку
- Не имеют температуры плавления
- Обладают текучестью
- Изотропны

Свойства жидких тел
- Объем сохраняют
- Форму не сохраняют
- Сжатие почти не возможно
- Значительные взаимодействия между молекулами
- Не могут далеко удаляться друг от друга.

Испарение
Испарение — процесс фазового перехода вещества из жидкого состояния в парообразное или газообразное, происходящий на поверхности вещества. Важным фактором испарения является площадь поверхности жидкости, с которой происходит испарение: из узкого стакана оно будет происходить медленнее, чем из широкой тарелки.

Сублимация(возгонка)
Испарение твердого тела называется сублимацией (возгонкой).
Вывешенное на мороз влажное белье через несколько минут замерзает и становится жестким как лист картона или фанеры. Однако через двое-трое суток оно уже совершенно свободно от льда – мягкое, эластичное и практически сухое. Лед перешел из твердой кристаллической фазы непосредственно в пар, минуя плавление. Такое «сухое» испарение называется сублимацией, или возгонкой.

Сублимация в кометах
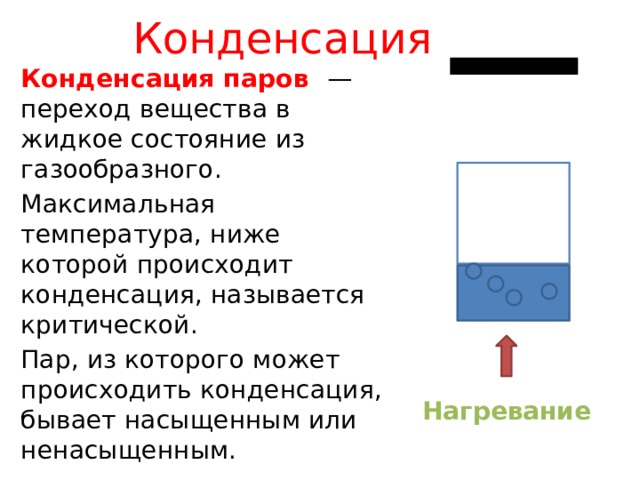
Конденсация
Конденсация паров — переход вещества в жидкое состояние из газообразного.
Максимальная температура, ниже которой происходит конденсация, называется критической.
Пар, из которого может происходить конденсация, бывает насыщенным или ненасыщенным.
Нагревание

Насыщенный пар (водяной)
Пар, находящийся в динамическом равновесии со своей жидкостью, называют насыщенным паром. Жидкость в закрытом сосуде вначале будет испаряться и плотность пара над ней будет увеличиваться. Однако чем больше молекул покидает жидкость, тем больше возвращаются. Чем больше плотность пара, тем больше молекул возвращаются в жидкость. При постоянной температуре в закрытом сосуде в результате установится динамическое равновесие т.е в среднем, количество молекул, покинувших жидкость, равно количеству молекул, вернувшихся в жидкость.

Кипение
Кипение — процесс интенсивного парообразования, который происходит как со свободной поверхности жидкости, так и внутри неё. При этом в объёме жидкости возникают границы разделения фаз, то есть на стенках сосуда образуются пузырьки, которые содержат воздух и насыщенный пар. Кипение, как и испарение, является одним из способов парообразования.
Критическая температура – это температура, при которой исчезают различия в физических свойствах между жидкостью и её насыщенным паром.
Пар имеющий температуру ниже критической – ненасыщенный пар .
Температура кипения жидкостей зависит от внешнего давления , чем оно больше, тем больше температура кипения.
Температура кипения некоторых веществ
Водород
Спирт
-253℃
Вода
78℃
Ртуть
100℃
357℃

Плавление
Плавление вещества − переход вещества из твердого состояния в жидкое. Этот фазовый переход всегда сопровождается поглощением энергии, т. е. к веществу необходимо подводить теплоту. Плавление происходит только при определенной температуре, называемой температурой плавления. Каждое вещество имеет свою температуру плавления. Пока происходит плавление, температура вещества не изменяется.

Кристаллизация
Кристаллизация (затвердевание) вещества − переход вещества из жидкого состояния в твердое. Это процесс, обратный плавлению.
Кристаллизация всегда сопровождается выделением энергии, т. е. от вещества необходимо отводить теплоту.
Она происходит только при определенной температуре, совпадающей с температурой плавления.
Пока происходит кристаллизация, температура вещества не изменяется.

Интересный парадокс

Домашнее задание
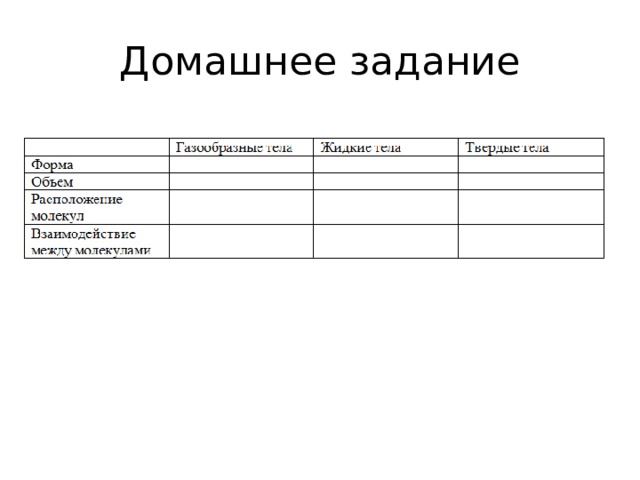
Домашнее задание

 Получите свидетельство
Получите свидетельство Вход
Вход












 Презентация на тему "Агрегатные состояния вещества и их свойства" (2.11 MB)
Презентация на тему "Агрегатные состояния вещества и их свойства" (2.11 MB)
 0
0 1593
1593 175
175 Нравится
0
Нравится
0





