
Карбоновые
кислоты

Карбоновые кислоты -
это органические
вещества, молекулы которых содержат одну или
несколько карбоксильных групп, соединенных с
углеводородным радикалом или водородным атомом.
O
С
- карбоксильная группа
OH
 С=О гидроксил OH O R C O H " width="640"
С=О гидроксил OH O R C O H " width="640"
Карбоксильная группа содержит две функциональные группы - и, непосредственно связанные друг с другом:
карбонил С=О
гидроксил OH
O
R
C
O
H

Электронное строение
б-
O
1.Электронная плотность сдвигается в сторону кислорода
б+
C
R
б+
2.Атом углерода приобретает положительный заряд
O
H
“
3. В результате этот атом углерода притягивает к себе электронную пару от атома кислорода
4. Компенсирую смещенную эл. плотность, атом кислорода оттягивает к себе эл. пару соседнего водорода
Вывод : связь гидроксильной группе становится более полярной и атом водорода приобретает большую подвижность

- Общая формула R-СООН
R – углеводородный радикал
-СООН – карбоксильная группа
(функциональная)
- С n H 2n+1 COOH – общая формула для предельных одноосновных кислот
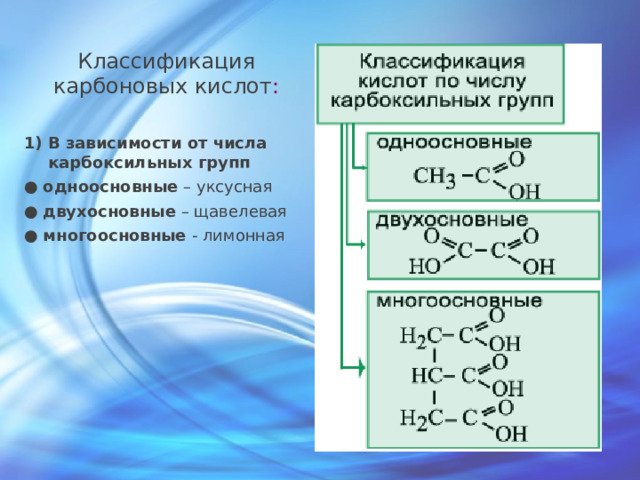
Классификация карбоновых кислот :
- В зависимости от числа карбоксильных групп
● одноосновные – уксусная
● двухосновные – щавелевая
● многоосновные - лимонная
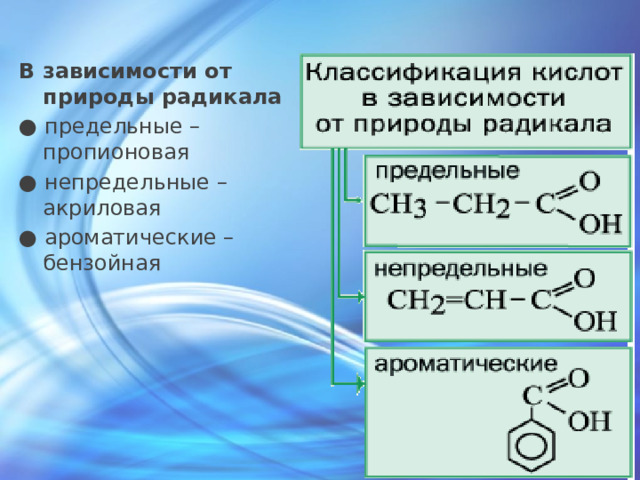
В зависимости от природы радикала
● предельные – пропионовая
● непредельные – акриловая
● ароматические – бензойная
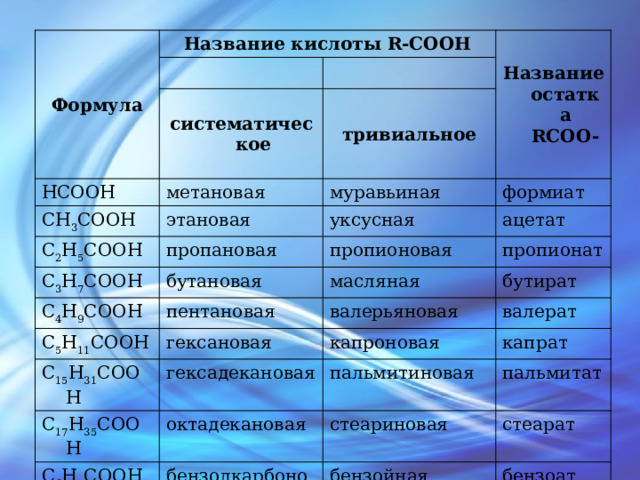
Формула
Название кислоты R-COOH
Название остатка RCOO-
HCOOH
систематическое
CH 3 COOH
тривиальное
метановая
C 2 H 5 COOH
этановая
муравьиная
формиат
пропановая
C 3 H 7 COOH
уксусная
C 4 H 9 COOH
ацетат
пропионовая
бутановая
C 5 H 11 COOH
пентановая
масляная
пропионат
бутират
C 15 H 31 COOH
валерьяновая
гексановая
гексадекановая
C 17 H 35 COOH
капроновая
валерат
капрат
пальмитиновая
октадекановая
C 6 H 5 COOH
пальмитат
стеариновая
бензолкарбоновая
CH 2 =СH-COOH
стеарат
бензойная
пропеновая
бензоат
акриловая
акрилат

Предельные карбоновые кислоты
НСООН Муравьиная, или метановая
Жидкость с резким запахом, температура кипения 100,8 °, хорошо растворима в воде, ядовита, вызывает ожоги, обладает дезинфицирующим действием

Муравьиную кислоту выделяют:
1 – медуза
2 – крапива
3 – муравей


СН 3 СООН Уксусная или этановая
Бесцветная жидкость, характерный запах, растворима в воде, хороший растворитель многих органических веществ, опасна при попадании на кожу.
Водные растворы:
3-5% раствор - «столовый уксус»
70-80% раствор - «уксусная эссенция»


Назовите вещество
3-метилпентановая кислота
СH 3 – СH 2 – СH – СH 2 – С
О
ОН
СН 3

Изомерия карбоновых кислот.
Cтруктурная изомерия: изомерия скелета в углеводородном радикале (начиная с C 4 ). межклассовая изомерия , начиная с C 2 . Например, формуле C 2 H 4 O 2 соответствуют 3 изомера, относящиеся к различным классам органических соединений.
Пространственная изомерия: Возможна цис-транс изомерия в случае непредельных карбоновых кислот. Например:

Физические свойства.
- Низшие карбоновые кислоты
- жидкости с острым запахом
- хорошо растворимые в воде
- с ↑ относ. молекул. массы растворимость ↓,
а t кип ↑
- Высшие кислоты (начиная с пеларгоновой (нонановой) CH 3 – (CH 2 ) 7 – COOH )
- твердые вещества
- без запаха
- нерастворимые в воде

Химические свойства.
Взаимодействие с
- металлами (до водорода)
2HCOOH + Mg (HCOO) 2 Mg + H 2 ↑
- основными и амфотерными оксидами
2HCOOH + MgO (HCOO) 2 Mg + H 2 O
- основаниями и амфотерными гидроксидами
2HCOOH + Mg(OH) 2 (HCOO) 2 Mg + 2H 2 O
- солями
2HCOOH + Na 2 SiO 3 2HCOONa + H 2 SiO 3 ↓
2CH 3 COOH + Na 2 CO 3 2CH 3 COONa + H 2 O + CO 2 ↑
Органические кислоты вступают в реакцию этерификациии со спиртами,
образуя сложные эфиры, согласно уравнению
O
O
R C + H OR′ = R C + H 2 O
OH
O R′
кислота спирт сложный эфир
CH 3 COOH + C 2 H 5 OH = CH 3 COOC 2 H 5 + H 2 O
уксусная кислота этиловый спирт этилацетат

Cl
Cl
2
Cl
Кроме реакции этерификации, для карбоновых кислот существует реакция замещения галогенами атомов водорода в радикале. Замещение протекает при 2-м атоме углерода и происходит на катализаторе.
Данная реакция является промежуточной для получения аминокислот.


Получение.
в промышленности
в лаборатории
(см. таблицу)
из солей, действуя
на них серной кислотой
при нагревании
O
O
t
2CH 3 C + H 2 SO 4 Na 2 SO 4 + 2CH 3 C
O H
O Na
ацетат натрия
уксусная кислота
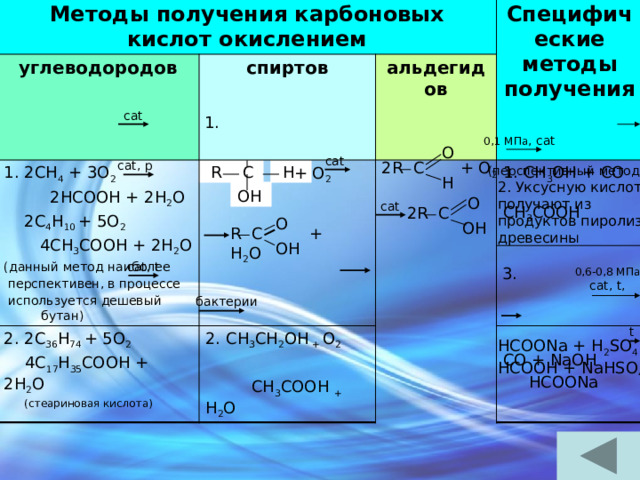
Методы получения карбоновых кислот окислением
углеводородов
спиртов
1. 2CH 4 + 3O 2
2HCOOH + 2H 2 O
Специфические методы получения
альдегидов
2C 4 H 10 + 5O 2
2. 2C 36 H 74 + 5O 2
2. CH 3 CH 2 OH + O 2
1. CH 3 OH + CO
4CH 3 COOH + 2H 2 O
4C 17 H 35 COOH + 2H 2 O
CH 3 COOH
(данный метод наиболее
(стеариновая кислота)
CH 3 COOH + H 2 O
перспективен, в процессе
CO + NaOH
используется дешевый бутан)
HCOONa
cat
1.
0,1 МПа , cat
H
O
cat
2R C + O 2
cat, p
H
R
C
(перспективный метод)
+ O 2
H
2. Уксусную кислоту
получают из
продуктов пиролиза
древесины
OH
O
cat
2R C
O
OH
R C + H 2 O
OH
cat, t
3.
0,6-0,8 МПа
cat, t,
бактерии
t
HCOONa + H 2 SO 4
HCOOH + NaHSO 4

Решить цепочку превращений
1 вариант:
CH 3 OH HCHO X HCOOC 2 H 5
2 вариант:
С 2 Н 6 C 2 H 5 Br X CH 2 = CH 2

Ресурсы
- Габриелян О.С. Химия. 10 класс. Базовый уровень: учебник, базовый уровень – М.: Дрофа, 2007.
- Химия. 10 класс. Базовый уровень: учебник / Под ред. В.И. Тренина. – М.: Дрофа, 2002.
- Смолина Т.А. Практические работы по органической химии: Малый практикум. – М.: Просвещение, 1986.
- CD – Органическая химия. 10-11классы. Лаборатория систем мультимедиа, МарГТУ, 2003.
- CD – Химия (8-11 класс). Виртуальная лаборатория. Лаборатория систем мультимедиа, МарГТУ, 2004.
- CD – Химия. Интерактивный тренинг – подготовка к ЕГЭ. Новая школа, 2007.
- CD – Химия. Базовый курс. Лаборатория систем мультимедиа, МарГТУ, 2003.

 Получите свидетельство
Получите свидетельство Вход
Вход











 Презентация карбоновые кислоты (600.66 KB)
Презентация карбоновые кислоты (600.66 KB)
 0
0 1056
1056 43
43 Нравится
1
Нравится
1


