
Щелочные металлы
СПБ ГБПОУ «ИПЛ»
Коротеева О.В .
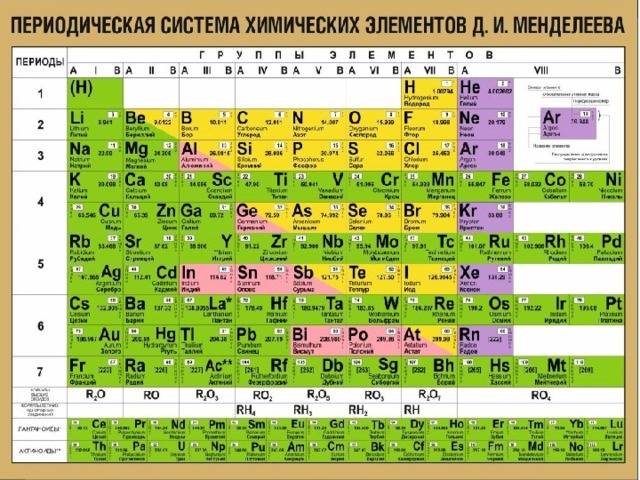
Металли-ческие свойства
Восстано-вительные свойства
R атома
Содержат один электрон на внешнем энергетическом уровне.
УСИЛИВАЮ
Т
С
Я
УВЕ
Л
И
Ч
И
В
А
Е
Т
С
Я
УСИЛИВАЮТСЯ
Na
Для всех щелочных металлов характерны восстановительные свойства.


ЩЕЛОЧНЫЕ МЕТАЛЛЫ В ПРИРОДЕ
Натрий и калий широко распространены в природе в виде солей. Соединения других щелочных металлов встречаются редко.
- NaCl – поваренная (каменная) соль
- Na 2 SO 4 ∙ 10H 2 O – глауберова соль
- KCl ∙ NaCl – сильвинит
- KCl ∙ MgCl 2 ∙ 6H 2 O - карналлит

БИОЛОГИЧЕСКАЯ РОЛЬ И ПРИМЕНЕНИЕ
Карбона́т ка́лия ( углеки́слый калий , пота́ш )
K2CO3
Применяют для изготовления жидкого мыла, хрустального или тугоплавкого стекла, крашения, выращивания сельскохозяйственных культур (соли калия являются хорошим удобрением для растений), для фотодела, в качестве добавки в строительный раствор для уменьшения температуры замерзания (правда, потом могут выделяться белые пятна, поэтому сейчас появляются специальные противоморозные присадки, не дающие разводов). Используется как противозамерзающая добавка в бетоне.
Зарегистрирован в качестве пищевой добавки E501 .

Гидрокарбонат натрия NaHCO 3 (другие названия: питьевая сода, пищевая сода, бикарбонат натрия, натрий двууглекислый)
Карбона́т на́трия Na 2 CO 3
Карбонат натрия используют в стекольном производстве; мыловарении и производстве стиральных и чистящих порошков; эмалей, для получения ультрамарина. Также он применяется для смягчения воды паровых котлов и вообще уменьшения жёсткости воды, для обезжиривания металлов и десульфатизации доменного чугуна.
Применение:
- в химической промышленности — для производства красителей, пенопластов и других органических продуктов, фтористых реактивов, товаров бытовой химии, наполнителей в огнетушителях.
- в легкой промышленности — в производстве подошвенных резин и искусственных кож, кожевенном производстве (дубление и нейтрализация кож), текстильной промышленности (отделка шелковых и
хлопчатобумажных тканей).
- в пищевой промышленности —
хлебопечении, производстве кондитерских изделий,
приготовлении напитков.

ПРОВЕРЬ СЕБЯ :
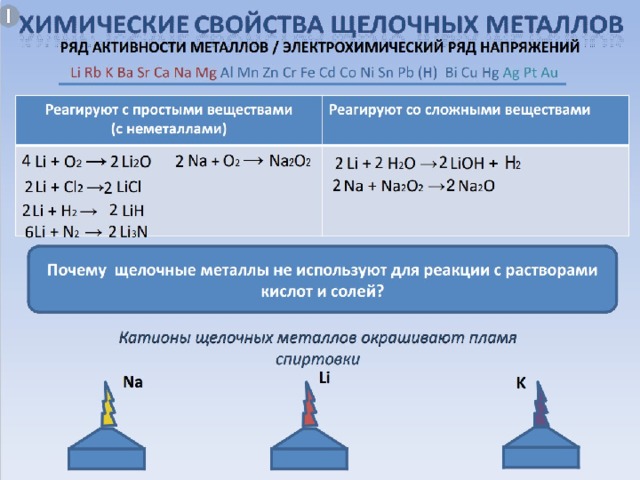
ВЫЧЕРКНИТЕ НЕВЕРНОЕ СУЖДЕНИЕ О ЩЕЛОЧНЫХ МЕТАЛЛАХ:
- Число электронов на внешнем энергетическом уровне равно 1.
- В реакциях щелочные металлы являются окислителями и восстановителями.
- При взаимодействии натрия с кислородом образуется пероксид натрия.
- Щелочные металлы не взаимодействуют с водой.
- Щелочные металлы – это металлы IА группы Периодической системы Д.И.Менделеева.
- Щелочные металлы получают электролизом расплавов их солей.
- При переходе от лития к калию уменьшается радиус атома.
- Качественной реакцией на ионы щелочных металлов является их взаимодействие с кислородом.

ПРОВЕРЬ СЕБЯ :
ВЫЧЕРКНИТЕ НЕВЕРНОЕ СУЖДЕНИЕ О ЩЕЛОЧНЫХ МЕТАЛЛАХ:
- Число электронов на внешнем энергетическом уровне равно 1.
- В реакциях щелочные металлы являются окислителями и восстановителями.
- При взаимодействии натрия с кислородом образуется пероксид натрия.
- Щелочные металлы не взаимодействуют с водой.
- Щелочные металлы – это металлы IА группы Периодической системы Д.И.Менделеева.
- Щелочные металлы получают электролизом расплавов их солей.
- При переходе от лития к калию уменьшается радиус атома.
- Качественной реакцией на ионы щелочных металлов является их взаимодействие с кислородом.

ДОМАШНЕЕ ЗАДАНИЕ:
- § 11
- Выполнить цепочку химических превращений:
Na → Na 2 O 2 → Na 2 O → Na 2 CO 3
↓
NaOH → NaCl

СПАСИБО ЗА УРОК!


 Получите свидетельство
Получите свидетельство Вход
Вход























 Презентация по химии «Щелочные металлы» (2.2 MB)
Презентация по химии «Щелочные металлы» (2.2 MB)
 0
0 902
902 6
6 Нравится
0
Нравится
0










