План урока:
1. Сравнительная характеристика металлов и неметаллов.
2. Что такое аллотропия? Примеры аллотропных модификаций.
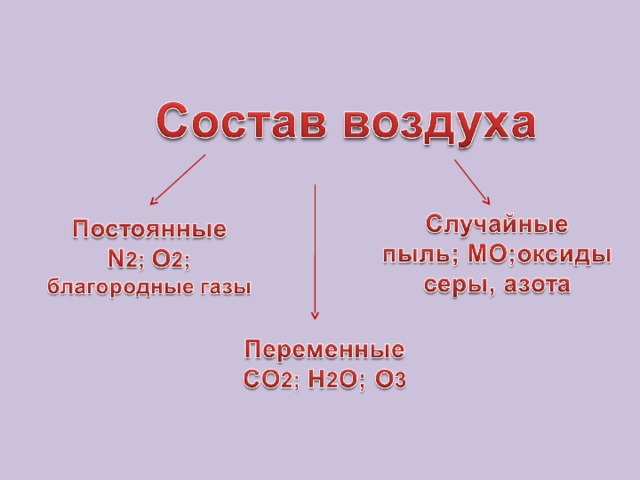
3. Состав воздуха.

Аллотропия – способность атомов одного химического элемента образовывать несколько простых веществ
Проверка знаний
Что можно сказать о количестве неМе по сравнению с Ме?
У каких элементов радиус атомов меньше; какое влияние это оказывает на их свойства? Какую роль выполняют эти элементы в химических реакциях?
В каких агрегатных состояниях находятся атомы неМе? Приведите примеры.
В каких интервалах колеблются температуры плавления неМе?
Какие типы кристаллических решеток характерны для неМе? Какие свойства неМе связаны со строением кристаллических решеток?
Дайте сравнительную характеристику кислорода и озона.
Какие химические вещества преобладают в воздухе? Укажите их процентное содержание по объему.
Какова роль воздуха?

 Получите свидетельство
Получите свидетельство Вход
Вход




















 Презентация по химии "Неметаллы" (3.15 MB)
Презентация по химии "Неметаллы" (3.15 MB)
 0
0 1591
1591 114
114 Нравится
0
Нравится
0