
СПИРТЫ

Содержание
1. Спирты
2. Классификация спиртов
3. Изомерия спиртов
4. Физические и химические
свойства спиртов
5. Типы реакций
6. Окисление

СПИРТЫ
C x H y (OH) n
- Спиртами называются органические вещест-ва, молекулы которых содержат одну или несколько гидроксильных групп, связанных с углеводородным радикалом.
- Спиртами называются органические вещест-ва, молекулы которых содержат одну или несколько гидроксильных групп, связанных с углеводородным радикалом.
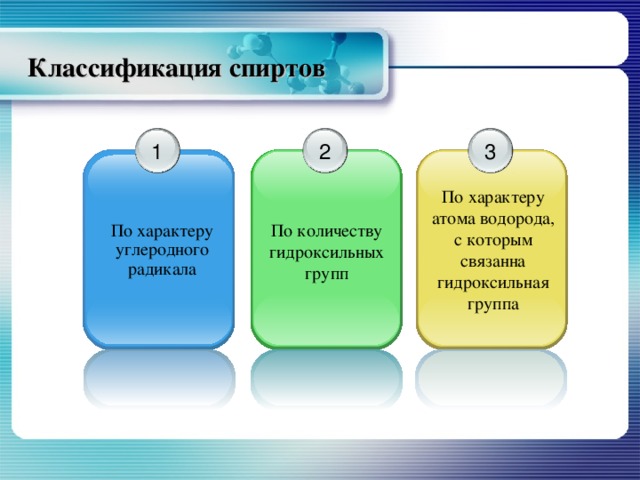
Классификация спиртов
1
3
2
По характеру атома водорода, с которым связанна гидроксильная группа
По количеству гидроксильных групп
По характеру углеродного радикала
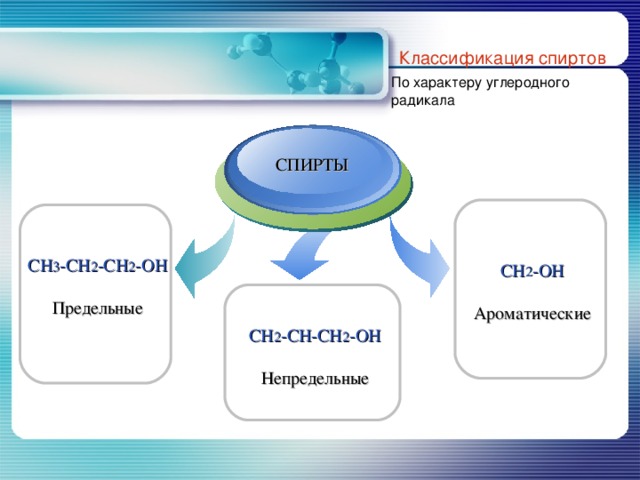
Классификация спиртов
По характеру углеродного радикала
Title
Add your text
СПИРТЫ
CH 3 -CH 2 -CH 2 -OH
Предельные
CH 2 -OH
Ароматические
CH 2 - CH-CH 2 -OH
Непредельные
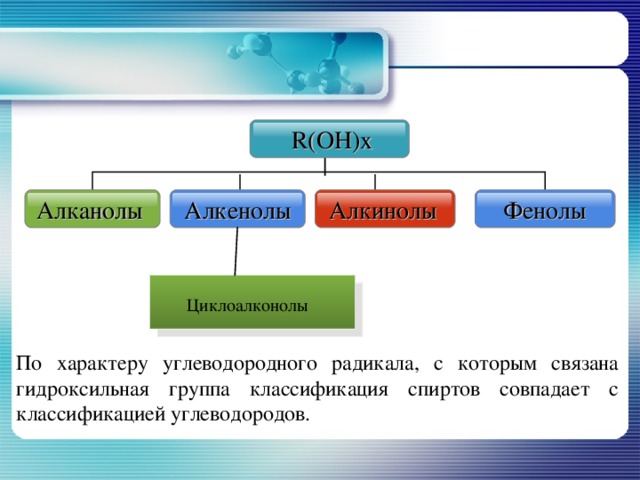
R ( OH ) x
Алканолы
Алкенолы
Фенолы
Алкинолы
Циклоалконолы
По характеру углеводородного радикала, с которым связана гидроксильная группа классификация спиртов совпадает с классификацией углеводородов.
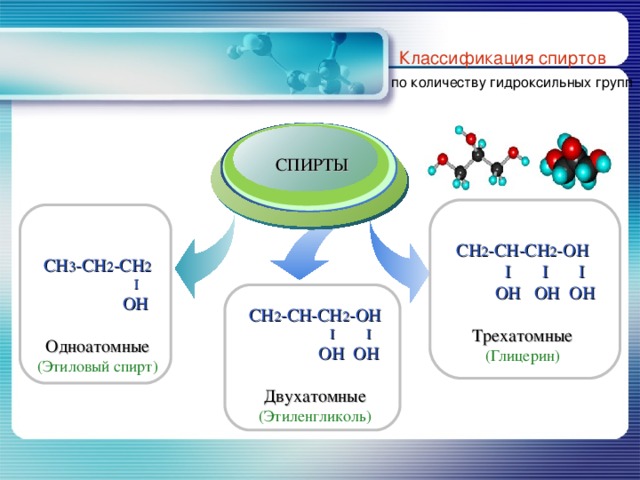
Классификация спиртов
по количеству гидроксильных групп
Title
Add your text
СПИРТЫ
CH 2 - CH-CH 2 -OH
I I I
OH OH OH
Трехатомные
(Глицерин)
CH 3 -CH 2 -CH 2
I
OH
Одноатомные
(Этиловый спирт)
CH 2 - CH-CH 2 -OH
I I
OH OH
Двухатомные
(Этиленгликоль)
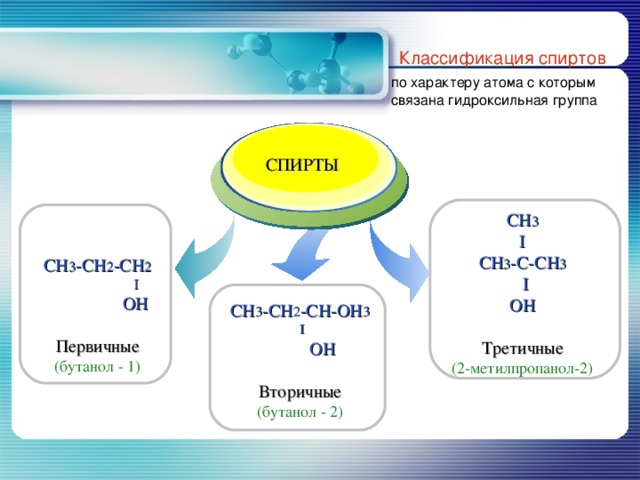
Классификация спиртов
по характеру атома с которым связана гидроксильная группа
Title
Add your text
СПИРТЫ
CH 3
I
CH 3 -C- С H 3
I
OH
Третичные
(2-метилпропанол-2)
CH 3 -CH 2 -CH 2
I
OH
Первичные
(бутанол - 1)
CH 3 - CH 2 -CH-OH 3
I
OH
Вторичные
(бутанол - 2)

CH 3 - OH - метан ол
Метиловый спирт
Этиловый спирт
C 2 H 5 - OH - этан ол
Пропиловый спирт
СН 3 -СН 2 -СН 2 -ОН - пропан ол
Бутиловый спирт
СН 3 -СН 2 -СН 2 -СН 2 -ОН - б утан ол
Алканолы образуют гомологический ряд общей формулы C n H 2n+1 OH ( n= 1,2,3,: N) . Названия алканолов по систематичес-кой номенклатуре строятся из названий соответствующих ал- канов путём добавления суффикса «ол»
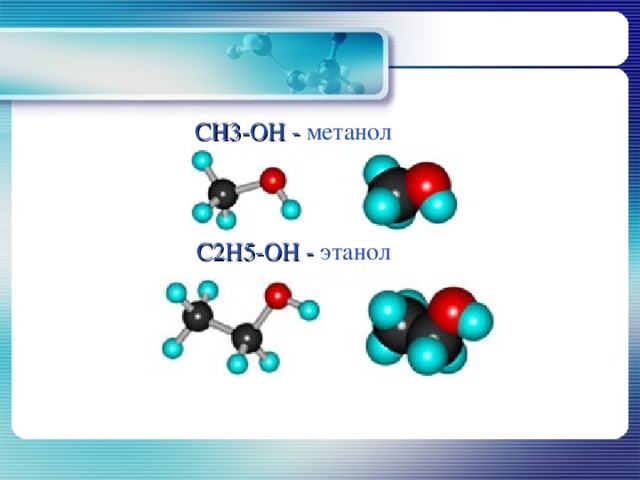
CH3 - OH - метанол
C2H5 - OH - этанол

Изомерия спиртов
Для алканолов характерны два вида изомерии:
изомерия положения гидроксильной
группы в углеродной цепи
Алканы
изомерия углеродного скелета.
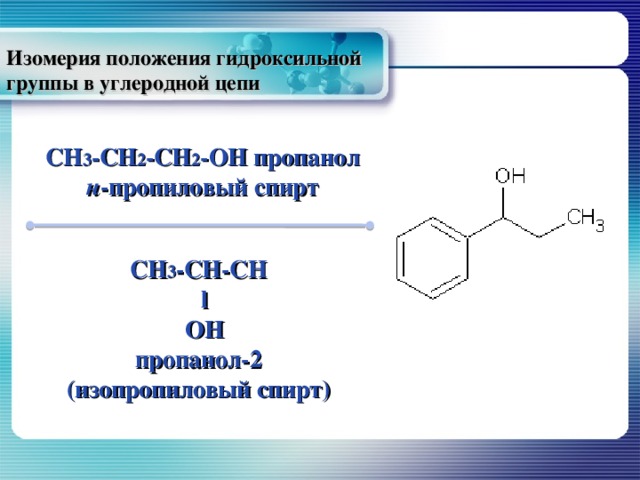
Изомерия положения гидроксильной группы в углеродной цепи
CH 3 -CH 2 -CH 2 -OH пропанол
н -пропиловый спирт
CH 3 -CH-CH
l
OH
пропанол-2
(изопропиловый спирт)

Изомерия углеродного скелета
CH 3 -CH 2 -CH 2 -CH 2 -OH бутанол-1 ( н -бутиловый спирт)
CH 3 -CH-CH 2 -OH
l
CH 3
2- метилпропанол-1
(изобутиловый спирт)
Первым из спиртов, для которого характерны оба вида изомерии, является бутанол

Физические свойства спиртов
Алканолы являются бесцветными жидкостями или кристаллическими веществами с характерным запахом. Первые члены гомологического ряда имеют приятный запах, для бутанолов и пентанолов запах становится неприятным и раздражающим. Высшие алканолы имеют приятный ароматный запах.
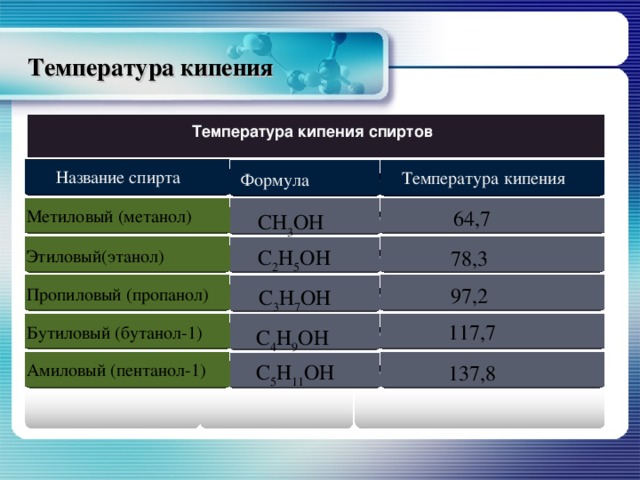
Температура кипения
Температура кипения спиртов
Название спирта
Температура кипения
Формула
64,7
Метиловый (метанол)
СН 3 ОН
С 2 Н 5 ОН
78,3
Этиловый(этанол)
97,2
Пропиловый (пропанол)
С 3 Н 7 ОН
117,7
Бутиловый (бутанол-1)
С 4 Н 9 ОН
С 5 Н 11 ОН
Амиловый (пентанол-1)
137,8
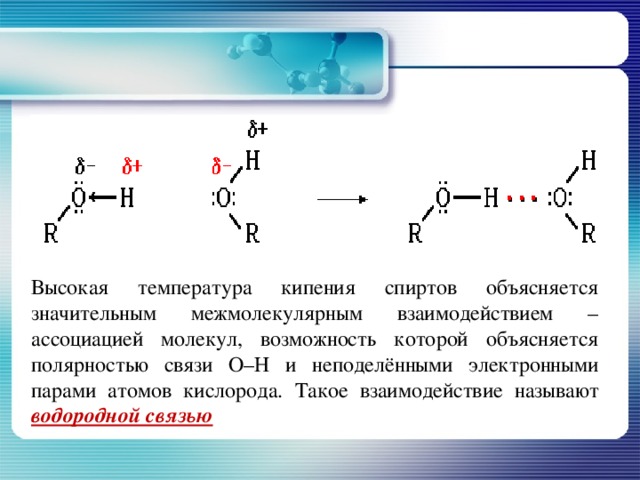
Высокая температура кипения спиртов объясняется значительным межмолекулярным взаимодействием – ассоциацией молекул, возможность которой объясняется полярностью связи О–Н и неподелёнными электронными парами атомов кислорода. Такое взаимодействие называют водородной связью

Строение молекулы этанола
В молекуле этанола атомы углерода, водорода и кислорода связаны только одинарными - связями. По-скольку электроотрицательность кислорода больше электроотрица-тельности углерода и водорода, общие электронные пары связей С–О и О – Н смещены в сторону атома кислорода. На нём возникает частичный отрицательный, а на атомах углерода и водорода частичные положительные заряды.
Н Н
| | δ-
Н – С – С О Н
| |
Н Н
Химические свойства спиртов
Реакционная способность спиртов обусловлена наличием в их молекулах полярных связей, способных разрываться по гетеролитическому механизму .
Спирты проявляют слабые кислотно – основные свойства
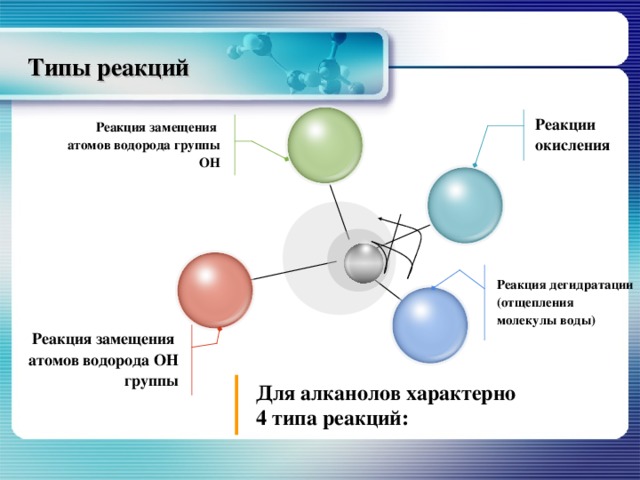
Типы реакций
Реакции окисления
Реакция замещения атомов водорода группы ОН
Реакция дегидратации (отщепления молекулы воды)
Реакция замещения атомов водорода ОН группы
Для алканолов характерно 4 типа реакций:

Реакция замещения водорода -ОН группы
С 2 Н 5 ОН + Na → C 2 H 5 ONa + H 2
C 2 H 5 ONa + H 2 O → C 2 H 5 OH + NaOH
Как слабые кислоты алканолы могут реагировать со щелочными металлами. Образующиеся при этом металлические производные спиртов называются алкоголятами .

Реакция замещения –ОН группы
Наибольшее практическое значение из реакций второго типа имеют реакции замещения гидроксильной группы на галогены. Данная реакция может осуществляться при действии на алканолы различных галогеноводородных кислот
 R 2 CH – OH RCH 2 – OH Реакционная способность HX HI HBr HCl HF Реакция алканолов с галогеноводородными кислотами является обратимой. Эффективность её протекания зависит от строения алканола, природы галогеноводорода и условий проведения. Наиболее активными в данной реакции являются третичные алканолы и иодоводородная кислота " width="640"
R 2 CH – OH RCH 2 – OH Реакционная способность HX HI HBr HCl HF Реакция алканолов с галогеноводородными кислотами является обратимой. Эффективность её протекания зависит от строения алканола, природы галогеноводорода и условий проведения. Наиболее активными в данной реакции являются третичные алканолы и иодоводородная кислота " width="640"
Реакции алканолов
R – OH + H – X ↔ R – X + H 2 O
Реакционная способность алканолов
R 3 С – OH R 2 CH – OH RCH 2 – OH
Реакционная способность HX
HI HBr HCl HF
Реакция алканолов с галогеноводородными кислотами является обратимой. Эффективность её протекания зависит от строения алканола, природы галогеноводорода и условий проведения. Наиболее активными в данной реакции являются третичные алканолы и иодоводородная кислота

Реакция дегидратации
Для алканолов характерно два типа реакции дегидратации:
- внутримолекулярная
и
- межмолекулярная
При внутримолекулярной дегидратации обра- зуются алкены, при межмолекулярной - простые эфиры.

Внутримолекулярная дегидратация алканолов может осуществляться при нагревании их с избытком концентрированной H 2 SO 4 при темпе- ратуре 150-200ºС или при пропускании спиртов над нагретыми твёрдыми катализаторами.
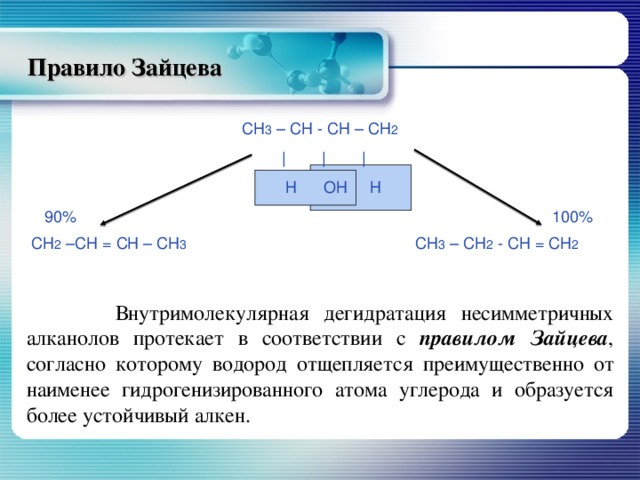
Правило Зайцева
СН 3 – СН - СН – СН 2
| | |
Н ОН Н
90% 100%
СН 2 –СН = СН – СН 3 СН 3 – СН 2 - СН = СН 2
Внутримолекулярная дегидратация несимметричных алканолов протекает в соответствии с правилом Зайцева , согласно которому водород отщепляется преимущественно от наименее гидрогенизированного атома углерода и образуется более устойчивый алкен.
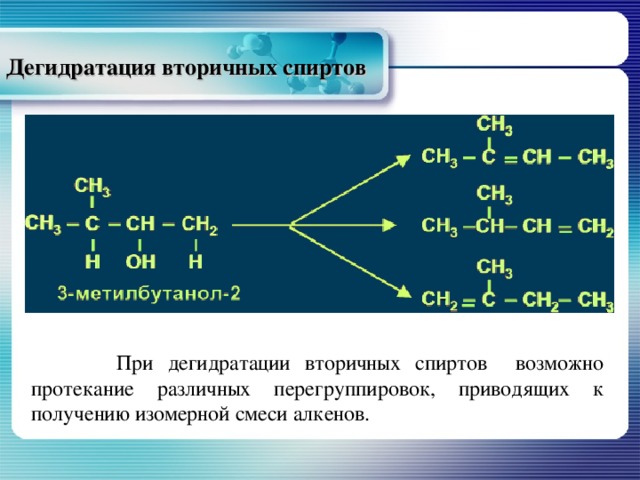
Дегидратация вторичных спиртов
При дегидратации вторичных спиртов возможно протекание различных перегруппировок, приводящих к получению изомерной смеси алкенов.

При более слабом нагревании этилового спирта с серной кислотой образуется диэтиловый эфир. Это летучая, легко воспламеняющаяся жидкость. Диэтиловый эфир относится к классу простых эфиров – органических веществ, молекулы которых состоят из двух углеводородных радикалов, соединённых посредством атома кислорода. Общая формула R – O - R
Реакции окисления
- Окисление спиртов проис-ходит и под действием силь-ных окислителей. Характер получаемых при этом продук-тов определяется степенью замещённости спиртов, а так-же природой применяемого окислителя

Кислородсодержащие органические вещества, как и углеводороды, горят на воздухе или в кислороде с образованием паров воды и углекислого газа. Горение спиртов – сильно экзотермическая реакция, поэтому они могут быть использованы в качестве высококалорийного топлива.
C n H 2n+1 OH+O 2 nCO 2 +(n+1)H 2 O+ Q

Окисление первичных спиртов до карбоновых кислот протекает при действии HNO 3 или перманганата калия в щелочной среде.
Окисление вторичных спиртов приводит к образованию соответствующих кетонов.
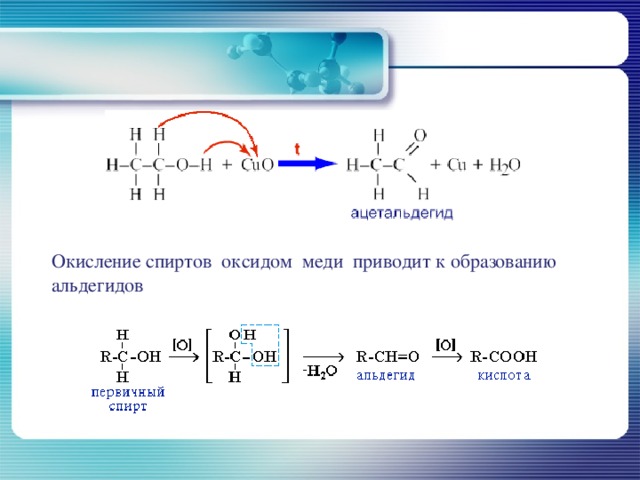
Окисление спиртов оксидом меди приводит к образованию альдегидов
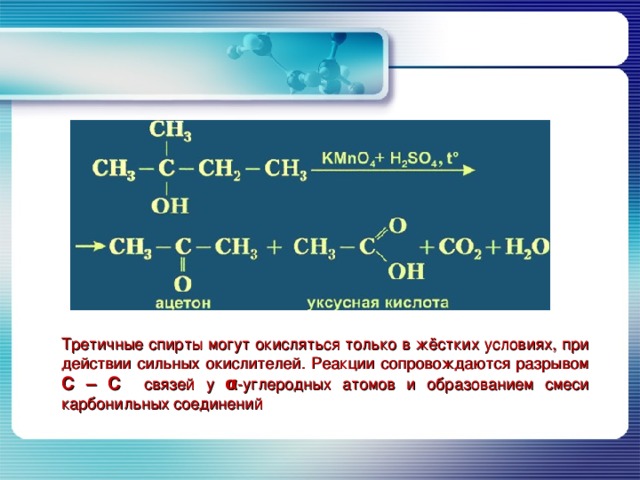
Третичные спирты могут окисляться только в жёстких условиях, при действии сильных окислителей. Реакции сопровождаются разрывом С – С связей у α -углеродных атомов и образованием смеси карбонильных соединений

Метанол и этанол
Метанол получают гидрированием оксида углерода ( II ) СО. В настоящее время разработан способ получения метанола частичным восстановлением углекислого газа. При этом используется более дешёвое углеродсодержащее сырьё, но требуется большой объём водорода.
250-350 0 C, 5-30MПа
СН 3 ОН
CO+2H 2
ZnO+ZnCr 2 O 4
CH 3 OH+H 2 O
СO 2 +3H 2
t 0
кат
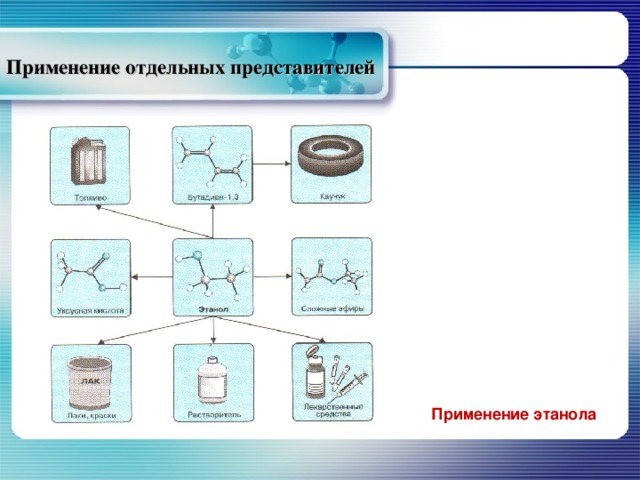
Применение отдельных представителей
Применение этанола

Наиболее распространённым методом получения этанола является ферментативное расщепление моносахаридов.
зимаза
С 6 H 10 O 5 ) n +nH 2 O
C 6 H 12 O 6
2С 2 Н 5 OH+2CO 2

Мировое производство мета-нола составляет около 10 мил-лионов тонн в год, этанола производится примерно на порядок больше. Метанол и этанол применяются в качестве растворителей и сырья в орга-ническом синтезе. Кроме того этанол используют в пищевой промышленности и в медицине.

Запомни
Водородная связь – это связь между атомом водорода одной молекулы и атомами с большой электоотрицательностью ( О, F , N , Cl ) другой моле-кулы.
Реакция этерификации – взаимодействие спир-тов с органическими и неорганическими кислотами с образованием сложных эфиров.



 Получите свидетельство
Получите свидетельство Вход
Вход























 R 2 CH – OH RCH 2 – OH Реакционная способность HX HI HBr HCl HF Реакция алканолов с галогеноводородными кислотами является обратимой. Эффективность её протекания зависит от строения алканола, природы галогеноводорода и условий проведения. Наиболее активными в данной реакции являются третичные алканолы и иодоводородная кислота " width="640"
R 2 CH – OH RCH 2 – OH Реакционная способность HX HI HBr HCl HF Реакция алканолов с галогеноводородными кислотами является обратимой. Эффективность её протекания зависит от строения алканола, природы галогеноводорода и условий проведения. Наиболее активными в данной реакции являются третичные алканолы и иодоводородная кислота " width="640"


























 Презентация по химии на тему: "Спирты" (4 MB)
Презентация по химии на тему: "Спирты" (4 MB)
 0
0 2147
2147 190
190 Нравится
0
Нравится
0






