"Железо и его соединения". 9-й класс
Образовательная цель: обеспечить усвоение знаний о важнейших соединениях железа +2 и +3, качественных реакциях на ионы железа +2 и +3, биологической роли железа, используя опорные знания о строении железа, демонстрацию занимательных опытов, сообщения учащихся, мультимедийное приложение.
Задачи:
Продолжить формировать умения составлять схемы строения атома, электронную формулу, графическую формулу; на основе этого определять степени окисления, окислитель, восстановитель.
Систематизировать знания о характере оксидов и гидроксидов со степенями окисления +2 и +3 на примере оксидов и гидроксидов железа +2 и +3.
Формировать умения сравнивать свойства важнейших соединений железа(II) и железа(III), научиться определять с помощью качественных реакций соединения, содержащие ионы Fe2+, Fe3+
Совершенствовать умения школьников из предложенных формул составлять генетические ряды, осуществлять цепочки превращений, составлять уравнения химических реакций.
Совершенствовать навыки работы с реактивами при выполнении опытов, соблюдать правила по ТБ.
Раскрыть значение железа в природе и жизни человека.
Развивающая цель:
Продолжить развитие:
мыслительных способностей: умения пользоваться опорными знаниями, умения сравнивать, обобщать, делать выводы, объяснять ход эксперимента;
навыков самостоятельности при работе с учебником, инструктивной картой и реактивами;
исследовательских навыков при исследовании свойств соединений железа(II) и железа (III) и проведении качественных реакций;
способности к рефлексии, коммуникативные умения.
Воспитывающая цель:
Продолжить воспитание:
положительной мотивации обучения, используя привлечение учащихся к подготовке занимательных опытов, сообщений о роли железа, лабораторной работы, мультимедийного сопровождения;
чувство ответственности при подготовке сообщений, выполнения домашнего задания;
правильной самооценки.
Тип урока: Комбинированный. Сообщение новых знаний и их совершенствование.
Оборудование: Периодическая система химических элементов Д. И. Менделеева, таблица растворимости веществ, таблица “Генетические ряды неорганических веществ”, тесты, презентация “Соединения железа”, Коллекция минералов: красный железняк, бурый железняк, магнитный железняк, железный колчедан.
Реактивы:
Для занимательного опыта: скальпель, вата, пинцет, растворы: FeCI3 растворы: FeCI3, KSCN, желтая кровяная соль K4[Fe(CN)6], красная кровяная соль K3[Fe(CN)6], нашатырный спирт.
Ход урока
1. Организационный момент.
Среди металлов самый славный
Важнейший древний элемент. В тяжелой индустрии – главный
Знаком с ним школьник и студент.
Родился в огненной стихии
А сплав его течет рекой.
Важнее нет в металлургии
Он нужен всей стране родной.
О каком металле идет речь?
(Это железо.)
Учитель: Сегодня на уроке мы продолжим изучение металла 8 группы, побочной подгруппы Fe и рассмотрим его соединения. А для этого нам необходимо повторить те сведения о железе, которые вы приобрели на прошлом уроке.
2. Проверка знаний (индивидуальный опрос).
Цель: повторение изученного материала, необходимого для открытия “нового знания” и выявления затруднений в работе учащихся.
1-й ученик. Написать на доске схему строения атома железа, электронную и графическую формулы. Какие степени окисления может проявлять железо? Окислитель или восстановитель?
Проверка: (. Слайд 2)
2-й ученик. Написать на доске уравнения реакций взаимодействия железа с простыми веществами: хлором, серой, кислородом. Расставить степени окисления, уравнять методом электронного баланса. Проверка (Слайд 3)
3-й ученик. Написать уравнения реакций взаимодействия железа со сложными веществами: с растворами кислот, солей, водой при нагревании. Для одной из реакций ионного обмена написать полное и сокращенное ионное уравнение. (Слайд 4)
4-й ученик. Рассказать о распространенности железа в земной коре. Назвать важнейшие руды железа. Описать по презентации.
3. Обобщение по опросу.
Беседа:
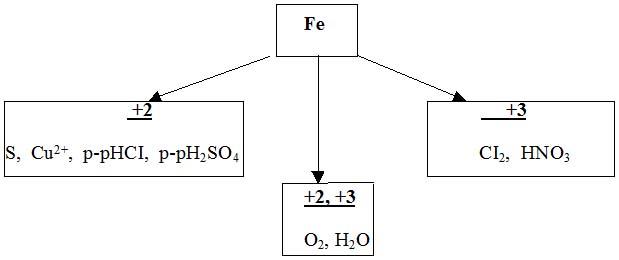
Какие степени окисления может проявлять железо?
В каких случаях образуются соединения железа(II)?
Планируемый ответ: При действии на железо слабых окислителей, например, растворов кислот (кроме HNO3), солей и простых веществ, например, серы.А как можно получить соединения железа(III)?
Планируемый ответ: При действии сильных окислителей на железо, например, галогенов, раствора азотной кислоты.Почему концентрированные азотную и серную кислоты можно перевозить в железной таре?
Планируемый ответ: они пассивируют железо и реакции с ними не происходит.
Учитель: Железо дает два ряда соединений, соответствующих степени окисления +2, +3. Степень окисления Fe зависит от окислительной способности реагирующего вещества. У сильных окислителей железо принимает степень окисления +3, у более слабых +2.
Ученики записывают схему в тетрадь. (Слайд 6)
Актуализация знаний
Какие соединения образуют металлы со степенью окисления +2? (Планируемый ответ: основные оксиды, основания, соли.)
Какие соединения образуют металлы со степенью окисления +3? (Планируемый ответ: амфотерные оксиды, амфотерные гидроксиды, соли.)
Сделайте вывод о характере оксида и гидроксида железа со степенью окисления +2 (Планируемый ответ: FeO – oсновный оксид, Fe(OH)2 – основание.)
Сделайте вывод о характере оксида и гидроксида железа со степенью окисления +3. (Планируемый ответ: Fe2O3 – амфотерный оксид, Fe(OH)3 – амфотерный гидроксид.)
Какие химические свойства следует ожидать от этих соединений? (Планируемый ответ: взаимодействуют с кислотами, амфотерные окиды и гидроксиды еще взаимодействуют и со щелочами, нерастворимые основания разлагаются при нагревании)
5. Формирование знаний о получении гидроксидов железа и качественных реакциях на ионы Fe2+, Fe3+.
Учитель: Как можно получить гидроксиды железа в лаборатории?
Предполагаемый ответ: нерастворимые основания можно получить при взаимодействии раствора соответствующей соли со щелочью.
Лабораторный опыт 1. Получение гидроксида железа(II) и гидроксида железа(III) (эксперимента проводится виртуально в видеофрагменте)
Что наблюдаете? Записать уравнения реакции.
Слайд 6 – уравнение реакций (самопроверка)
| FeCI2 + 2NaOH = Fe(OH)2↓ + 2NaCI | FeCI3 + 3NaOH = Fe(OH)3↓ + 3NaCI |
Вывод: Это один из способов распознавания соединений железа с различной степенью окисления, качественные реакции на ионы Fe2+ Fe3+.
Fe(OH)2 окисляется на воздухе: сначала зеленеет, потом приобретает бурую окраску.
(Демонстрация разрезанного яблока и пробирки с Fe(OH)2, на стенках которой видно как осадок становится бурого цвета.)
4Fe(OH)2 + 2H2O + O2 = 4Fe(OH)3 (Слайд 8)
Занимательный опыт по химии
Вот еще одно развлечение:
Кто даст руку на отсечение?
Пауза.
Жалко руку на отсечение?
Тогда нужен больной для лечения. (Приглашаю к столу ученика из класса.)
Оперирую без боли,
правда, будет много крови.
При каждой операции
Нужна стерилизация.(вместо йода раствор FeCI3.)
Йодом смочим мы обильно,
Чтобы было все стерильно. (Тампоном, смоченным раствором FeCI3, смазывает обильно руку “пациента”.)
Не вертитесь, пациент,
Нож возьмем! Скальпель “дезинфицирую” “спиртом” (раствором KSCN).
(делаю “разрез” ножом, смоченным обильно раствором KSCN, течет “кровь”.)
Посмотрите, прямо струйкой кровь течет,
А не вода!
Не волнуйтесь!
Живой водой я смою руку
И от раны – ни следа! (Смывает “кровь” ваткой, смоченной раствором нашатырного спирта.)
Конечно, эта кровь не настоящая и рана – тоже, зато помогает определить в растворе ионы Fe3+. “Йод” – в нашем случае – это раствор FeCI3, а спирт – это роданид калия KSCN. А реакция между ними – это еще одна качественная реакция на ионы Fe3+.
Кроме перечисленных реакций, ионы Fe2+ и Fe3+ можно определить и с помощью других реактивов – желтой кровяной соли K4[Fe(CN)6] и красной кровяной соли K3[Fe(CN)6]. Качественные реакции на ионы железа мы внимательно посмотрим.
Реактив – желтая кровяная соль K4 [Fe(CN)6]
Результат воздействия – синий осадок берлинской лазури.
K4 [Fe(CN)6] + FeCI3 = 3KCI + KFe[Fe(CN)6]
Реактив – красная кровяная соль K3[Fe(CN)6].
Результат воздействия – синий осадок (турнбулевой сини)
FeCI2 + K3[Fe(CN)6] = 2КCI + KFe[Fe(CN)6]↓
Вывод:
Реактивами на ионы Fe2+ являются щелочи и красная кровяная соль K3[Fe(CN)6].
Реактивами на ионы Fe3+ являются щелочи, роданид калия и желтая кровяная соль K4[Fe(CN)6].
Учащиеся записывают уравнения качественных реакций в тетради и выводы. (Слайд 9)
(Конструирование схем из приведенных формул.) (Слайд 14)
| FeCI2 | Fe | FeCI3 |
| Fe(OH)2 | Fe3O4 | Fe(OH)3 |
| FeO | FeSO4 | Fe2O3 |
Из приведенных формул составить схемы генетических рядов:
Вариант 1. От оксида железа(II) до железа.
Вариант 2. От железа до оксида железа(III).
Написать уравнения соответствующих реакций.
Ответы учеников проверяются по слайду.
Какова же биологическая роль железа и его соединений?
Примерный ответ: Железо - это биогенный элемент. Он входит в состав гемоглобина, миоглобина, различных ферментов и других сложных железо-белковых комплексов, которые находятся в печени и селезенке. В организме взрослого человека имеется 4-5 г железа, из них 65% - в крови. Железо стимулирует функцию кроветворных органов. Красный пигмент крови – гемоглобин – осуществляет перенос кислорода от органов дыхания к тканям и обратный перенос углекислого газа от тканей к легким.
Много железа содержится в коровьем и козьем молоке, яичном желтке.
У растений железо в порфиринах, которые отвечают за синтез хлорофилла. При недостатке железа растения не образуют хлорофилла (что разрушает процесс фотосинтеза), теряют возможность ассимилировать углекислый газ и выделять кислород, у животных и человека развивается анемия (малокровие).
Основные источники железа:
Зеленные овощи;
Яичный желток;
Печень;
Горошек зеленый;
Томаты сырые;
Капуста;
Чеснок;
Яблоки, груши;
Земляника;
Сухофрукты.
Тест “Порядок ли у вас с железом”.
На вопросы отвечайте либо “да”, либо “нет”.
1. Часто ли вы чувствуете усталость и подавленность?
2. Произошли ли у вас в последнее время изменения кожи, волос и ногтей?
3. Теряли ли вы в последнее время много крови?
4. Занимаетесь ли вы профессиональным спортом?
5. Вы редко или совсем не едите мясо?
6. Выпиваете ли вы более трех чашек чая или кофе в день?
7. Вы едите мало овощей?
Если на большинство вопросов вы ответили “нет”, то ваш организм в достаточной степени обеспечен железом.
Работа в группах
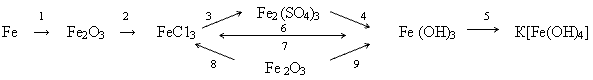
Или
Кроссворд
К каким металлам относится железо по своей плотности? (Тяжелые)
Так железо называли древние египтяне? (Вааепере)
Как называется самородное железо земного происхождения. (Теллурическое)
В состав чего входило железо с которым впервые познакомились древние люди? (Метеорит)
В какой пустыне находится самый крупный метеоритный кратер? (Аризона)
Белок крови, в состав которого входит железо. (Гемоглобин)
|
| Т | Я | Ж | Е | Л | Ы | Е |
| ||||||
| В | А | А | Е | П | Е | Р | Е |
| ||||||
|
| Т | Е | Л | Л | У | Р | И | Ч | Е | С | К | О | Е | |
| М | Е | Т | Е | О | Р | И | Т |
|
| |||||
| А | Р | И | З | О | Н | А |
| |||||||
| Г | Е | М | О | Г | Л | О | Б | И | Н | |||||
Или
Разгадав ключевые слова и заменив цифры буквами по горизонтальным рядам, прочитайте отрывок из стихотворения Николая Рыленкова, объясните его смысл.
| 2 | 13 | 15 | 13 | 2 | 1 |
| 16 |
| 14 | 15 | 7 | 15 |
| 13 | 6 | 13 | 9 | ? |
| 12 | 6 | 17 | , |
| 11 | 12 |
| 6 |
| 16 | 17 | 15 | 1 | 12 | 12 | 13 |
| 16 | 10 | 22 |
| 18 | 1 | 17 | 10 |
| э | 17 | 13 | . |
| 2 | 13 | 15 |
| 19 | 2 | 25 |
| 3 | 6 | 5 | 25 | 17 |
| 16 |
| 3 |
| 15 | 1 | 4 | 13 | 11 | , |
| 1 |
| 12 | 1 | 11 |
|
| 14 | 15 | 7 | 15 | 13 | 5 | 1 | -- | 11 | 1 | 17 | 19 | . |
Бог войны, атрибуты которого использовали алхимики для обозначения железа – 11, 1, 15, 16
Зеленый овощ, содержащий железо – 18, 14, 7, 12, 1, 17.
Один важных компонентов крови, содержащее железо – 4, 6, 11, 13, 4, 10, 13, 2, 7, 12
Природное соединение железа, называемое еще пирит – 16, 6, 15, 12,22, 9 8, 13, 10, 23, 6, 5, 1, 12
Лабораторный прибор, используется для закрепления пробирок – 18, 14, 1, 17, 7, 3
Минерал, содержащий железо – 24, 1, 10, 19, 8, 13, 14, 7, 15, 7, 17
Состояние здоровья человека, при лечении которого используются железосодержащие препараты – 25, 14, 1, 5, 13, 8 16, 7, 10
Ответ: марс, шпинат, гемоглобин, серный колчедан, штатив, халькопирит, упадок сил.
Борьба с природой?
Нет, мне странно слышать это.
Борьбу ведут с врагом,
А нам природа – мать.
Н. Рыленков
Закрепление знаний тест по теме
| Тестирование Железо. Соединения железа.
Вариант 1
а) Ag; б) Сu; в) Fe; г) Hg. 2. При горении железа в кислороде образуется. а) FeO . б) Fe2 O3 . в) Fe3O4 . 3. Гидроксид железа (III) проявляет свойства : а) амфотерные; б) кислотные; в) основные.
4. Электронная формула внешнего энергетического уровня и предвнешнего d – подуровня: а)…3d6 4s2; б) …3d74s2; в) … 3d84s2 . 5.При взаимодействии солей Fe3+ со щелочами образуется осадок: а) белого цвета; б) зеленого цвета; в) бурого цвета. 6. Соли железа (III) получают при взаимодействии железа а) с растворами кислот; б) с концентрированными растворами. 7. Химическое соединение Fe3O4 называется: а) магнетит; б) лимонит; в) пирит. 8. Гидроксид железа (III) проявляет свойства : а) амфотерные; б) кислотные; в) основные. 9. При взаимодействии, с какими веществами железо образует соединения со степенью окисления +3? А) СI2 Б)S В) p-рHCIГ) HNO3
| Тестирование Железо. Соединения железа.
Вариант 2.
А) О2Б) Na2O В) p-рH2SO4 Г) СО2 2. .При взаимодействии солей Fe2+ со щелочами образуется осадок: а) белого цвета; б) зеленого цвета;а) бурого цвета 3. Гидроксид железа (II) проявляет свойства: а) амфотерные; б) кислотные; в) основные. 4. Формула соли, с водным раствором которой реагирует железо: а) Zn (NO3)2; б) Mn (NO3);в) Pb (NO3)2 ;г) Ca(NO3)2.
5. Соли железа (II) получают при взаимодействии железа а) с растворами кислот; б) с концентрированными кислотами. 6. Химическое соединение FeS2 называется: а) магнетит; б) гематит; в) пирит. 7. Оксид железа (3) проявляет свойства а) кислотные; б) основные; в) амфотерные. 8. В состав гемоглобина крови человека входит: а) железо; б) медь; в) золото.
А) СI2 Б) S В) p-рHCIГ) HNO3
|
Домашнее задание:

 Получите свидетельство
Получите свидетельство Вход
Вход












 Открытый урок в 9 классе по теме "Железо" (63.47 KB)
Открытый урок в 9 классе по теме "Железо" (63.47 KB)
 0
0 1059
1059 82
82 Нравится
0
Нравится
0


