
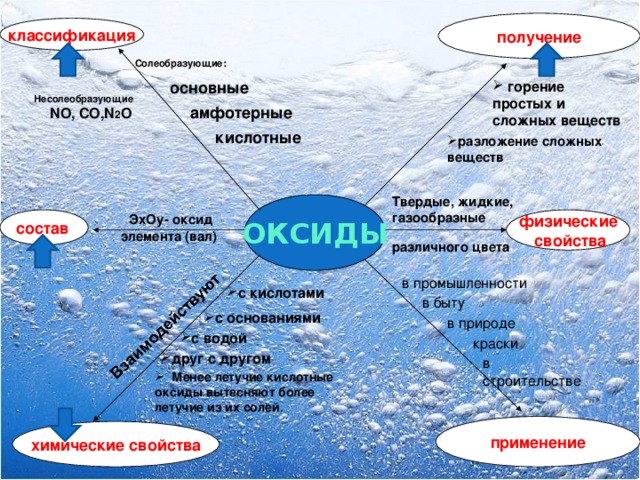
Блок- схема по теме «Оксиды»
Воронова Галина Владимировна,
учитель химии МБОУ «СОШ №4 с углубленным изучением отдельных предметов» г.Усинска
получение
классификация
Солеобразующие:
основные
- горение простых и сложных веществ
Несолеобразующие
NO, CO,N 2 O
амфотерные
кислотные
- разложение сложных веществ
Твердые, жидкие, газообразные
ОКСИДЫ
ЭхО y - оксид элемента (вал)
состав
физические
свойства
различного цвета
в промышленности
в быту
в природе
краски
в строительстве
- Менее летучие кислотные оксиды вытесняют более летучие из их солей .
применение
химические свойства

1. Из приведенного перечня веществ выберите оксиды, дайте им названия : Al 2 O 3 , CH 4 , Cu(OH) 2 , SO 3 , MgO, H 2 S, HCl, N 2 O 5 , NH 3 , H 2 SO 4 , MgCl 2 , Fe 2 O 3 , P 2 O 5
Al 2 O 3 ( оксид алюминия) , SO 3 (оксид серы (VI)) , MgO (оксид магния) , N 2 O 5 (оксид азота (V)) , Fe 2 O 3 (оксид железа ( III )) , P 2 O 5 ( оксид фосфора ( V))

2. Проклассифицируйте оксиды:
CuO, Al 2 O 3 , FeO, MnO 2 , BaO, MnO, BeO,
Mn 2 O 7 , K 2 O, CO 2 ,P 2 O 5
Основные
Кислотные
Амфотерные
Mn 2 O 7 , CO 2 , P 2 O 5
CuO , FeO , BaO , MnO , K 2 O
Al 2 O 3 , BeO , MnO 2
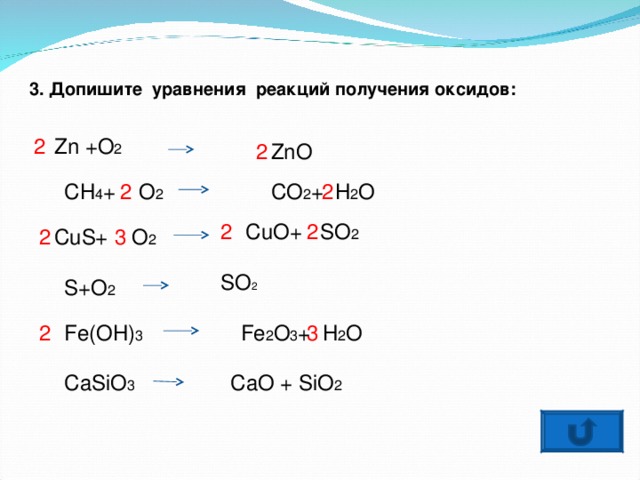
3. Допишите уравнения реакций получения оксидов:
2
Zn +O 2
ZnO
2
2
2
С O 2 + H 2 O
CH 4 + O 2
CuO+ SO 2
2
2
CuS+ O 2
3
2
SO 2
S+O 2
Fe 2 O 3 + H 2 O
Fe(OH) 3
3
2
CaO + SiO 2
CaSiO 3
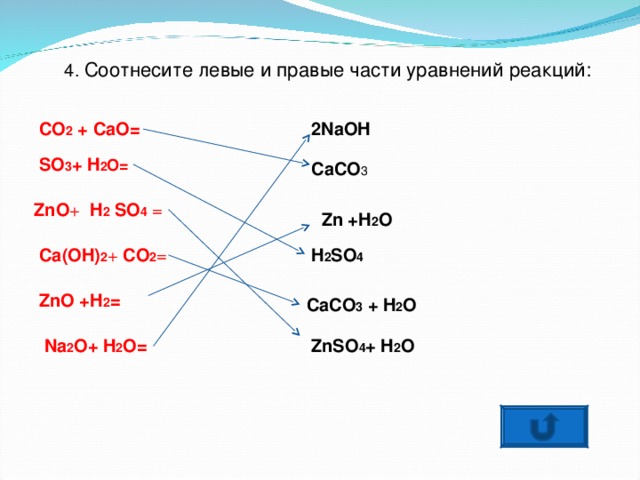
4 . Соотнесите левые и правые части уравнений реакций:
2NaOH
CO 2 + CaO=
SO 3 + H 2 O=
CaCO 3
ZnO + H 2 SO 4 =
Zn +H 2 O
H 2 SO 4
Ca(OH) 2 + CO 2 =
ZnO +H 2 =
CaCO 3 + H 2 O
ZnSO 4 + H 2 O
Na 2 O+ H 2 O=


 Получите свидетельство
Получите свидетельство Вход
Вход

















 Оксиды (0.81 MB)
Оксиды (0.81 MB)
 0
0 1310
1310 147
147 Нравится
0
Нравится
0








