ОКСИДЫ
Оксиды-сложные вещества, состоящие из двух химических элементов, один из которых кислород в степени окисления -2 .
Понятие оксиды включает бесконечное разнообразие веществ: жидкие, например оксид водорода, или вода; твердые, например оксид кремния — песок и множество разновидностей кварца, среди которых халцедон и аметист, горный хрусталь и морион; газообразные, например оксиды углерода — углекислый и угарный газы.
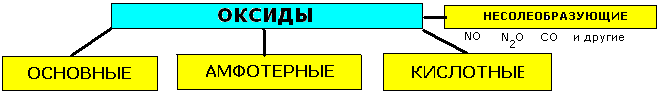
По своим химическим свойствам все оксиды подразделяются на солеобразующие и несолеобразующие.
Несолеобразующими оксидами называются такие оксиды, которые не взаимодействуют ни с кислотами, ни со щелочами и не образуют солей.Несолеобразующих оксидов немного.
В их состав входят элементы — неметаллы, например: оксиды азота (I и II), оксид углерода (II) — СО и некоторые другие.
Солеобразующими называются такие оксиды, которые взаимодействуют с кислотами или основаниями и образуют при этом соль и воду.
Среди солеобразующих оксидов различают оксиды основные и кислотные
Основные оксиды
Основные оксиды - это сложные химические вещества, относящиеся к окислам, которые образуют соли при химической реакции с кислотами или кислотными оксидами и не реагируют с основаниями или основными оксидами. Например, к основным относятся следующие:
K2O (окись калия), CaO (окись кальция), FeO (окись железа 2-валентного).
Рассмотрим химические свойства оксидов на примерах
1. Взаимодействие с водой:
- взаимодействие с водой с образованием основания (или щёлочи)
CaO+H2O = Ca(OH)2 (известная реакция гашения извести, при этом выделяется большое количества тепла!)
2. Взаимодействие с кислотами:
- взаимодействие с кислотой с образованием соли и воды (раствор соли в воде)
CaO+H2SO4 = CaSO4+ H2O (Кристаллы этого вещества CaSO4 известны всем под названием "гипс").
3. Взаимодействие с кислотными оксидами: образование соли
CaO+CO2=CaCO3 (Это вещество известно всем - обычный мел!)
Кислотные оксиды
Кислотные оксиды - это сложные химические вещества, относящиеся к окислам, которые образуют соли при химическом взаимодействии с основаниями или основными оксидами и не взаимодействуют с кислотными оксидами.
Примерами кислотных окислов могут быть:
CO2 (всем известный углекислый газ), P2O5 - оксид фосфора (образуется при сгорании на воздухе белого фосфора), SO3 - триокись серы - это вещество используют для получения серной кислоты.
- химическая реакция с водой
CO2+H2O=H2CO3 - это вещество - угольная кислота - одна из слабых кислот, её добавляют в газированную воду для "пузырьков" газа. С повышением температуры растворимость газа в воде уменьшается, а его излишек выходит в виде пузырьков.
- реакция со щелочами (основаниями):
CO2+NaOH=Na2CO3 - образовавшееся вещество (соль) широко используется в хозяйстве. Её название - кальцинированная сода или стиральная сода, - отличное моющее средство для подгоревших кастрюль, жира, пригара. Голыми руками работать не рекомендую!
- реакция с основными оксидами:
CO2+MgO=MgCO3 - получившая соль - карбонат магния - ещё называется "горькая соль".
Амфотерные оксиды
Амфотерные оксиды - это сложные химические вещества, также относящиеся к окислам, которые образуют соли при химическом взаимодействии и с кислотами (или кислотными оксидами) и основаниями (или основными оксидами). Наиболее частое применение слово "амфотерный" в нашем случае относится к оксидам металлов.
Примером амфотерных оксидов могут быть:
ZnO - окись цинка (белый порошок, часто применяемый в медицине для изготовления масок и кремов), Al2O3 - окись алюминия (называют еще "глинозёмом").
Химические свойства амфотерных оксидов уникальны тем, что они могут вступать в химические реакции, соответствующие как основаниями так и с кислотами. Например:
- реакция с кислотным оксидом:
ZnO+H2CO3 = ZnCO3 + H2O - Образовавшееся вещество - раствор соли "карбоната цинка" в воде.
- реакция с основаниями:
ZnO+2NaOH=Na2ZnO2+H2O - полученное вещество - двойная соль натрия и цинка.
Получение оксидов
Получение оксидов производят различными способами. Это может происходить физическим и химическим способами. Самым простым способом является химическое взаимодействие простых элементов с кислородом. Например, результатом процесса горения или одним из продуктов этой химической реакции являются оксиды. Например, если раскалённое железный прутик, да и не только железный (можно взять цинк Zn, олово Sn, свинец Pb, медь Cu, - вообщем то, что имеется под рукой) поместить в колбу с кислородом, то произойдёт химическая реакция окисления железа, которая сопровождается яркой вспышкой и искрами. Продуктом реакции будет чёрный порошок оксида железа FeO:
2Fe+O2=2FeO
Полностью аналогичны химические реакции с другими металлами и неметаллами, Например: Цинк сгорает в кислороде с образованием окисла цинка
2Zn+O2=2ZnO
Горение угля сопровождается образованием сразу двух окислов: угарного газа и углекислого газа
2C+O2=2CO - образование угарного газа.
C+O2=CO2 - образование углекислого газа. Этот газ образуется если кислорода имеется в более, чем достаточном количестве, то есть в любом случае сначала протекает реакция с образованием угарного газа, а потом угарный газ окисляется, превращаясь в углекислый газ.
Получение оксидов можно осуществить другим способом - путём химической реакции разложения. Например, для получения окисла железа или окисла алюминия необходимо прокалить на огне соответствующие основания этих металлов:
Fe(OH)2=FeO+H2O
2Al(OH)3=Al2O3+3H2O,
а также при разложении отдельных кислот:
H2CO3=H2O+CO2 - разложение угольной кислоты
H2SO3=H2O+SO2 - разложение сернистой кислоты
Получение оксидов можно осуществить из солей металлов при сильном нагревании, например:
CaCO3=CaO+CO2 - прокаливанием мела получают окись кальция (или негашенную известь) и углекислый газ.
Cu(NO3)2 = 2CuO + 4NO2 + O2 - в этой реакции разложения получается сразу два окисла: меди CuO (чёрного цвета) и азота NO2 (его ещё называют бурым газом из-за его действительно бурого цвета).
Ещё одним способом, которым можно осуществить получение окислов - это окислительно-восстановительные реакции, например
Cu + 4HNO3(конц.) = Cu(NO3)2 + 2NO2 + 2H2O
S + H2SO4(конц.) = 3SO2 + 2H2O
Таким образом, все выше сказанное можно представить в виде схемы:
Рассмотрим примеры решений
Укажите группу основных оксидов
а) CuO; Cu2O; SO3; б) SO2; P2O5; CO2; в) K2O; CaO;BaO;г) Na2O; N2O5; BaO.
Ответ: т.к. основные оксиды образуют металлы и им соответствуют основания то ответ в)
В какой группе веществ, приведены формулы кислотных оксидов
а)AL2O3; K2O; MgO; б) SO3;SO2; N2O5;в)SO2; ZnO; H2O;г)CuO; BaO; Na2O?
Ответ: т.к. кислотные оксиды образуют неметаллы и им соответствуют кислоты то ответ б)
3. Какое из веществ, взаимодействует с водой при комнатной температуре?
а) оксид кремния (IV); б) оксид меди (II); в) оксид серы (VI)
Ответ: в) т.к. SO3 + H2O = H2SO4 , кислотные оксиды реагируют с водой с образованием кислот, исключение SiO2.
4. Какое из веществ не взаимодействует с соляной кислотой
а) оксид углерода (IV); б) оксид кальция; в) кальций
Ответ: а) т.к. с кислотами не взаимодействует кислотный оксид CO2
5. Оксид кальция не взаимодействует с
а) оксидом углерода (IV); б) гидроксидом натрия; в) водой
Ответ: б) т.к. основные оксиды не реагируют со щелочами.
6. Оксид магния реагирует с каждым из веществ
а) HCl и SO3; б) SO3 и NaOH; в) NaOH и H2О
Ответ: а) т.к. основные оксиды (MgO) реагируют с кислотами (HCl) и кислотными оксидами (SO3)
MgO + 2HCl = MgCl2 + H2O
MgO + SO3 = MgSO4
7. Оксид серы (IV) реагирует с
а) NaOH ;б) NaCl; в) H2SO4
Ответ: а) т.к. оксид серы (IV) является кислотным оксидом и может реагировать со щелочью
NaOH + SO2 = Na2SO3 + H2O
Тест по теме
Часть А. Выберите один правильный ответ.
1. Кислотный оксид – это:
1) CO 2) CaO 3) N2O 4) P2O5
2. Из приведенного списка веществ : оксид углерода (IV), оксид азота (II), оксид меди (II), оксид углерода (II), к основным оксидам относятся
1) один 2)два 3) три 4) четыре
3. Кислотным оксидом и кислотой соответственно являются
1) CO, H2S 2)AI2O3, Ca(OH)2 3) SO2, NH3 4)N2O5, HCIO4
4. Основным оксидом и основанием соответственно являются
1) ZnO, HCI 2) CO, NaOH 3) CaO, Ca(OH)2 4) K2O, KBr
5.Осуществима реакция между
1) CuO и NO 2) SO3 и SiO2 3) CO2 и CaO 4) HgO и H2O
6. Химическая реакция возможна между
1) оксидом фосфора (V) и гидроксидом калия;
2) оксидом кремния и соляной кислотой;
3) оксидом алюминия и водой;
4) оксидом цинка и кислородом;
7. При взаимодействии оксида кальция с водой образуется (-ются)
1) соль и вода 2) основание 3) кислота 4) щелочь и водород
8. Оксиду меди (I) и гидроксиду меди (I) соответствуют формулы
1) CuO и CuOH ; 2) CuO и Cu(OH)2; 3) Cu2O и Cu(OH)2; 4) Cu2O и CuOH
9. При взаимодействии оксида серы (VI) с водой образуется(-ются)
1) соль и вода 2) основание 3) кислота 4) кислота и водород
10. С оксидом углерода (IV) реагирует каждое из двух веществ:
1) фосфорная кислота и вода 3) гидроксид натрия и вода
2) оксид магния и сера 4) оксид железа (III) и водород
Часть В. Из предложенного перечня веществ выберите два правильных ответа:
Ответы: 1-4; 2-1; 3-4; 4-3; 5-3; 6-1; 7-2; 8-4; 9-3; 10-3;
Часто задаваемые вопросы
1.Какие оксиды называют кислотными?
См. определение
2.Какие оксиды называют основными?
См. определение
3.Какие оксиды называют амфотерными?
См. определение
4.Какие оксиды относят к несолеобразующим?
См. схему


 Получите свидетельство
Получите свидетельство Вход
Вход












 Материал к уроку химии "Оксиды" (29.63 КB)
Материал к уроку химии "Оксиды" (29.63 КB)
 0
0 519
519 47
47 Нравится
0
Нравится
0







