Окислительно - восстановительные реакции в заданиях ОГЭ по химии
Работу выполнила:
учитель химии и биологии
МБОУ «Саук-Деринская СОШ №45»
Резниченко Майя Керимовна

HI + H 2 SO 4 → I 2 + H 2 S + H 2 O
«Никакая деятельность не может быть прочна, если она не имеет основы в личном интересе» Л.Н. Толстой
Окислительно- восстановительные реакции
ОВР – это реакция, идущая с изменением степени окисления элементов.

Многие реакции в природе являются окислительно- восстановительными, например фотосинтез, дыхание, горение и др.
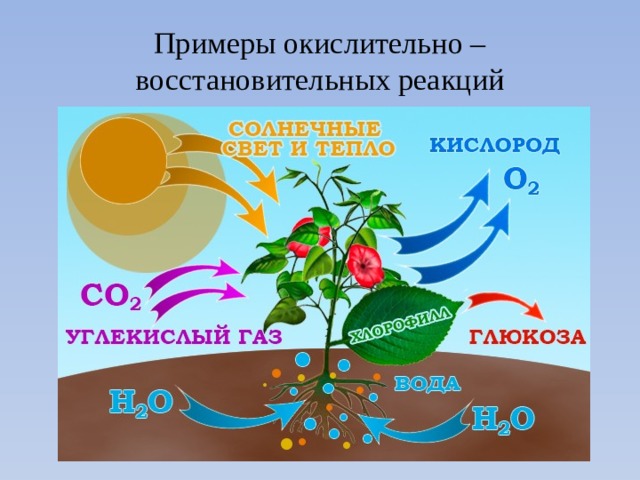
Примеры окислительно – восстановительных реакций

Примеры окислительно – восстановительных реакций

Примеры окислительно – восстановительных реакций

Примеры окислительно – восстановительных реакций
Степень окисления
условная величина, показывающая заряд атома в молекуле.
Степень окисления
Степень окисления никогда не показывает реальный заряд атома - это условная величина, принимаемая нами для удобства расчётов химических реакций .

Окислитель - это атом или ион в молекуле, который забирает электроны

Восстановитель –
это атом или ион в молекуле, который отдает электроны

Окислитель в ходе реакции восстанавливается, а восстановитель - окисляется
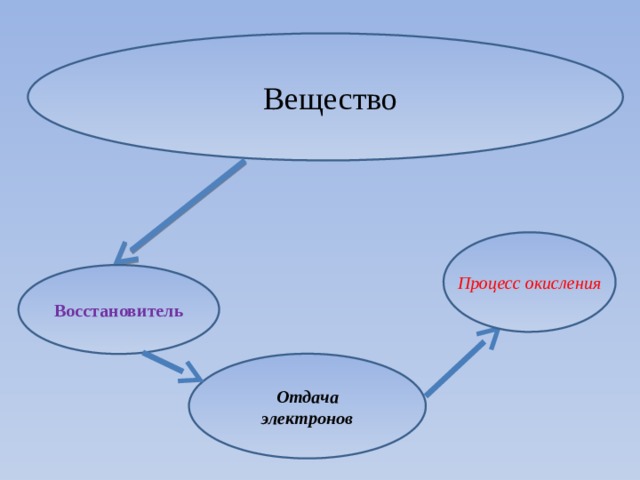
Вещество
Процесс окисления
Восстановитель
Отдача электронов
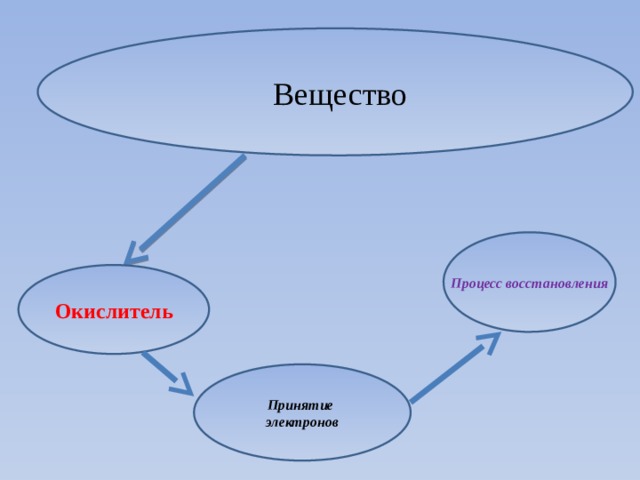
Вещество
Процесс восстановления
Окислитель
Принятие электронов

Для запоминания можно использовать следующий прием
ООВ
ВВО
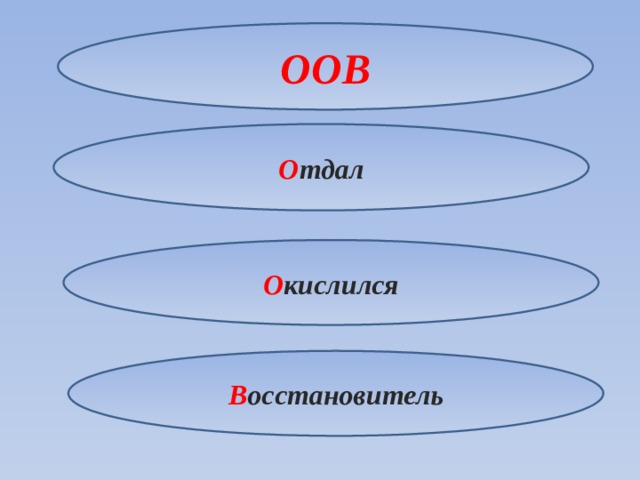
ООВ
О тдал
О кислился
В осстановитель
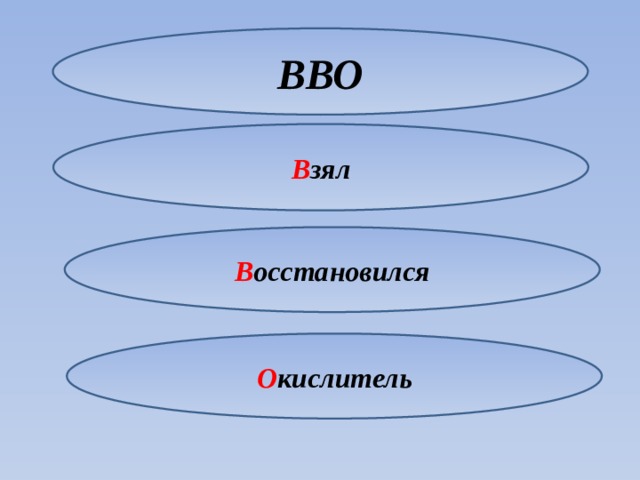
ВВО
В зял
Окислился
В осстановился
О кислитель
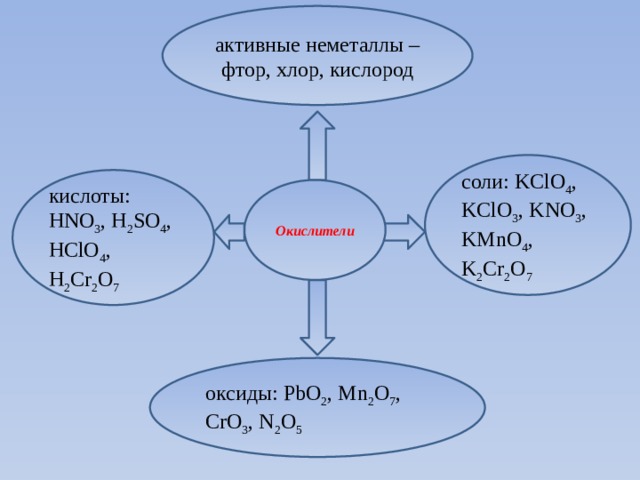
активные неметаллы – фтор, хлор, кислород
соли: KСlO 4 , KClO 3 , KNO 3 , KMnO 4 , K 2 Cr 2 O 7
кислоты: HNO 3 , H 2 SO 4 , HClO 4 , H 2 Cr 2 O 7
Окислители
оксиды: PbO 2 , Mn 2 O 7 , CrO 3 , N 2 O 5
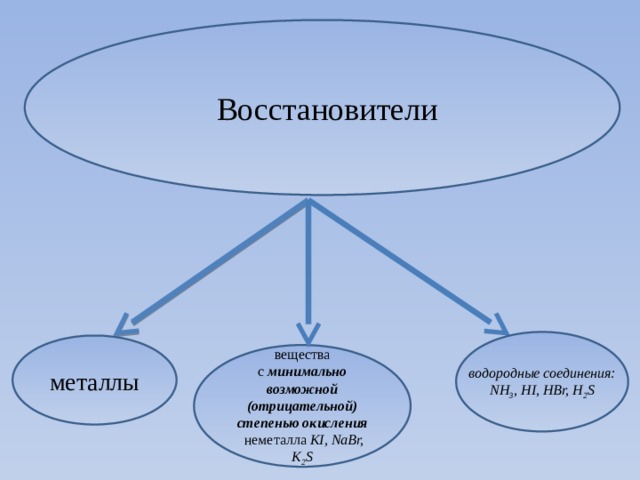
Восстановители
водородные соединения: NН 3 , HI, HBr, H 2 S
металлы
вещества с минимально возможной (отрицательной) степенью окисления
неметалла KI, NaBr, K 2 S
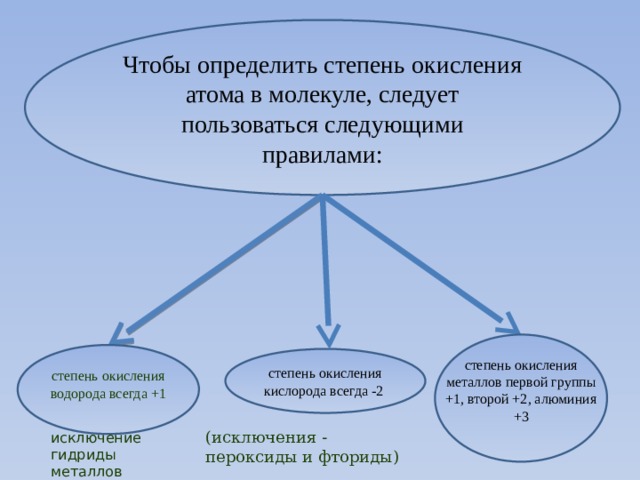
Чтобы определить степень окисления атома в молекуле, следует пользоваться следующими правилами:
степень окисления металлов первой группы +1, второй +2, алюминия +3
степень окисления водорода всегда +1
исключение гидриды металлов
степень окисления кислорода всегда -2
(исключения - пероксиды и фториды)
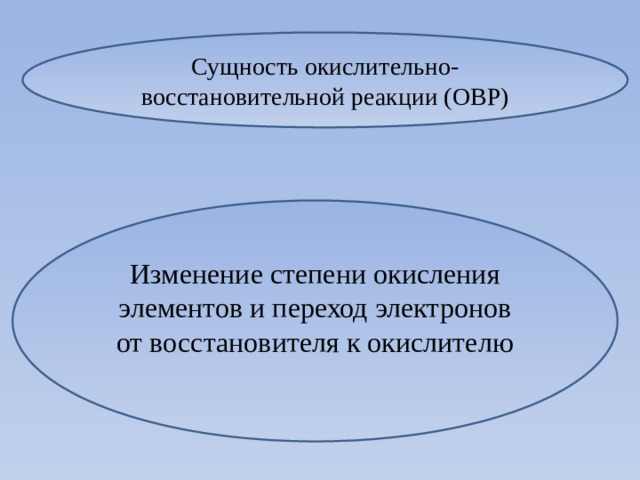
Сущность окислительно-восстановительной реакции (ОВР)
Изменение степени окисления элементов и переход электронов от восстановителя к окислителю
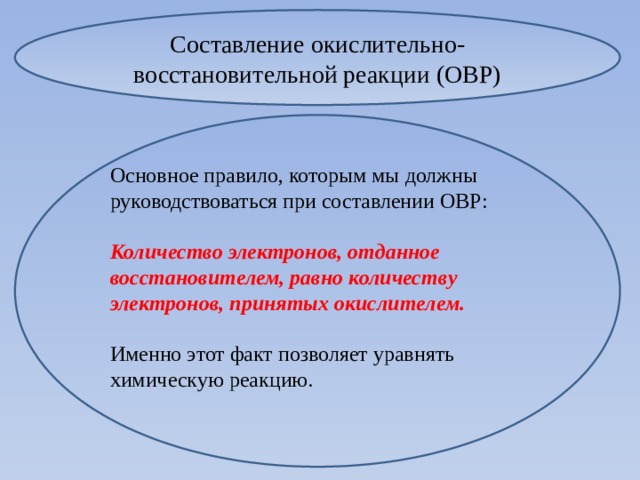
Составление окислительно-восстановительной реакции (ОВР)
Основное правило, которым мы должны руководствоваться при составлении ОВР:
Количество электронов, отданное восстановителем, равно количеству электронов, принятых окислителем.
Именно этот факт позволяет уравнять химическую реакцию.

Первый вариант задания
Сера является окислителем в реакции:
- H 2 S + I 2 = S + 2HI
- 3S + 2Al = Al 2 S 3
- 2SO 2 + О 2 = 2SO 3
- S + 3NO 2 = SO 3 + 3NO

Распишем первое уравнение:
H2S + I2 = S + 2HI
Исходные вещества:
- степень окисления серы в молекуле сероводорода равен -2, так как водород всегда +1
- степень окисления йода 0, так как это простое вещество
Продукты реакции:
- степень окисления серы 0, простое вещество
- степень окисления йода -1, так как водород +1
Анализируем:
- сера поменяла степень окисления с -2 до 0, значит отдала электроны - она восстановитель (но сама сера окислилась!)
- йод поменял степень окисления с 0 до -1, значит он принял электроны - окислитель (но сам по себе йод восстановился!)
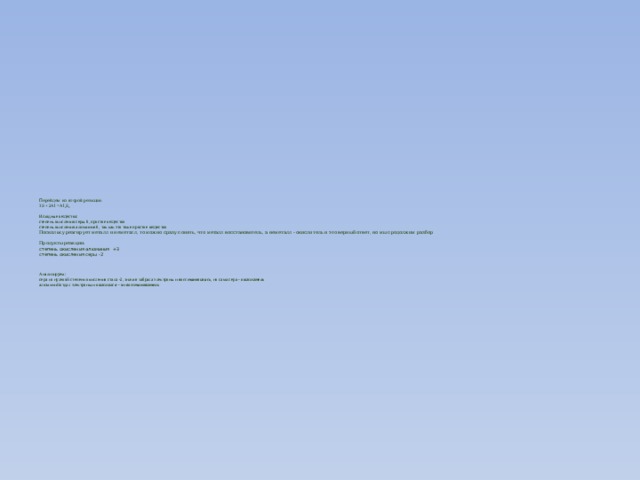
Перейдем ко второй реакции: 3S + 2Al = Al 2 S 3 Исходные вещества: степень окисления серы 0, простое вещество степень окисления алюминия 0, так как это тоже простое вещество Поскольку реагирует металл и неметалл, то можно сразу понять, что металл восстановитель, а неметалл - окислитель и это верный ответ, но мы продолжим разбор Продукты реакции: степень окисления алюминия +3 степень окисления серы -2 Анализируем: сера из нулевой степени окисления стала -2, значит забрала электроны и восстановилась , но сама сера - окислитель алюминий отдал электроны и окислился - он восстановитель

Третья реакция:
2SO 2 + О 2 = 2SO 3
Исходные вещества:
- степень окисления серы +4, так как у кислорода заряд -2, и их два атома
- степень окисления кислорода 0, так как это простое вещество
Поскольку реагирует кислород и образуется оксид, можно догадаться, что сера здесь выступает восстановителем и окисляется, докажем это:
Продукты реакции:
- степень окисления серы +6
- степень окисления кислорода -2
Анализируем:
- сера отдала последние два электрона и окислилась, являясь восстановителем
- кислород забрал электроны и восстановился, являясь окислителем

Последняя реакция:
S + 3NO2 = SO3 + 3NO
Исходные вещества:
- степень окисления серы 0, так как это простое вещество
- степень окисления азота +4, так как у кислорода -2, и их два атома
Продукты реакции:
- степень окисления серы +6, так как у кислорода степень окисления -2, и их три атома в молекуле
- степень окисления азота +2, так как у кислорода -2
Анализируем:
- сера отдала 6 электронов и окислилась, являясь восстановителем
- азот забрал электроны и восстановился, являясь окислителем
Ответ: 2

В 20 задании ОГЭ по химии необходимо полностью предоставить решение. Решение 20 задания - составление уравнения химической реакции методом электронного баланса.

Теперь рассмотрим метод электронного баланса на типовом примере, но перед этим вспомним, что это за метод и как им пользоваться.

Метод электронного баланса
Метод электронного баланса - метод уравнивания химических реакций, основанный на изменении степеней окисления атомов в химических соединениях.

Алгоритм наших действий выглядит следующим образом:
- Вычисляем изменение степени окисления каждого элемента в уравнении химической реакции
- Выбираем только те элементы, которые поменяли степень окисления
- Для найденных элементов составляем электронный баланс, заключающийся в подсчете количества приобретенных или отданных электронов
- Находим наименьшее общее кратное для переданных электронов
- Полученные значения и есть коэффициенты в уравнении (за редким исключением)
- Определить окислитель и восстановитель

Используя метод электронного баланса, расставьте коэффициенты в уравнении реакции, схема которой
HI + H 2 SO 4 → I 2 + H 2 S + H 2 O
Определите окислитель и восстановитель.

Итак, составляем электронный баланс. В данной реакции меняют степени окисления сера и йод .
Сера находилась в степени окисления +6, а в продуктах -2.
Йод имел степень окисления -1, а стал 0.
Если у Вас возникли трудности с расчетом, то вспомните, как рассчитывать степень окисления .

HI –1 + H 2 S +6 O 4 → I 2 0 + H 2 S –2 + H 2 O
1 | S +6 + 8ē → S –2 4 | 2I –1 – 2ē → I 2 0
Сера приняла 8 электронов, а йод отдал только два.
Наименьшее общее кратное 8, дополнительные множители 1 и 4
Расставляем коэффициенты в уравнении реакции согласно полученным данным :
8HI + H 2 SO 4 = 4I 2 + H 2 S + 4H 2 O
Не забываем указать, что сера в степени окисления +6 является окислителем , а иод в степени окисления –1 – восстановителем.

необходимо
обратить внимание на:
- тщательный анализ условия задания
- выяснение сущности описанных превращений
- получение максимальной информации из условия;
- проверку соответствия решения условию.
При подготовке к выполнению задания

А на экзамене…
«Сможешь.
Ибо ты обрел знание»
Ричард Бах

А на экзамене…
Всем уверенности в своих силах, успешной сдачи экзаменов и… везения!!!

 Получите свидетельство
Получите свидетельство Вход
Вход











 Окислительно-восстановительные реакции (919.19 KB)
Окислительно-восстановительные реакции (919.19 KB)
 0
0 609
609 29
29 Нравится
0
Нравится
0






